5.2.5. АКСОННЫЙ ТРАНСПОРТ
Наличие у нейрона
отростков, длина которых может достигать
1 м (например, аксоны, ин-нервирующие
мускулатуру конечностей), создает
серьезную проблему внутриклеточной
связи между различными участками нейрона
и ликвидации возможных повреждений его
отростков. Основная масса веществ
(структурных белков, ферментов,
полисахаридов, липидов и др.) образуется
в трофическом центре (теле) нейрона,
расположенном преимущественно около
ядра, а используются они в различных
участках нейрона, включая его отростки.
Хотя в аксонных окончаниях существуют
синтез медиаторов, АТФ и повторное
использование мембраны пузырьков после
выделения медиатора, все же необходима
постоянная доставка ферментов и
фрагментов мембран из тела клетки.
Для транспорта этих веществ (например,
белков) путем диффузии на расстояние,
равное максимальной длине аксона
(около 1 м), потребовалось бы 50 лет! Для
решения этой задачи эволюция
сформировала специальный вид транспорта
в пределах отростков нейрона, который
более хорошо изучен в аксонах и получил
название аксонного транспорта. С помощью
этого процесса осуществляется трофическое
влияние не только в пределах различных
участков нейрона, но и на иннервируе-
мые клетки. В
последнее время появились данные о
существовании нейроплазматичес-кого
транспорта в дендритах, который
осуществляется из тела клетки со
скоростью около 3 мм в сутки. Различают
быстрый и медленный аксонный транспорт.
А.
Быстрый аксонный транспорт идет
в двух направлениях: от тела клетки до
аксонных окончаний (антеградный
транспорт, скорость 250—400 мм/сут) и в
противоположном направлении
(ретроградный транспорт, скорость
200—300 мм/сут). Посредством анте-градного
транспорта в аксонные окончания
доставляются везикулы, образующиеся в
аппарате Гольджи и содержащие
гликопротеины мембран, ферменты,
медиаторы, липиды и другие вещества.
Посредством ретроградного транспорта
в тело нейрона переносятся везикулы,
содержащие остатки разрушенных структур,
фрагменты мембран, ацетилхоли-нэстераза,
неидентифицированные «сигнальные
вещества», регулирующие синтез белка
в соме клетки. В патологических условиях
по аксону к телу клетки могут
транспортироваться вирусы полиомиелита,
герпеса, бешенства и столбнячный
экзотоксин. Многие вещества, доставленные
путем ретроградного транспорта,
подвергаются разрушению в лизосомах.
Быстрый
аксонный транспорт осуществляется
с помощью специальных структурных
элементов нейрона: микротрубочек и
микрофиламентов, часть которых
представляет собой актиновые нити
(актин составляет 10—15 % белков нейрона).
Для транспорта необходима энергия АТФ.
Разрушение микротрубочек (например,
колхицином) и микрофиламентов
(цитохолазином В), снижение уровня АТФ
в аксоне более чем в 2 раза и падение
концентрации Са2+
блокируют аксонный транспорт.
Б.
Медленный аксонный транспорт
осуществляется
только в антеградном направлении и
представляет собой передвижение всего
столба аксоплазмы. Он выявляется в
опытах со сдавлением (перевязкой) аксона.
При этом происходит увеличение диаметра
аксона проксимальнее перетяжки в
результате «наплыва гиалоплазмы» и
утончение аксона за местом сдавления.
Скорость медленного транспорта равна
1—2 мм/сут, что соответствует скорости
роста аксона в онтогенезе и при его
регенерации после его повреждения. С
помощью этого транспорта перемещаются
образованные в эндоплазматической сети
белки микротрубочек и микрофиламентов
(тубулин, актин и др.), ферменты цитозоля,
РНК, белки каналов, насосов и другие
вещества. Медленный аксонный транспорт
не на-
рушается при
разрушении микротрубочек, но прекращается
при отделении аксона от тела нейрона,
что свидетельствует о разных механизмах
быстрого и медленного аксонного
транспорта.
В.
Функциональная роль аксонного транспорта.
1.
Антеградный и ретроградный транспорт
белков и других веществ необходимы для
поддержания структуры и функции аксона
и его пресинаптических окончаний, а
также для таких процессов, как аксонный
рост и образование синаптических
контактов.
2. Аксонный транспорт
участвует в трофическом влиянии
нейрона на иннервируемую клетку, так
как часть транспортируемых веществ
выделяется в синаптическую щель и
действует на рецепторы постсинаптической
мембраны и близлежащих участков мембраны
иннервируемой клетки. Эти вещества
участвуют в регуляции обмена веществ,
процессов размножения и дифференцировки
ин-нервируемых клеток, формируя их
функциональную специфику. Например,
в опытах с перекрестной иннервацией
быстрых и медленных мышц показано,
что свойства мышц меняются в зависимости
от типа иннервиру-ющего нейрона, его
нейротрофического воздействия.
Передатчики трофических влияний нейрона
до сих пор точно не определены, важное
значение в этом плане придается
полипептидам и нуклеиновым кислотам.
3. Роль аксонного
транспорта особенно ярко выявляется
при повреждении нерва. Если нервное
волокно на каком-либо участке прервано,
его периферический отрезок, лишенный
контакта с телом нейрона, подвергается
разрушению, которое называется
валле-ровской дегенерацией. В течение
2—3 сут наступает распад нейрофибрилл,
митохондрий, миелина и синаптических
окончаний. Надо отметить, что распаду
подвергается участок волокна, снабжение
которого кислородом и питательными
веществами с кровотоком не прекращается.
Считают, что решающим механизмом
дегенерации является прекращение
аксонного транспорта веществ от тела
клетки до синаптических окончаний.
4. Аксонный
транспорт играет важную роль и при
регенерации нервных волокон.
Соседние файлы в папке ВОЗБУДИМЫЕ ТКАНИ
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
From Wikipedia, the free encyclopedia
Axonal transport, also called axoplasmic transport or axoplasmic flow, is a cellular process responsible for movement of mitochondria, lipids, synaptic vesicles, proteins, and other organelles to and from a neuron’s cell body, through the cytoplasm of its axon called the axoplasm.[1] Since some axons are on the order of meters long, neurons cannot rely on diffusion to carry products of the nucleus and organelles to the end of their axons. Axonal transport is also responsible for moving molecules destined for degradation from the axon back to the cell body, where they are broken down by lysosomes.[2]
Dynein, a motor protein responsible for retrograde axonal transport, carries vesicles and other cellular products toward the cell bodies of neurons. Its light chains bind the cargo, and its globular head regions bind the microtubule, «inching» along it.
Movement toward the cell body is called retrograde transport and movement toward the synapse is called anterograde transport.[3][4]
Mechanism[edit]
The vast majority of axonal proteins are synthesized in the neuronal cell body and transported along axons. Some mRNA translation has been demonstrated within axons.[5][6] Axonal transport occurs throughout the life of a neuron and is essential to its growth and survival. Microtubules (made of tubulin) run along the length of the axon and provide the main cytoskeletal «tracks» for transportation. Kinesin and dynein are motor proteins that move cargoes in the anterograde (forwards from the soma to the axon tip) and retrograde (backwards to the soma (cell body)) directions, respectively. Motor proteins bind and transport several different cargoes including mitochondria, cytoskeletal polymers, autophagosomes, and synaptic vesicles containing neurotransmitters.
Axonal transport can be fast or slow, and anterograde (away from the cell body) or retrograde (conveys materials from axon to cell body).
Fast and slow transport[edit]
Vesicular cargoes move relatively fast (50–400 mm/day) whereas transport of soluble (cytosolic) and cytoskeletal proteins takes much longer (moving at less than 8 mm/day).[7] The basic mechanism of fast axonal transport has been understood for decades but the mechanism of slow axonal transport is only recently becoming clear, as a result of advanced imaging techniques.[8] Fluorescent labeling techniques (e.g. fluorescence microscopy) have enabled direct visualization of transport in living neurons. (See also: Anterograde tracing.)
Recent studies have revealed that the movement of cytoskeletal «slow» cargoes is actually rapid but unlike fast cargoes, they pause frequently, making the overall transit rate much slower. The mechanism is known as the «Stop and Go» model of slow axonal transport, and has been extensively validated for the transport of the cytoskeletal protein neurofilament.[9] The movement of soluble (cytosolic) cargoes is more complex, but appears to have a similar basis where soluble proteins organize into multi-protein complexes that are then conveyed by transient interactions with more rapidly moving cargoes moving in fast axonal transport.[10][11][12] An analogy is the difference in transport rates between local and express subway trains. Though both types of train travel at similar velocities between stations, the local train takes much longer to reach the end of the line because it stops at every station whereas the express makes only a few stops on the way.
Anterograde transport[edit]
Anterograde (also called «orthograde») transport is movement of molecules/organelles outward, from the cell body (also called soma) to the synapse or cell membrane.
The anterograde movement of individual cargoes (in transport vesicles) of both fast and slow components along the microtubule[4] is mediated by kinesins.[2] Several kinesins have been implicated in slow transport,[8] though the mechanism for generating the «pauses» in the transit of slow component cargoes is still unknown.
There are two classes of slow anterograde transport: slow component a (SCa) that carries mainly microtubules and neurofilaments at 0.1-1 millimeters per day, and slow component b (SCb) that carries over 200 diverse proteins and actin at a rate of up to 6 millimeters per day.[8] The slow component b, which also carries actin, are transported at a rate of 2-3 millimeters per day in retinal cell axons.
During reactivation from latency, the herpes simplex virus (HSV) enters its lytic cycle, and uses anterograde transport mechanisms to migrate from dorsal root ganglia neurons to the skin or mucosa that it subsequently affects.[13]
A cargo-receptor for anterograde transport motors, the kinesins, has been identified as the amyloid precursor protein (APP), the parent protein that produces the senile plaques found in Alzheimer’s disease.[14] A 15-amino acid peptide in the cytoplasmic carboxyl terminus of APP binds with high affinity to conventional kinesin-1 and mediates transport of exogenous cargo in the giant axon of the squid.[15]
Manganese, a contrast agent for T1-weighted MRI, travels by anterograde transport after stereotaxic injection into the brain of experimental animals and thereby reveals circuitry by whole brain MR imaging in living animals, as pioneered by Robia Pautler, Elaine Bearer and Russ Jacobs. Studies in kinesin-light chain-1 knockout mice revealed that Mn2+ travels by kinesin-based transport in the optic nerve and in the brain. Transport in both hippocampal projections and in the optic nerve also depends on APP.[16] Transport from hippocampus to forebrain is decreased in aging and destination is altered by the presence of Alzheimer’s disease plaques.[17]
Retrograde transport[edit]
Retrograde transport shuttles molecules/organelles away from axon termini toward the cell body. Retrograde axonal transport is mediated by cytoplasmic dynein, and is used for example to send chemical messages and endocytosis products headed to endolysosomes from the axon back to the cell.[2] Operating at average in vivo speeds of approximately 2 μm/sec,[18][19] fast retrograde transport can cover 10-20 centimeters per day.[2]
Fast retrograde transport returns used synaptic vesicles and other materials to the soma and informs the soma of conditions at the axon terminals. Retrograde transport carries survival signals from the synapse back to the cell body, such as the TRK, the nerve growth factor receptor.[20] Some pathogens exploit this process to invade the nervous system. They enter the distal tips on an axon and travel to the soma by retrograde transport. Examples include tetanus toxin and the herpes simplex, rabies, and polio viruses. In such infections, the delay between infection and the onset of symptoms corresponds to the time needed for the pathogens to reach the somata.[21] Herpes simplex virus travels both ways in axons depending on its life cycle, with retrograde transport dominating polarity for incoming capsids.[22]
Consequences of interruption[edit]
Whenever axonal transport is inhibited or interrupted, normal physiology becomes pathophysiology, and an accumulation of axoplasm, called an axonal spheroid, may result. Because axonal transport can be disrupted in a multitude of ways, axonal spheroids can be seen in many different classes of diseases, including genetic, traumatic, ischemic, infectious, toxic, degenerative and specific white matter diseases called leukoencephalopathies. Several rare neurodegenerative diseases are linked to genetic mutations in the motor proteins, kinesin and dynein, and in those cases, it is likely that axonal transport is a key player in mediating pathology.[23][24] Dysfunctional axonal transport is also linked to sporadic (common) forms of neurodegenerative diseases such as Alzheimer’s and Parkinson’s.[8] This is mainly due to numerous observations that large axonal accumulations are invariably seen in affected neurons, and that genes known to play a role in the familial forms of these diseases also have purported roles in normal axonal transport. However, there is little direct evidence for involvement of axonal transport in the latter diseases, and other mechanisms (such as direct synaptotoxicity) may be more relevant.
Arrest of axoplasmic flow at the edge of ischemic areas in vascular retinopathies leads to swelling of nerve fibres, which give rise to soft exudates or cotton-wool patches.
Since the axon depends on axoplasmic transport for vital proteins and materials, injury, such as diffuse axonal injury, which interrupts the transport, will cause the distal axon to degenerate in a process called Wallerian degeneration. Cancer drugs that interfere with cancerous growth by altering microtubules (which are necessary for cell division) damage nerves because the microtubules are necessary for axonal transport.
Infection[edit]
The rabies virus reaches the central nervous system by retrograde axoplasmic flow.[25] The tetanus neurotoxin is internalised at the neuromuscular junction through binding the nidogen proteins and is retrogradely transported towards the soma in signaling endosomes.[26] Neurotropic viruses, such the herpesviruses, travel inside axons using cellular transport machinery, as has been shown in work by Elaine Bearer’s group.[27][28] Other infectious agents are also suspected of using axonal transport.[29] Such infections are now thought to contribute to Alzheimer’s disease and other neurodegenerative neurological disorders.[30][31]
See also[edit]
- Intraflagellar transport
References[edit]
- ^ Sabry J, O’Connor TP, Kirschner MW (June 1995). «Axonal transport of tubulin in Ti1 pioneer neurons in situ». Neuron. 14 (6): 1247–56. doi:10.1016/0896-6273(95)90271-6. PMID 7541635.
- ^ a b c d Oztas E (2003). «Neuronal Tracing» (PDF). Neuroanatomy. 2: 2–5. Archived (PDF) from the original on 2005-10-25.
- ^ Karp G, van der Geer P (2005). Cell and molecular biology: concepts and experiments (4th ed.). John Wiley. p. 344. ISBN 978-0-471-46580-5.
- ^ a b Bear MF, Connors BW, Paradso MA (2007). Neuroscience : exploring the brain (3rd ed.). Lippincott Williams & Wilkins. p. 41. ISBN 978-0-7817-6003-4.
- ^ Giustetto M, Hegde AN, Si K, Casadio A, Inokuchi K, Pei W, Kandel ER, Schwartz JH (November 2003). «Axonal transport of eukaryotic translation elongation factor 1alpha mRNA couples transcription in the nucleus to long-term facilitation at the synapse». Proceedings of the National Academy of Sciences of the United States of America. 100 (23): 13680–5. Bibcode:2003PNAS..10013680G. doi:10.1073/pnas.1835674100. PMC 263873. PMID 14578450.
- ^ Si K, Giustetto Si K, Giustetto M, Etkin A, Hsu R, Janisiewicz AM, Miniaci MC, Kim JH, Zhu H, Kandel ER (December 2003). «A neuronal isoform of CPEB regulates local protein synthesis and stabilizes synapse-specific long-term facilitation in aplysia». Cell. 115 (7): 893–904. doi:10.1016/s0092-8674(03)01021-3. PMID 14697206. S2CID 15552012.
- ^ Maday, Sandra; Twelvetrees, Alison E.; Moughamian, Armen J.; Holzbaur, Erika L.F. (October 2014). «Axonal Transport: Cargo-Specific Mechanisms of Motility and Regulation». Neuron. 84 (2): 292–309. doi:10.1016/j.neuron.2014.10.019. PMC 4269290. PMID 25374356.
- ^ a b c d Roy S, Zhang B, Lee VM, Trojanowski JQ (January 2005). «Axonal transport defects: a common theme in neurodegenerative diseases». Acta Neuropathologica. 109 (1): 5–13. doi:10.1007/s00401-004-0952-x. PMID 15645263. S2CID 11635065.
- ^ Brown A (March 2003). «Axonal transport of membranous and nonmembranous cargoes: a unified perspective». The Journal of Cell Biology. 160 (6): 817–21. doi:10.1083/jcb.200212017. PMC 2173776. PMID 12642609.
- ^ Scott DA, Das U, Tang Y, Roy S (May 2011). «Mechanistic logic underlying the axonal transport of cytosolic proteins». Neuron. 70 (3): 441–54. doi:10.1016/j.neuron.2011.03.022. PMC 3096075. PMID 21555071.
- ^ Roy S, Winton MJ, Black MM, Trojanowski JQ, Lee VM (March 2007). «Rapid and intermittent cotransport of slow component-b proteins». The Journal of Neuroscience. 27 (12): 3131–8. doi:10.1523/JNEUROSCI.4999-06.2007. PMC 6672457. PMID 17376974.
- ^ Kuznetsov AV (2011). «Analytical solution of equations describing slow axonal transport based on the stop-and-go hypothesis». Central European Journal of Physics. 9 (3): 662–673. Bibcode:2011CEJPh…9..662K. doi:10.2478/s11534-010-0066-0.
- ^ Holland DJ, Miranda-Saksena M, Boadle RA, Armati P, Cunningham AL (October 1999). «Anterograde transport of herpes simplex virus proteins in axons of peripheral human fetal neurons: an immunoelectron microscopy study». Journal of Virology. 73 (10): 8503–11. doi:10.1128/JVI.73.10.8503-8511.1999. PMC 112870. PMID 10482603.
- ^ Satpute-Krishnan P, DeGiorgis JA, Conley MP, Jang M, Bearer EL (October 2006). «A peptide zipcode sufficient for anterograde transport within amyloid precursor protein». Proceedings of the National Academy of Sciences of the United States of America. 103 (44): 16532–7. Bibcode:2006PNAS..10316532S. doi:10.1073/pnas.0607527103. PMC 1621108. PMID 17062754.
- ^ Seamster PE, Loewenberg M, Pascal J, Chauviere A, Gonzales A, Cristini V, Bearer EL (October 2012). «Quantitative measurements and modeling of cargo-motor interactions during fast transport in the living axon». Physical Biology. 9 (5): 055005. Bibcode:2012PhBio…9e5005S. doi:10.1088/1478-3975/9/5/055005. PMC 3625656. PMID 23011729.
- ^ Gallagher JJ, Zhang X, Ziomek GJ, Jacobs RE, Bearer EL (April 2012). «Deficits in axonal transport in hippocampal-based circuitry and the visual pathway in APP knock-out animals witnessed by manganese enhanced MRI». NeuroImage. 60 (3): 1856–66. doi:10.1016/j.neuroimage.2012.01.132. PMC 3328142. PMID 22500926.
- ^ Bearer EL, Manifold-Wheeler BC, Medina CS, Gonzales AG, Chaves FL, Jacobs RE (October 2018). «Alterations of functional circuitry in aging brain and the impact of mutated APP expression». Neurobiology of Aging. 70: 276–290. doi:10.1016/j.neurobiolaging.2018.06.018. PMC 6159914. PMID 30055413.
- ^ Gibbs KL, Kalmar B, Sleigh JN, Greensmith L, Schiavo G (January 2016). «In vivo imaging of axonal transport in murine motor and sensory neurons». Journal of Neuroscience Methods. 257: 26–33. doi:10.1016/j.jneumeth.2015.09.018. PMC 4666412. PMID 26424507.
- ^ Sleigh J, Schiavo G (2016). «Older but not slower: aging does not alter axonal transport dynamics of signalling endosomes in vivo». Matters. 2 (6). doi:10.19185/matters.201605000018.
- ^ Cui B, Wu C, Chen L, Ramirez A, Bearer EL, Li WP, Mobley WC, Chu S (August 2007). «One at a time, live tracking of NGF axonal transport using quantum dots». Proceedings of the National Academy of Sciences of the United States of America. 104 (34): 13666–71. Bibcode:2007PNAS..10413666C. doi:10.1073/pnas.0706192104. PMC 1959439. PMID 17698956.
- ^ Saladin, Kenneth. Anatomy and Physiology: The Unity of Form and Function. Sixth. New York : McGraw-Hill, 2010. 445. Print.
- ^ Bearer EL, Breakefield XO, Schuback D, Reese TS, LaVail JH (July 2000). «Retrograde axonal transport of herpes simplex virus: evidence for a single mechanism and a role for tegument». Proceedings of the National Academy of Sciences of the United States of America. 97 (14): 8146–50. Bibcode:2000PNAS…97.8146B. doi:10.1073/pnas.97.14.8146. PMC 16684. PMID 10884436.
- ^ Maday S, Twelvetrees AE, Moughamian AJ, Holzbaur EL (October 2014). «Axonal transport: cargo-specific mechanisms of motility and regulation». Neuron. 84 (2): 292–309. doi:10.1016/j.neuron.2014.10.019. PMC 4269290. PMID 25374356.
- ^ Sleigh JN, Rossor AM, Fellows AD, Tosolini AP, Schiavo G (December 2019). «Axonal transport and neurological disease». Nat Rev Neurol. 15 (12): 691–703. doi:10.1038/s41582-019-0257-2. PMID 31558780. S2CID 203437348.
- ^ Mitrabhakdi E, Shuangshoti S, Wannakrairot P, Lewis RA, Susuki K, Laothamatas J, Hemachudha T (November 2005). «Difference in neuropathogenetic mechanisms in human furious and paralytic rabies». Journal of the Neurological Sciences. 238 (1–2): 3–10. doi:10.1016/j.jns.2005.05.004. PMID 16226769. S2CID 25509462.
- ^ Bercsenyi K, Schmieg N, Bryson JB, Wallace M, Caccin P, Golding M, Zanotti G, Greensmith L, Nischt R, Schiavo G (November 2014). «Tetanus toxin entry. Nidogens are therapeutic targets for the prevention of tetanus» (PDF). Science. 346 (6213): 1118–23. doi:10.1126/science.1258138. PMID 25430769. S2CID 206560426.
{{cite journal}}: CS1 maint: url-status (link) - ^ Satpute-Krishnan P, DeGiorgis JA, Bearer EL (December 2003). «Fast anterograde transport of herpes simplex virus: role for the amyloid precursor protein of alzheimer’s disease». Aging Cell. 2 (6): 305–18. doi:10.1046/j.1474-9728.2003.00069.x. PMC 3622731. PMID 14677633.
- ^ Cheng SB, Ferland P, Webster P, Bearer EL (March 2011). «Herpes simplex virus dances with amyloid precursor protein while exiting the cell». PLOS ONE. 6 (3): e17966. Bibcode:2011PLoSO…617966C. doi:10.1371/journal.pone.0017966. PMC 3069030. PMID 21483850.
- ^ Bearer EL, Satpute-Krishnan P (September 2002). «The role of the cytoskeleton in the life cycle of viruses and intracellular bacteria: tracks, motors, and polymerization machines». Current Drug Targets. Infectious Disorders. 2 (3): 247–64. doi:10.2174/1568005023342407. PMC 3616324. PMID 12462128.
- ^ Itzhaki RF, Lathe R, Balin BJ, Ball MJ, Bearer EL, Braak H, et al. (2016). «Microbes and Alzheimer’s Disease». Journal of Alzheimer’s Disease. 51 (4): 979–84. doi:10.3233/JAD-160152. PMC 5457904. PMID 26967229.
- ^ «No place like asphalt for these hardy microbes». New Scientist. 206 (2757): 15. 2010. doi:10.1016/s0262-4079(10)60991-8.
Аксональный транспорт, также называемый аксоплазматический транспорт или аксоплазматический поток, клеточный процесс, ответственный за движение митохондрий, липидов, синаптических пузырьков, белков и других органеллы в и от нейрона клеточного тела через цитоплазму его аксона, называемого аксоплазма. Поскольку некоторые аксоны имеют длину порядка метров, нейроны не могут полагаться на диффузию, чтобы переносить продукты ядра и органелл к концам своих аксонов. Аксональный транспорт также отвечает за перемещение молекул, предназначенных для деградации, от аксона обратно в тело клетки, где они расщепляются лизосомами.
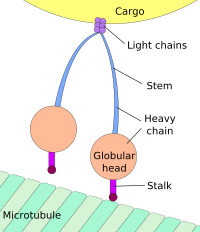
Движение к телу клетки называется ретроградным транспортом, а движение к синапсу называется антероградным переносом.
Содержание
- 1 Механизм
- 2 Быстрый и медленный перенос
- 3 Антероградный перенос
- 4 Ретроградный перенос
- 5 Последствия прерывания
- 6 Инфекция
- 7 См. Также
- 8 Ссылки
Механизм

. Подавляющее большинство аксональных белков синтезируется в теле нейрональной клетки и транспортируется по аксонам. Некоторая трансляция мРНК была продемонстрирована в аксонах. Транспорт аксонов происходит на протяжении всей жизни нейрона и необходим для его роста и выживания. Микротрубочки (сделанные из тубулина ) проходят вдоль аксона и обеспечивают основные цитоскелетные «дорожки» для транспортировки. Кинезин и динеин — это моторные белки, которые перемещают грузы в антероградном (вперед от сомы к кончику аксона) и ретроградном (назад) к соме (телу клетки)) соответственно. Моторные белки связываются и транспортируют несколько различных грузов, включая митохондрии, цитоскелет полимеры, аутофагосомы и синаптические везикулы, содержащие нейротрансмиттеры.
Аксональный транспорт может быть быстрым или медленным, а также антероградным (от тела клетки) или ретроградным (транспортирует материалы от аксона к телу клетки).
Быстрый и медленный транспорт
Везикулярные грузы перемещаются относительно быстро (50–400 мм / день), тогда как транспортировка растворимых (цитозольных) и цитоскелетных белков занимает гораздо больше времени (перемещение менее 8 мм / день). день). Базовый механизм быстрого аксонального транспорта был понят на протяжении десятилетий, но механизм медленного аксонального транспорта стал ясен только недавно, в результате передовых методов визуализации. Методы флуоресцентного мечения (например, флуоресцентная микроскопия ) сделали возможным прямую визуализацию транспорта в живых нейронах. (См. Также: Антероградное отслеживание.)
Недавние исследования показали, что движение цитоскелетных «медленных» грузов на самом деле происходит быстро, но в отличие от быстрых грузов, они часто останавливаются, что делает общую скорость транзита намного медленнее. Этот механизм известен как модель медленного аксонального транспорта «Stop and Go» и был широко подтвержден для транспорта нейрофиламента белка цитоскелета. Движение растворимых (цитозольных) грузов является более сложным, но, по-видимому, имеет аналогичную основу, когда растворимые белки организуются в мультибелковые комплексы, которые затем передаются посредством временных взаимодействий с более быстро движущимися грузами, перемещающимися в быстром аксональном транспорте. Аналогия — разница в тарифах на проезд между местными и скоростными поездами метро. Хотя оба типа поездов движутся между станциями с одинаковой скоростью, местному поезду требуется гораздо больше времени, чтобы добраться до конца линии, потому что он останавливается на каждой станции, тогда как экспресс делает всего несколько остановок по пути.
Антероградный перенос
Антероградный (также называемый «ортоградным») перенос — это движение молекул / органелл наружу от тела клетки (также называемого сома ) к синапсу или клеточной мембране.
Антероградное движение отдельных грузов (в транспортных пузырьках ) как быстрых, так и медленных компонентов вдоль микротрубочек опосредуется кинезинами. Некоторые кинезины участвуют в медленном транспорте, хотя механизм генерации «пауз» при прохождении медленных компонентов груза все еще неизвестен.
Существует два класса медленного антероградного транспорта: медленный компонент a (SCa), который переносит в основном микротрубочки и нейрофиламенты со скоростью 0,1-1 миллиметра в день, и медленный компонент b (SCb), несущий более 200 различных белков и актина со скоростью до 6 миллиметров в день. Медленный компонент b, который также несет актин, транспортируется в аксонах клеток сетчатки со скоростью 2-3 миллиметра в день.
Во время латентной реактивации вирус простого герпеса (HSV) входит в свой литический цикл и использует механизмы антероградного транспорта для миграции из ганглиев дорсальных корешков нейронов кожи или слизистой оболочки, на которые он впоследствии влияет.
Рецептор карго для двигателей антероградного транспорта, кинезины, был идентифицирован как белок-предшественник амилоида (АРР), родительский белок, который производит старческий бляшки, обнаруженные при болезни Альцгеймера. Пептид из 15 аминокислот на карбоксильном конце цитоплазмы APP связывается с высоким сродством с обычным кинезином-1 и опосредует транспорт экзогенного груза в гигантском аксоне кальмара.
Марганец, контрастное вещество для T 1 МРТ, перемещается антероградным транспортом после стереотаксической инъекции в мозг экспериментальных животных и, таким образом, выявляет схему с помощью МРТ всего мозга у живых животных, как это было впервые сделано Робией Паутлер, Элейн Беэр и Расс Джейкобс. Исследования на мышах, лишенных легкой цепи кинезина-1, показали, что Mn перемещается посредством транспорта на основе кинезина в зрительном нерве и в головном мозге. Транспорт как в проекциях гиппокампа, так и в зрительном нерве также зависит от APP. Транспорт из гиппокампа в передний мозг снижается при старении, а место назначения изменяется из-за наличия бляшек при болезни Альцгеймера.
Ретроградный транспорт
Ретроградный транспорт перемещает молекулы / органеллы от концов аксона к тело клетки. Ретроградный аксональный транспорт опосредуется цитоплазматическим динеином и используется, например, для отправки химических сообщений и продуктов эндоцитоза, направляемых в эндолизосомы от аксона обратно в клетку. Работая со средней скоростью in vivo примерно 2 мкм / сек, быстрый ретроградный транспорт может покрывать 10-20 см в день.
Быстрый ретроградный транспорт возвращает использованные синаптические везикулы и другие материалы в сому и информирует сому об условиях на окончаниях аксонов. Ретроградный транспорт переносит сигналы выживания из синапса обратно в тело клетки, такие как TRK, рецептор фактора роста нервов. Некоторые патогены используют этот процесс для вторжения в нервную систему. Они входят в дистальные кончики аксона и перемещаются к соме ретроградным транспортом. Примеры включают столбнячный токсин и вирусы простого герпеса, бешенства и полиомиелита. При таких инфекциях задержка между инфицированием и появлением симптомов соответствует времени, необходимому для того, чтобы патогены достигли соматических клеток. Вирус простого герпеса перемещается по аксонам в обоих направлениях в зависимости от его жизненного цикла, при этом ретроградный транспорт доминирует полярность для поступающих капсидов.
Последствия прерывания
Когда аксональный транспорт ингибируется или прерывается, нормальная физиология становится патофизиологией, и может возникнуть скопление аксоплазмы, называемое аксональным сфероидом . Поскольку транспорт аксонов может быть нарушен множеством способов, аксональные сфероиды можно увидеть при многих различных классах заболеваний, включая генетические, травматические, ишемические, инфекционные, токсические, дегенеративные и так называемые лейкоэнцефалопатии. Несколько редких нейродегенеративных заболеваний связаны с генетическими мутациями в двигательных белках, кинезине и динеине, и в этих случаях вполне вероятно, что аксональный транспорт является ключевым игроком в опосредовании патологии. Дисфункциональный аксональный транспорт также связан со спорадическими (распространенными) формами нейродегенеративных заболеваний, таких как болезнь Альцгеймера и болезнь Паркинсона. Это в основном связано с многочисленными наблюдениями, что большие скопления аксонов неизменно наблюдаются в пораженных нейронах, и что гены, о которых известно, что они играют роль в семейных формах этих заболеваний, также предположительно играют роль в нормальном аксональном транспорте. Однако прямых доказательств участия аксонального транспорта в последних заболеваниях мало, и другие механизмы (такие как прямая синаптотоксичность) могут быть более актуальными.
Остановка потока аксоплазмы на краю ишемической области при сосудистых ретинопатиях приводит к набуханию нервных волокон, которое приводит к образованию мягких экссудатов или ватных пятен.
Поскольку аксон зависит от аксоплазматического транспорта жизненно важных белков и материалов, повреждение, такое как диффузное повреждение аксона, которое прерывает транспортировку, вызовет дегенерацию дистального аксона в процесс называется валлеровским вырождением. Противораковые препараты, которые препятствуют росту злокачественных опухолей, изменяя микротрубочки (которые необходимы для деления клеток ), повреждают нервы, поскольку микротрубочки необходимы для транспорта аксонов.
Инфекция
вирус бешенства достигает центральной нервной системы ретроградным аксоплазматическим потоком. Столбнячный нейротоксин интернализуется в нервно-мышечном соединении посредством связывания белков нидоген и ретроградно транспортируется к соме в сигнальных эндосомах. Нейротропные вирусы, такие как герпесвирусы, перемещаются внутри аксонов с помощью клеточного транспортного механизма, как было показано в работе группы Элейн Беарэр. Другие инфекционные агенты также подозреваются в использовании аксонального транспорта. В настоящее время считается, что такие инфекции способствуют развитию болезни Альцгеймера и других нейродегенеративных неврологических расстройств.
См. Также
- Внутрилагеллярный транспорт
Ссылки
- ^Sabry J, O’Connor TP, Kirschner MW (июнь 1995 г.). «Аксональный транспорт тубулина в пионерных нейронах Ti1 in situ». Нейрон. 14 (6): 1247–56. DOI : 10.1016 / 0896-6273 (95) 90271-6. PMID 7541635.
- ^ Озтас Э. (2003). «Нейронная трассировка» (PDF). Нейроанатомия. 2 : 2–5. Архивировано (PDF) из оригинала 25.10.2005.
- ^Карп Г., Ван дер Гир П. Клеточная и молекулярная биология: концепции и эксперименты (4-е изд.). Джон Вили. п. 344. ISBN 978-0-471-46580-5 .
- ^ Медведь М.Ф., Коннорс Б.В., Парадсо Массачусетс (2007). Неврология: исследование мозга (3-е изд.). Липпинкотт Уильямс и Уилкинс. п. 41. ISBN 978-0-7817-6003-4 .
- ^Джустетто М., Хегде А.Н., Си К., Касадио А., Инокучи К., Пей В., Кандел Э. Р., Шварц Дж. Х. (ноябрь 2003 г.). «Аксональный транспорт мРНК фактора элонгации трансляции 1альфа эукариот связывает транскрипцию в ядре с долгосрочным облегчением в синапсе». Труды Национальной академии наук Соединенных Штатов Америки. 100 (23): 13680–5. Bibcode : 2003PNAS..10013680G. doi : 10.1073 / pnas.1835674100. PMC 263873. PMID 14578450.
- ^Si K, Giustetto Si K, Giustetto M, Etkin A, Hsu R, Janisiewicz AM, Miniaci MC, Kim JH, Zhu H, Kandel ER (декабрь 2003 г.). «Нейрональная изоформа CPEB регулирует локальный синтез белка и стабилизирует синапс-специфическое долгосрочное облегчение при аплизии». Cell. 115 (7): 893–904. DOI : 10.1016 / s0092-8674 (03) 01021-3. PMID 14697206. S2CID 15552012.
- ^Мадей, Сандра; Twelvetrees, Элисон Э.; Мугамян, Армен Дж.; Хольцбаур, Эрика Л.Ф. (октябрь 2014 г.). «Аксональный транспорт: механизмы движения и регуляции, специфичные для груза». Нейрон. 84 (2): 292–309. doi : 10.1016 / j.neuron.2014.10.019. PMC 4269290. PMID 25374356.
- ^ Рой С., Чжан Б., Ли В.М., Trojanowski JQ (январь 2005 г.). «Дефекты аксонального транспорта: общая тема нейродегенеративных заболеваний». Acta Neuropathologica. 109 (1): 5–13. doi : 10.1007 / s00401-004-0952-x. PMID 15645263. S2CID 11635065.
- ^Коричневый A (март 2003 г.). «Аксональный транспорт перепончатых и немембранозных грузов: единая перспектива». Журнал клеточной биологии. 160 (6): 817–21. doi : 10.1083 / jcb.200212017. PMC 2173776. PMID 12642609.
- ^Скотт Д.А., Дас У, Тан И, Рой С. (май 2011 г.). «Механистическая логика, лежащая в основе аксонального транспорта цитозольных белков». Нейрон. 70 (3): 441–54. doi : 10.1016 / j.neuron.2011.03.022. PMC 3096075. PMID 21555071.
- ^Рой С., Винтон М.Дж., Блэк М.М., Трояновский Д.К., Ли В.М. (март 2007 г.). «Быстрый и прерывистый котранспорт медленных белков компонента-b». Журнал неврологии. 27 (12): 3131–8. doi : 10.1523 / JNEUROSCI.4999-06.2007. PMC 6672457. PMID 17376974.
- ^Кузнецов А.В. (2011). «Аналитическое решение уравнений, описывающих медленный аксональный транспорт на основе гипотезы остановки и движения». Центральноевропейский физический журнал. 9 (3): 662–673. Bibcode : 2011CEJPh… 9..662K. doi : 10.2478 / s11534-010-0066-0.
- ^Holland DJ, Miranda-Saksena M, Boadle RA, Armati P, Cunningham AL (октябрь 1999 г.). «Антероградный транспорт белков вируса простого герпеса в аксонах периферических нейронов плода человека: исследование с помощью иммуноэлектронной микроскопии». Журнал вирусологии. 73 (10): 8503–11. doi : 10.1128 / JVI.73.10.8503-8511.1999. PMC 112870. PMID 10482603.
- ^Сатпуте-Кришнан П., ДеГиоргис Дж. А., Конли М. П., Джанг М., Бирер Е. Л. (октябрь 2006 г.). «Почтовый индекс пептида, достаточный для антероградного транспорта в белке-предшественнике амилоида». Труды Национальной академии наук Соединенных Штатов Америки. 103 (44): 16532–7. Bibcode : 2006PNAS..10316532S. doi : 10.1073 / pnas.0607527103. ПМЦ 1621108. PMID 17062754.
- ^Seamster PE, Loewenberg M, Pascal J, Chauviere A, Gonzales A, Cristini V, Bearer EL (октябрь 2012 г.). «Количественные измерения и моделирование грузомоторных взаимодействий при быстрой транспортировке в живом аксоне». Физическая биология. 9 (5): 055005. Bibcode : 2012PhBio… 9e5005S. doi : 10.1088 / 1478-3975 / 9/5/055005. PMC 3625656. PMID 23011729.
- ^Галлахер Дж. Дж., Чжан Х, Зиомек Дж. Дж., Джейкобс Р. Э., Бирер Е. Л. (апрель 2012 г.). «Дефицит аксонального транспорта в цепи на основе гиппокампа и зрительный путь у животных с нокаутом APP, подтвержденный МРТ с усилением марганца». NeuroImage. 60 (3): 1856–66. doi : 10.1016 / j.neuroimage.2012.01.132. PMC 3328142. PMID 22500926.
- ^Bearer EL, Manifold-Wheeler BC, Medina CS, Gonzales AG, Chaves FL, Jacobs RE (октябрь 2018 г.). «Изменения функциональной схемы в стареющем мозге и влияние мутированной экспрессии АРР». Нейробиология старения. 70 : 276–290. doi : 10.1016 / j.neurobiolaging.2018.06.018. ПМЦ 6159914. PMID 30055413.
- ^Гиббс К.Л., Кальмар Б., Сани Дж. Н., Гринсмит Л., Скьяво Г. (январь 2016 г.). «Визуализация транспорта аксонов в моторных и сенсорных нейронах мышей in vivo». Журнал методов неврологии. 257 : 26–33. doi : 10.1016 / j.jneumeth.2015.09.018. PMC 4666412. PMID 26424507.
- ^Sleigh J, Schiavo G (2016). «Старше, но не медленнее: старение не изменяет динамику аксонального транспорта сигнальных эндосом in vivo». Имеет значение. 2 (6). doi : 10.19185 / questions.201605000018.
- ^Цуй Б., Ву С., Чен Л., Рамирес А., Бирер Э.Л., Ли В.П., Мобли В.С., Чу С. (август 2007 г.). «Поочередное отслеживание аксонального транспорта NGF с помощью квантовых точек». Труды Национальной академии наук Соединенных Штатов Америки. 104 (34): 13666–71. Bibcode : 2007PNAS..10413666C. doi : 10.1073 / pnas.0706192104. PMC 1959439. PMID 17698956.
- ^Саладин, Кеннет. Анатомия и физиология: единство формы и функции. Шестое. Нью-Йорк: Макгроу-Хилл, 2010. 445. Печать.
- ^Несущий Э.Л., Брейкфилд XO, Шубак Д., Риз Т.С., ЛаВейл Дж. Х. (июль 2000 г.). «Ретроградный аксональный транспорт вируса простого герпеса: свидетельства единственного механизма и роль тегумента». Труды Национальной академии наук Соединенных Штатов Америки. 97 (14): 8146–50. Bibcode : 2000PNAS… 97.8146B. doi : 10.1073 / pnas.97.14.8146. PMC 16684. PMID 10884436.
- ^Maday S, Twelvetrees AE, Mouhamian AJ, Holzbaur EL (октябрь 2014 г.). «Аксональный транспорт: грузо-специфические механизмы моторики и регуляции». Нейрон. 84 (2): 292–309. doi : 10.1016 / j.neuron.2014.10.019. PMC 4269290. PMID 25374356.
- ^Sleigh JN, Rossor AM, Fellows AD, Tosolini AP, Schiavo G (декабрь 2019 г.). «Аксональный транспорт и неврологические заболевания». Nat Rev Neurol. 15 (12): 691–703. DOI : 10.1038 / s41582-019-0257-2. PMID 31558780. S2CID 203437348.
- ^Митрабхакди Э., Шуангшоти С., Ваннакрайрот П., Льюис Р.А., Сусуки К., Лаотхаматас Дж., Хемачуда Т. (ноябрь 2005 г.). «Различие в нейропатогенетических механизмах при бешеном и паралитическом бешенстве человека». Журнал неврологических наук. 238 (1–2): 3–10. doi : 10.1016 / j.jns.2005.05.004. PMID 16226769. S2CID 25509462.
- ^Bercsenyi K, Schmieg N, Bryson JB, Wallace M, Caccin P, Golding M, Zanotti G, Greensmith L, Nischt R, Schiavo G (ноябрь 2014 г.). «Поступление столбнячного токсина. Нидогены являются терапевтическими мишенями для профилактики столбняка» (PDF). Наука. 346 (6213): 1118–23. doi : 10.1126 / science.1258138. PMID 25430769. S2CID 206560426.
- ^Сатпуте-Кришнан П., ДеГиоргис Дж. А., Бирер Е.Л. (декабрь 2003 г.). «Быстрый антероградный транспорт вируса простого герпеса: роль белка-предшественника амилоида болезни Альцгеймера». Ячейка старения. 2 (6): 305–18. doi : 10.1046 / j.1474-9728.2003.00069.x. PMC 3622731. PMID 14677633.
- ^Cheng SB, Ferland P, Webster P, Bearer EL (март 2011 г.). «Вирус простого герпеса танцует с белком-предшественником амилоида при выходе из клетки». PLOS ONE. 6 (3): e17966. Bibcode : 2011PLoSO… 617966C. doi : 10.1371 / journal.pone.0017966. PMC 3069030. PMID 21483850.
- ^Bearer EL, Satpute-Krishnan P (сентябрь 2002 г.). «Роль цитоскелета в жизненном цикле вирусов и внутриклеточных бактерий: треки, двигатели и машины для полимеризации». Текущие целевые показатели по лекарствам. Инфекционные заболевания. 2 (3): 247–64. doi : 10.2174 / 1568005023342407. PMC 3616324. PMID 12462128.
- ^Ицхаки РФ, токарный Р., Балин Б.Дж., Болл М.Дж., предъявитель Е.Л., Браак Х. и др. (2016). «Микробы и болезнь Альцгеймера». Журнал болезни Альцгеймера. 51 (4): 979–84. doi : 10.3233 / JAD-160152. PMC 5457904. PMID 26967229.
- ^«Нет места лучше асфальта для этих выносливых микробов». Новый ученый. 206 (2757): 15. 2010. doi :10.1016/s0262-4079(10)60991-8.
