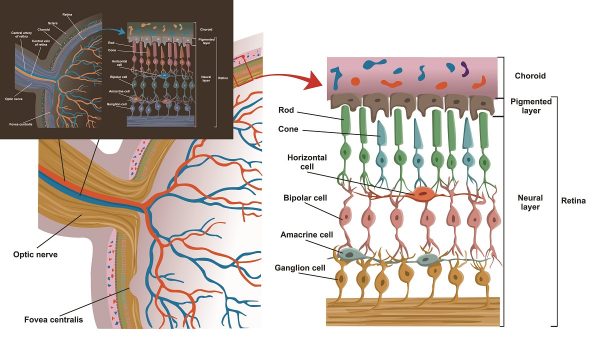
Самая высокая плотность ганглиозных клеток находится в макулярной области. Макула, занимая менее 2% области сетчатки, содержит 30% ганглиозных клеток. Три внутренних слоя сетчатки – слой ганглиозных клеток, слой нервных волокон (аксоны ганглиозных клеток) и внутренний плексиформный слой (дендриты ганглиозных клеток) – составляют ГКС (рис. 29). Измерение толщины ГКС производится при сканировании макулярной области в радиусе 3 мм от центра фовеа и при автоматическом сегментировании слоев сетчатки.
Потеря синапсов и дендритов, уменьшение толщины и гибель аксонов с последующим сморщиванием и потерей клеточной сомы ганглиозных клеток при глаукоме будут определяющим фактором при оценке абсолютных значений толщины сетчатки в целом и ее слоев.
Измерение толщины сетчатки производится с помощью автоматизированного программного обеспечения сегментации от ВПМ до пигментного эпителия сетчатки (ПЭС). При измерении толщины сетчатки в зависимости от используемого оборудования могут быть различия в расположении сегментационных линий, определяющих ее толщину. Первый маркер соответствует витреоретинальному интерфейсу и одинаков для всех устройств, так как разделяет две контрастные структуры: арефлективное стекловидное тело и гиперрефлективный слой нервных волокон. Наружная граница сетчатки может варьировать, поскольку ПЭС визуализируется как неоднородная структура со слоями высокой (фагосомная зона) и низкой (миелосомная зона) рефлективности. В зависимости от алгоритма программного обеспечения вторым маркером может быть наружная (Spectralis) либо внутренняя (Cirrus) граница ретинального пигментного эпителия. Таким образом, нормативное значение толщины сетчатки является уникальным для используемой машины, что препятствует сравнению данных, полученных на различных томографах.
Сегментация изображения дает возможность распознавать как отдельные слои, так и группы слоев, оценивать толщину и объем внутренней и наружной сетчатки. Маркером, разделяющим сетчатку на наружную и внутреннюю, является внутренний плексиформный слой (рис. 30).
Схема топографической оценки макулярной области, впервые предложенная для оценки эффективности лечения диабетической ретинопатии в рамках исследования ETDRS, подразделена на секторы с обозначением средней толщины в каждом из них (центральное субполе – кольцо диаметром 1 мм вокруг центральной ямки (C1), внутреннее кольцо диаметром 3 мм и наружное 6 мм вокруг центральной ямки обозначены S, T, I и N (верхний, височный, нижний и носовой квадранты) (рис. 31).
Оценка толщины сетчатки у детей должна учитывать продолжающееся развитие макулы после рождения (рис. 32), максимальные изменения которой происходят в первые 5 лет жизни и продолжаются до раннего подросткового возраста.
Ремоделирование фовеолярного профиля включает в себя: центробежную миграцию внутренних слоев сетчатки (слоя нервных волокон, слоя ганглиозных клеток, внутреннего плексиформного слоя, внутреннего ядерного слоя) и наружного плексиформного слоя от центральной ямки, а также центростремительную миграцию колбочковых фоторецепторов в центральную ямку и увеличение толщины наружных слоев сетчатки, наружного ядерного слоя, удлинение внутренних и наружных сегментов фоторецепторов (рис. 33).
При этом толщина слоя фоторецепторов увеличивается, а ганглиозного и внутреннего ядерного слоев уменьшается.
В отличие от взрослых, когда наблюдается возрастная потеря толщины, толщина ГКС у детей с возрастом увеличивается. В связи с этим целесообразно толщину макулы и ее отдельных слоев рассматривать отдельно для детей в возрасте младше и старше 5 лет.
Создание нормативной педиатрической базы от 0 до 17 лет облегчит распознавание структурных нарушений и дальнейшее наблюдение за ними, но на сегодняшний день видится перспективой отдаленного будущего.
У недоношенных детей могут быть выявлены признаки незрелости фовеолярного профиля (неглубокая центральная ямка, сохранение внутренних слоев сетчатки и тонкий слой фоторецепторов) (рис. 34, 35).
Повреждение ГКС является важным звеном патогенеза глаукомы в общем каскаде событий, ведущих к необратимым изменениям зрительного нерва. У взрослых изменение толщины ГКС отражает потерю ганглиозных клеток при глаукоме и имеет решающее значение в начальной стадии заболевания.
Обзор данных литературы продемонстрировал достоверно значимое уменьшение макулярного объема в целом и толщины внутренних слоев сетчатки у детей с глаукомой в сравнении со здоровыми детьми (рис. 36).
Собственные наблюдения за детьми с врожденной и ювенильной глаукомой позволяют говорить о том, что изменения в макулярной области появляются гораздо позднее изменений ДЗН и перипапиллярного СНВС (рис. 37).
Интересным, на наш взгляд, является факт увеличения толщины внутреннего ядерного слоя у детей с глаукомой (рис. 38), развивающегося вторично по отношению к гибели ганглиозных клеток в результате ретроградной транссинаптической дегенерации.
Таким образом, толщину макулы и ее отдельных слоев необходимо оценивать отдельно для детей в возрасте младше и старше 5 лет. Интерпретацию карт значимости у маленьких детей следует проводить с осторожностью. Изменения ДЗН и перипапиллярного СНВС у детей с врожденной и ювенильной глаукомой более информативны, нежели изменения ГКС. В то же время изменение внутреннего ядерного слоя у детей с глаукомой может быть надежным диагностическим маркером прогрессирования заболевания.
В целом, как было сказано выше, в детском возрасте подъем ВГД в первую очередь вызывает растяжение глазного яблока, и только вслед за этим происходят формирование глаукомной экскавации зрительного нерва и снижение зрительных функций. Поэтому определение стадий врожденной глаукомы необходимо осуществлять с использованием иных критериев, чем при глаукоме взрослого возраста, по «худшему» клиническому признаку на момент обследования ребенка.
Строение сетчатки глаза — структура и функции
Сетчатка — функциональная единица центральной нервной системы, обеспечивающая преобразование светового сигнала в нервный импульс. Строение сетчатки представляет собой многослойную ткань. Которая состоит из шести типов нейрональных клеток (два типа фоторецепторов: колбочки и палочки; горизонтальные, биполярные, амакриновые и ганглиозные клетки). А также, трех типов глиальных (мюллеровы, глиальные, астроциты и микроглиальные). Наличие внутреннего и внешнего гемато-ретинальных барьеров и внутриретинальных соединений обусловливает тонкость регуляции обменов с кровообращением и внутри самой сетчатки. Центральная зона (макула) узкоспециализированная зона обеспечения остроты зрения, имеет специфические анатомические особенности.
Общая анатомия
Сетчатка выстилает заднюю часть глаза. Это тонкая прозрачная оболочка. Толщиной менее 500 мкм. Она выявляет васкуляризацию пигментов и васкуляризацию сосудистой оболочки, лежащую в основе розово-оранжевого цвета глазного дна. Головка зрительного нерва видна макроскопически в виде розоватого диска. Вокруг которого выходят ретинальные артерии и вены, называемые зрительным сосочком.
Макула представляет собой область задней части, центр которой аваскулярен. Ее можно различить при осмотре глазного дна по оранжевой окраске из-за присутствия пигментов ксантофилла. Расположена височно по отношению к диску зрительного нерва. Ямка в центре макулы, состоящая только из колбочек, обеспечивает остроту зрения. Простирается от зубчатой мышцы спереди до зрительного нерва на заднем полюсе глазного яблока.
Плоская часть является областью, в которую вводятся инструменты для витреоретинальной хирургии. В это место выполняются интравитреальные инъекции. Поперечный диаметр взрослого эмметропического глаза составляет около 22 мм. Она покрывает примерно 15-16 мм внутреннего диаметра глаза и 72 % поверхности глазной сферы. Склера, белая оболочка, обеспечивающая жесткость глазного яблока, имеет толщину менее миллиметра.
Васкуляризация сетчатки: сосуды и сосудистой оболочки
Сетчатка васкуляризируется двумя различными сосудистыми системами, не имеющими анатомических связей в физиологических условиях: ретинальной капиллярной сетью, обеспечивающей непосредственную неоваскуляризацию слоев, и хориоидальной сетью, обеспечивающей васкуляризацию косвенно, так как в наружной части нет капилляров. Центральная артерия отходит главным образом от внутренней сонной артерии, следует внутриневрально и выходит на диск зрительного нерва, где делится на четыре конечные ветви: височную и носовую, верхнюю и нижнюю. Конечные артерии делятся на коллатеральные артерии, которые различаются на терминальные артерии, что также имеют коллатерали. И так далее дихотомически, пока не сформируется решетчатая сеть, покрывающая каждую из артерий, квадрант внутренней сетчатки. Капилляры отходят от этих коллатеральных сосудов и организованы в поверхностные, промежуточные и глубокие сплетения.
Артерии и вены
Артерии и вены располагаются в волоконно-оптическом слое. Капилляры имеют диаметр 5-6 мкм и образованы эндотелиальными с плотным соединением, расположенными на толстой базальной мембране. Их окружают перициты и микроглии. Типы глиальных различаются в поверхностных и глубоких сосудистых сплетениях: в то время как в поверхностных и промежуточных сосудистых сплетениях глио-нейроваскулярная связь опосредована астроцитами и мюллеровскими глиальными, в глубоком сплетении отсутствуют периваскулярные астроциты и только мюллеровские глиальные могут обеспечивать, в частности, через калиевые каналы. Таким образом, в случае отказа мюллеровских глиальных глубокая капиллярная сеть более чувствительна к потере регуляции в ответ на активность фоторецепторов.
Хориоидальная сосудистая система доставляет питательные вещества и кислород к наружной сетчатке и, в частности, к фоторецепторам опосредованно, так как наружная не имеет питающей капиллярной сети. Хориоидальная сосудистая сеть происходит от ветвей глазной артерии, которая сама является ветвью внутренней сонной артерии. Сосудистая оболочка представляет собой ткань толщиной от 300 до 500 мкм у человека, ограниченную мембраной Бруха спереди и спаянную со склерой сзади.
Она состоит из пигментированных (меланоцитов), тучных клеток, микроглии и сосудов. Хориоидальный кровоток является одним из важнейших в организме. Сосуды хориокапилляров, организованные в функциональные дольки, орошаемые независимыми артериолами, образованы слоем эндотелиальных с плотными соединениями, содержащими большие диафрагмальные фенестрации (от 60 до 90 нм), открытие которых зависит от роста эндотелия сосудов, таким образом регулируя прохождение белков и макромолекул. Этот белковый градиент между сетчаткой и сосудистой оболочкой необходим для прикрепления и для состояния прозрачности, необходимого для передачи фотонов. Сосудистая оболочка богато иннервирована парасимпатическими, симпатическими и тройничными чувствительными нервными волокнами, которые регулируют хориоидальный кровоток.
Микроскопическая анатомия
Классически существует десять слоев сетчатки:
- слой клеток пигментного эпителия;
- наружный и внутренний сегменты фоторецепторов;
- наружная пограничная мембрана, место соединения мюллеровских с сегментами фоторецепторов и фоторецепторов между ними системами адгезионных и плотных контактов;
- фоторецепторных ядер или наружный ядерный;
- наружный плексиформный, образованный синапсами между биполярными клетками и фоторецепторами и с горизонтальными. Последние модулируют нервное сообщение, передаваемое по прямому пути;
- внутренний ядерный, представляющий собой слой ядер горизонтальных, биполярных, амакриновых и клеток Мюллера. Наружная часть содержит тела горизонтальных клеток, центральная часть — ядра биполярных и Мюллера, а самая внутренняя часть — амакриновые;
- плексиформный (зернистый), состоящий из дендритов ганглиозных и аксонов биполярных клеток;
- ганглиозных клеток;
- нервных волокон. Состоящий из аксонов ганглиозных, окруженных глиальными отростками, образующими зрительный нерв, связанный с головным мозгом;
- внутренняя пограничная мембрана, представляющая собой мембранное расширение, состоящее из ножек мюллеровских и их базальной мембраны.
Пигментный эпителий
Монослой пигментного эпителия (ПЭС) является основным компонентом не только из-за его физических и функциональных свойств в качестве внешнего гематоретинального барьера и его оптических свойств, но особенно из-за его многочисленных метаболических активностей. Представляет собой прилегающий эпителий с плотным соединением, сильно поляризованный, содержащий множество ионных и водных каналов на его базолатеральной и апикальной поверхностях, обеспечивающий избирательный транспорт между нейросетчаткой и хориоидальной сосудистой сетью. Необходим для зрения из-за его метаболической активности в ретиноидном цикле, а также из-за фагоцитоза и рециркуляции «использованных» внешних сегментов фоторецепторов. Содержит пигменты, образованные в основном из зерен меланина и липофуксина. Эти зерна особенно реагируют на фотоны с короткими длинами волн, которые вызывают выработку активных форм кислорода, способных вызвать окислительный стресс.
Фоторецепторы
Фоторецепторы представляют собой сильно поляризованные нейроны. Внешний сегмент фоторецептора составляет светочувствительную часть. Он образован складками плазматической мембраны, образующими стопку дисков, которые обновляются и фагоцитируются ПЭС. Внутренний сегмент содержит метаболический аппарат и соединен с внешним сегментом соединительными ресничками. Область, в которой расположены митохондрии, можно визуализировать с помощью оптической когерентной томографии. Внешняя пограничная мембрана соответствует соединительным комплексам между фоторецепторами и мюллеровскими. Содержит ядра фоторецепторов. Внешний плексиформный слой соответствует синапсам, установленным между фоторецепторами и биполярными и горизонтальными клетками, которые образуют более толстый слой волокон Генле, в макулярной области (50 мкм), где располагаются Мюллера. Эти различные структуры, образующие внешнюю часть, можно исследовать с помощью оптической когерентной томографии. Они являются маркерами целостности и зрительной функции.
Ганглиозные клетки и волоконно-оптический слой
Ганглиозные представляют собой клетки размером 10–20 мкм. Эти клетки через свои дендриты образуют синапсы с биполярными и амакриновыми во внутреннем плексиформном слое. Аксоны ганглиозных сходятся в сосочке, образуя зрительный нерв. Они образуют переплетенные волокна с отростками из мюллеровых клеток. Волокна конвергируют на уровне зрительного нерва с радиальной ориентацией. За исключением макулярных волокон, которые образуют прямолинейную межпапилломакулярную сеть.
Глиальные клетки
Глия, как и нейрональная глия в центральной нервной системе, играет несколько ролей в гомеостазе нейронов: транспорт питательных веществ, гидроионная регуляция, иммуномодуляция, продукция нейротрофических факторов. В основной физиологической ситуации астроциты и микроглия располагаются во внутренних слоях.
Астроциты располагаются также вокруг сосудов, под внутренней пограничной мембраной, и очень многочисленны у выхода диска зрительного нерва. Ядра Мюллера находятся в средней части внутреннего ядерного слоя, но их цитоплазматические отростки простираются от внутренней пограничной мембраны до сегментов фоторецепторов. Не исключено, что их отростки могут противостоять микроворсинкам пигментного эпителия.
Клетки Мюллера являются основными позвоночных. Они представляют собой анатомическую связь между нейронами и отделами, с которыми они обмениваются молекулами, а именно сосудами, стекловидным телом и субретинальным пространством. Они наделены множеством различных ионных каналов, рецепторов лигандов, трансмембранных транспортных молекул и ферментов. В частности, экспрессируют глутаминсинтетазу, которая превращает интернализованные молекулы глутамата в глутамин. Они отвечают за поддержание гомеостаза внеклеточной среды (ионы, вода, нейротрансмиттеры и рН). Одной из их основных характеристик является высокая проводимость их плазматической мембраны по отношению к калию. Они участвуют в метаболизме глюкозы, обеспечивая нейроны лактатом и пируватом для их окислительного метаболизма, а также в устранении метаболических отходов.
Астроциты бывают двух типов. С одной стороны, клетки вдвое длиннее своей ширины располагаются вдоль волоконно-оптических пучков, без контакта с сосудами. С другой стороны, другая популяция звездчатых астроглиальных пересекает слой оптического волокна и устанавливает неспециализированные контакты с сосудами. В физиологических условиях микроглии располагаются исключительно вокруг сосудов.
Макула человека
Макула человека составляет менее 5% от общей поверхности сетчатки. Это небольшая специализированная область, расположенная в центре зрительной оси. Она обеспечивает фотопическое и цветовое зрение, а также остроту.
В этой области все слои смещаются, оставляя в центре макулы центральную зону. Ямку, образованную исключительно колбочками и определенными мюллеровскими глиальными, структура и функция которых отличны от других мюллеровских. На крыше ямки мог быть другой тип глиальных, вероятно, астроцитарного типа, функцию которого еще предстоит определить. В этой области находится наибольшая плотность колбочек, которая обеспечивает остроту зрения, цветовое и фотопическое зрение. Макула развивается после рождения. Она достигает своей анатомо-функциональной зрелости примерно к 10-12 годам. Только у приматов и человека имеется одно пятно. Тогда как у других животных его нет, за исключением хищных птиц, у которых их два.
Вывод
Строение сетчатки отражает ее функциональную сложность и исключительную топографическую специализацию. Многие структурные анализы с использованием специальных методов по-прежнему необходимы. С одной стороны, для определения морфологии нормальной сетчатки человека. С другой стороны, для оценки функциональных физиологических изменений. Использование методов визуализации, а также идентификация специфических маркеров различных типов клеток остаются необходимыми для более точного морфологического анализа.
Таким образом, неинвазивные методы визуализации, такие как оптическая когерентная томография в спектральной области (SD-OCT), в сочетании или без ангиографии без красителей (OCT-A) или аналогичная адаптивная оптика, можно получить изображения в поперечных срезах (или «анфас») и даже визуализировать определенные клетки. Эти методы используются в рутинной практике для диагностических целей и принятия терапевтических решений. В настоящее время разрабатываются другие методы визуализации с очень высоким разрешением. Такие как фазово-контрастная микроскопия с транссклеральным освещением, позволит еще точнее исследовать нормальную и патологическую сетчатку.
From Wikipedia, the free encyclopedia
| Retinal ganglion cell | |
|---|---|

Diagram showing cross-section of retinal layers. The area labeled «Ganglionic layer» contains retinal ganglion cells |
|
| Identifiers | |
| MeSH | D012165 |
| NeuroLex ID | nifext_17 |
| Anatomical terms of neuroanatomy
[edit on Wikidata] |
A retinal ganglion cell (RGC) is a type of neuron located near the inner surface (the ganglion cell layer) of the retina of the eye. It receives visual information from photoreceptors via two intermediate neuron types: bipolar cells and retina amacrine cells. Retina amacrine cells, particularly narrow field cells, are important for creating functional subunits within the ganglion cell layer and making it so that ganglion cells can observe a small dot moving a small distance.[1] Retinal ganglion cells collectively transmit image-forming and non-image forming visual information from the retina in the form of action potential to several regions in the thalamus, hypothalamus, and mesencephalon, or midbrain.
Retinal ganglion cells vary significantly in terms of their size, connections, and responses to visual stimulation but they all share the defining property of having a long axon that extends into the brain. These axons form the optic nerve, optic chiasm, and optic tract.
A small percentage of retinal ganglion cells contribute little or nothing to vision, but are themselves photosensitive; their axons form the retinohypothalamic tract and contribute to circadian rhythms and pupillary light reflex, the resizing of the pupil.
Function[edit]
There are about 0.7 to 1.5 million retinal ganglion cells in the human retina.[2] With about 4.6 million cone cells and 92 million rod cells, or 96.6 million photoreceptors per retina,[3] on average each retinal ganglion cell receives inputs from about 100 rods and cones. However, these numbers vary greatly among individuals and as a function of retinal location. In the fovea (center of the retina), a single ganglion cell will communicate with as few as five photoreceptors. In the extreme periphery (edge of the retina), a single ganglion cell will receive information from many thousands of photoreceptors.[citation needed]
Retinal ganglion cells spontaneously fire action potentials at a base rate while at rest. Excitation of retinal ganglion cells results in an increased firing rate while inhibition results in a depressed rate of firing.
A false-color image of a flat-mounted rat retina viewed through a fluorescence microscope at 50x magnification. The optic nerve was injected with a fluorophore, causing retinal ganglion cells to fluoresce.
Types[edit]
There is wide variability in ganglion cell types across species. In primates, including humans, there are generally three classes of RGCs:
- W-ganglion: small, 40% of total, broad fields in retina, excitation from rods. Detection of direction movement anywhere in the field.
- X-ganglion: medium diameter, 55% of total, small field, color vision. Sustained response.
- Y- ganglion: largest, 5%, very broad dendritic field, respond to rapid eye movement or rapid change in light intensity. Transient response.
Based on their projections and functions, there are at least five main classes of retinal ganglion cells:
- Midget cell (parvocellular, or P pathway; P cells)
- Parasol cell (magnocellular, or M pathway; M cells)
- Bistratified cell (koniocellular, or K pathway)
- Photosensitive ganglion cells
- Other ganglion cells projecting to the superior colliculus for eye movements (saccades)[4]
P-type[edit]
P-type retinal ganglion cells project to the parvocellular layers of the lateral geniculate nucleus. These cells are known as midget retinal ganglion cells, based on the small sizes of their dendritic trees and cell bodies. About 80% of all retinal ganglion cells are midget cells in the parvocellular pathway. They receive inputs from relatively few rods and cones. They have slow conduction velocity, and respond to changes in color but respond only weakly to changes in contrast unless the change is great. They have simple center-surround receptive fields, where the center may be either ON or OFF while the surround is the opposite.
Simulated array of parvocellular +M-L (green on) responses (right) to a natural video (left). Notice the relatively high spatial acuity, and sustained temporal responses in this pathway.[5]
M-type[edit]
M-type retinal ganglion cells project to the magnocellular layers of the lateral geniculate nucleus. These cells are known as parasol retinal ganglion cells, based on the large sizes of their dendritic trees and cell bodies. About 10% of all retinal ganglion cells are parasol cells, and these cells are part of the magnocellular pathway. They receive inputs from relatively many rods and cones. They have fast conduction velocity, and can respond to low-contrast stimuli, but are not very sensitive to changes in color. They have much larger receptive fields which are nonetheless also center-surround.
Simulated array of magnocellular OFF responses (right) to a natural video (left). Notice more transient temporal responses in this pathway, compared to the P-type. This retinal pathway is largely color blind.[5]
K-type[edit]
BiK-type retinal ganglion cells project to the koniocellular layers of the lateral geniculate nucleus. K-type retinal ganglion cells have been identified only relatively recently. Koniocellular means «cells as small as dust»; their small size made them hard to find. About 10% of all retinal ganglion cells are bistratified cells, and these cells go through the koniocellular pathway. They receive inputs from intermediate numbers of rods and cones. They may be involved in color vision. They have very large receptive fields that only have centers (no surrounds) and are always ON to the blue cone and OFF to both the red and green cone.
Simulated array of koniocellular +S (blue on) responses (right) to a natural video (left). Notice the low spatial acuity, reflecting the very large receptive fields.[5]
Photosensitive ganglion cell[edit]
Photosensitive ganglion cells, including but not limited to the giant retinal ganglion cells, contain their own photopigment, melanopsin, which makes them respond directly to light even in the absence of rods and cones. They project to, among other areas, the suprachiasmatic nucleus (SCN) via the retinohypothalamic tract for setting and maintaining circadian rhythms. Other retinal ganglion cells projecting to the lateral geniculate nucleus (LGN) include cells making connections with the Edinger-Westphal nucleus (EW), for control of the pupillary light reflex, and giant retinal ganglion cells.
Physiology[edit]
Most mature ganglion cells are able to fire action potentials at a high frequency because of their expression of Kv3 potassium channels.[6][7][8]
Pathology[edit]
Degeneration of axons of the retinal ganglion cells (the optic nerve) is a hallmark of glaucoma.[9]
Developmental biology[edit]
Retinal growth: the beginning[edit]
Retinal ganglion cells (RGCs) are born between embryonic day 11 and post-natal day zero in the mouse and between week 5 and week 18 in utero in human development.[10][11][12] In mammals, RGCs are typically added at the beginning in the dorsal central aspect of the optic cup, or eye primordium. Then RC growth sweeps out ventrally and peripherally from there in a wave-like pattern.[13] This process depends on a host of factors, ranging from signaling factors like FGF3 and FGF8 to proper inhibition of the Notch signaling pathway. Most importantly, the bHLH (basic helix-loop-helix)-domain containing transcription factor Atoh7 and its downstream effectors, such as Brn3b and Isl-1, work to promote RGC survival and differentiation.[10] The «differentiation wave» that drives RGC development across the retina is also regulated in particular of the bHLH factors Neurog2 and Ascl1 and FGF/Shh signaling, deriving from the periphery.[10][13][14]
Growth within the retinal ganglion cell (optic fiber) layer[edit]
Early progenitor RGCs will typically extend processes connecting to the inner and outer limiting membranes of the retina with the outer layer adjacent to the retinal pigment epithelium and inner adjacent to the future vitreous humor. The cell soma will pull towards the pigment epithelium, undergo a terminal cell division and differentiation, and then migrate backwards towards the inner limiting membrane in a process called somal translocation. The kinetics of RGC somal translocation and underlying mechanisms are best understood in the zebrafish.[15] The RGC will then extend an axon in the retinal ganglion cell layer, which is directed by laminin contact.[16] The retraction of the apical process of the RGC is likely mediated by Slit–Robo signaling.[10]
RGCs will grow along glial end feet positioned on the inner surface (side closest to the future vitreous humor). Neural cell adhesion molecule (N-CAM) will mediate this attachment via homophilic interactions between molecules of like isoforms (A or B). Slit signaling also plays a role, preventing RGCs from growing into layers beyond the optic fiber layer.[17]
Axons from the RGCs will grow and extend towards the optic disc, where they exit the eye. Once differentiated, they are bordered by an inhibitory peripheral region and a central attractive region, thus promoting extension of the axon towards the optic disc. CSPGs exist along the retinal neuroepithelium (surface over which the RGCs lie) in a peripheral high–central low gradient.[10] Slit is also expressed in a similar pattern, secreted from the cells in the lens.[17] Adhesion molecules, like N-CAM and L1, will promote growth centrally and will also help to properly fasciculate (bundle) the RGC axons together. Shh is expressed in a high central, low peripheral gradient, promoting central-projecting RGC axons extension via Patched-1, the principal receptor for Shh, mediated signaling.[18]
Growth into and through the optic nerve[edit]
RGCs exit the retinal ganglion cell layer through the optic disc, which requires a 45° turn.[10] This requires complex interactions with optic disc glial cells which will express local gradients of Netrin-1, a morphogen that will interact with the Deleted in Colorectal Cancer (DCC) receptor on growth cones of the RGC axon. This morphogen initially attracts RGC axons, but then, through an internal change in the growth cone of the RGC, netrin-1 becomes repulsive, pushing the axon away from the optic disc.[19] This is mediated through a cAMP-dependent mechanism. Additionally, CSPGs and Eph–ephrin signaling may also be involved.
RGCs will grow along glial cell end feet in the optic nerve. These glia will secrete repulsive semaphorin 5a and Slit in a surround fashion, covering the optic nerve which ensures that they remain in the optic nerve. Vax1, a transcription factor, is expressed by the ventral diencephalon and glial cells in the region where the chiasm is formed, and it may also be secreted to control chiasm formation.[20]
Growth at the optic chiasm[edit]
When RGCs approach the optic chiasm, the point at which the two optic nerves meet, at the ventral diencephalon around embryonic days 10–11 in the mouse, they have to make the decision to cross to the contralateral optic tract or remain in the ipsilateral optic tract. In the mouse, about 5% of RGCs, mostly those coming from the ventral-temporal crescent (VTc) region of the retina, will remain ipsilateral, while the remaining 95% of RGCs will cross.[10] This is largely controlled by the degree of binocular overlap between the two fields of sight in both eyes. Mice do not have a significant overlap, whereas, humans, who do, will have about 50% of RGCs cross and 50% will remain ipsilateral.
Building the repulsive outline of the chiasm[edit]
Once RGCs reach the chiasm, the glial cells supporting them will change from an intrafascicular to radial morphology. A group of diencephalic cells that express the cell surface antigen stage-specific embryonic antigen (SSEA)-1 and CD44 will form an inverted V-shape.[21] They will establish the posterior aspect of the optic chiasm border. Additionally, Slit signaling is important here: Heparin sulfate proteoglycans, proteins in the ECM, will anchor the Slit morphogen at specific points in the posterior chiasm border.[22] RGCs will begin to express Robo, the receptor for Slit, at this point, thus facilitating the repulsion.
Contralateral projecting RGCs[edit]
RGC axons traveling to the contralateral optic tract need to cross. Shh, expressed along the midline in the ventral diencephalon, provides a repulsive cue to prevent RGCs from crossing the midline ectopically. However, a hole is generated in this gradient, thus allowing RGCs to cross.
Molecules mediating attraction include NrCAM, which is expressed by growing RGCs and the midline glia and acts along with Sema6D, mediated via the plexin-A1 receptor.[10] VEGF-A is released from the midline directs RGCs to take a contralateral path, mediated by the neuropilin-1 (NRP1) receptor.[23] cAMP seems to be very important in regulating the production of NRP1 protein, thus regulating the growth cones response to the VEGF-A gradient in the chiasm.[24]
Ipsilateral projecting RGCs[edit]
The only component in mice projecting ipsilaterally are RGCs from the ventral-temporal crescent in the retina, and only because they express the Zic2 transcription factor. Zic2 will promote the expression of the tyrosine kinase receptor EphB1, which, through forward signaling (see review by Xu et al.[25]) will bind to ligand ephrin B2 expressed by midline glia and be repelled to turn away from the chiasm. Some VTc RGCs will project contralaterally because they express the transcription factor Islet-2, which is a negative regulator of Zic2 production.[26]
Shh plays a key role in keeping RGC axons ipsilateral as well. Shh is expressed by the contralaterally projecting RGCs and midline glial cells. Boc, or Brother of CDO (CAM-related/downregulated by oncogenes), a co-receptor for Shh that influences Shh signaling through Ptch1,[27] seems to mediate this repulsion, as it is only on growth cones coming from the ipsilaterally projecting RGCs.[18]
Other factors influencing ipsilateral RGC growth include the Teneurin family, which are transmembrane adhesion proteins that use homophilic interactions to control guidance, and Nogo, which is expressed by midline radial glia.[28][29] The Nogo receptor is only expressed by VTc RGCs.[10]
Finally, other transcription factors seem to play a significant role in altering. For example, Foxg1, also called Brain-Factor 1, and Foxd1, also called Brain Factor 2, are winged-helix transcription factors that are expressed in the nasal and temporal optic cups and the optic vesicles begin to evaginate from the neural tube. These factors are also expressed in the ventral diencephalon, with Foxd1 expressed near the chiasm, while Foxg1 is expressed more rostrally. They appear to play a role in defining the ipsilateral projection by altering expression of Zic2 and EphB1 receptor production.[10][30]
Growth in the optic tract[edit]
Once out of the optic chiasm, RGCs will extend dorsocaudally along the ventral diencephalic surface making the optic tract, which will guide them to the superior colliculus and lateral geniculate nucleus in the mammals, or the tectum in lower vertebrates.[10] Sema3d seems to be promote growth, at least in the proximal optic tract, and cytoskeletal re-arrangements at the level of the growth cone appear to be significant.[31]
Myelination[edit]
In most mammals, the axons of retinal ganglion cells are not myelinated where they pass through the retina. However, the parts of axons that are beyond the retina, are myelinated. This myelination pattern is functionally explained by the relatively high opacity of myelin—myelinated axons passing over the retina would absorb some of the light before it reaches the photoreceptor layer, reducing the quality of vision. There are human eye diseases where this does, in fact, happen. In some vertebrates, such as the chicken, the ganglion cell axons are myelinated inside the retina.[32]
See also[edit]
- Ganglion cell
- Receptive field
References[edit]
- ^ Masland RH (January 2012). «The tasks of amacrine cells». Visual Neuroscience. 29 (1): 3–9. doi:10.1017/s0952523811000344. PMC 3652807. PMID 22416289.
- ^ Watson AB (June 2014). «A formula for human retinal ganglion cell receptive field density as a function of visual field location» (PDF). Journal of Vision. 14 (7): 15. doi:10.1167/14.7.15. PMID 24982468.
- ^ Curcio CA, Sloan KR, Kalina RE, Hendrickson AE (February 1990). «Human photoreceptor topography» (PDF). The Journal of Comparative Neurology. 292 (4): 497–523. doi:10.1002/cne.902920402. PMID 2324310. S2CID 24649779.
- ^ Principles of Neural Science 4th Ed. Kandel et al.
- ^ a b c Schottdorf M, Lee BB (June 2021). «A quantitative description of macaque ganglion cell responses to natural scenes: the interplay of time and space». The Journal of Physiology. 599 (12): 3169–3193. doi:10.1113/JP281200. PMC 8998785. PMID 33913164. S2CID 233448275.
- ^ «Ionic conductances underlying excitability in tonically firing retinal ganglion cells of adult rat».
- ^ Henne J, Pöttering S, Jeserich G (December 2000). «Voltage-gated potassium channels in retinal ganglion cells of trout: a combined biophysical, pharmacological, and single-cell RT-PCR approach». Journal of Neuroscience Research. 62 (5): 629–37. doi:10.1002/1097-4547(20001201)62:5<629::AID-JNR2>3.0.CO;2-X. PMID 11104501. S2CID 44513007.
- ^ Henne J, Jeserich G (January 2004). «Maturation of spiking activity in trout retinal ganglion cells coincides with upregulation of Kv3.1- and BK-related potassium channels». Journal of Neuroscience Research. 75 (1): 44–54. doi:10.1002/jnr.10830. PMID 14689447. S2CID 38851244.
- ^ Jadeja RN, Thounaojam MC, Martin PM (2020). «Implications of NAD + Metabolism in the Aging Retina and Retinal Degeneration». Oxidative Medicine and Cellular Longevity. 2020: 2692794. doi:10.1155/2020/2692794. PMC 7238357. PMID 32454935.
- ^ a b c d e f g h i j k Erskine L, Herrera E (2014-01-01). «Connecting the retina to the brain». ASN Neuro. 6 (6): 175909141456210. doi:10.1177/1759091414562107. PMC 4720220. PMID 25504540.
- ^ Petros TJ, Rebsam A, Mason CA (2008-01-01). «Retinal axon growth at the optic chiasm: to cross or not to cross». Annual Review of Neuroscience. 31: 295–315. doi:10.1146/annurev.neuro.31.060407.125609. PMID 18558857.
- ^ Pacal M, Bremner R (May 2014). «Induction of the ganglion cell differentiation program in human retinal progenitors before cell cycle exit». Developmental Dynamics. 243 (5): 712–29. doi:10.1002/dvdy.24103. PMID 24339342. S2CID 4133348.
- ^ a b Hufnagel RB, Le TT, Riesenberg AL, Brown NL (April 2010). «Neurog2 controls the leading edge of neurogenesis in the mammalian retina». Developmental Biology. 340 (2): 490–503. doi:10.1016/j.ydbio.2010.02.002. PMC 2854206. PMID 20144606.
- ^ Lo Giudice Q, Leleu M, La Manno G, Fabre PJ (September 2019). «Single-cell transcriptional logic of cell-fate specification and axon guidance in early-born retinal neurons». Development. 146 (17): dev178103. doi:10.1242/dev.178103. PMID 31399471.
- ^ Icha J, Kunath C, Rocha-Martins M, Norden C (October 2016). «Independent modes of ganglion cell translocation ensure correct lamination of the zebrafish retina». The Journal of Cell Biology. 215 (2): 259–275. doi:10.1083/jcb.201604095. PMC 5084647. PMID 27810916.
- ^ Randlett O, Poggi L, Zolessi FR, Harris WA (April 2011). «The oriented emergence of axons from retinal ganglion cells is directed by laminin contact in vivo». Neuron. 70 (2): 266–80. doi:10.1016/j.neuron.2011.03.013. PMC 3087191. PMID 21521613.
- ^ a b Thompson H, Andrews W, Parnavelas JG, Erskine L (November 2009). «Robo2 is required for Slit-mediated intraretinal axon guidance». Developmental Biology. 335 (2): 418–26. doi:10.1016/j.ydbio.2009.09.034. PMC 2814049. PMID 19782674.
- ^ a b Sánchez-Camacho C, Bovolenta P (November 2008). «Autonomous and non-autonomous Shh signalling mediate the in vivo growth and guidance of mouse retinal ganglion cell axons». Development. 135 (21): 3531–41. doi:10.1242/dev.023663. PMID 18832395.
- ^ Höpker VH, Shewan D, Tessier-Lavigne M, Poo M, Holt C (September 1999). «Growth-cone attraction to netrin-1 is converted to repulsion by laminin-1». Nature. 401 (6748): 69–73. Bibcode:1999Natur.401…69H. doi:10.1038/43441. PMID 10485706. S2CID 205033254.
- ^ Kim N, Min KW, Kang KH, Lee EJ, Kim HT, Moon K, et al. (September 2014). «Regulation of retinal axon growth by secreted Vax1 homeodomain protein». eLife. 3: e02671. doi:10.7554/eLife.02671. PMC 4178304. PMID 25201875.
- ^ Sretavan DW, Feng L, Puré E, Reichardt LF (May 1994). «Embryonic neurons of the developing optic chiasm express L1 and CD44, cell surface molecules with opposing effects on retinal axon growth». Neuron. 12 (5): 957–75. doi:10.1016/0896-6273(94)90307-7. PMC 2711898. PMID 7514428.
- ^ Wright KM, Lyon KA, Leung H, Leahy DJ, Ma L, Ginty DD (December 2012). «Dystroglycan organizes axon guidance cue localization and axonal pathfinding». Neuron. 76 (5): 931–44. doi:10.1016/j.neuron.2012.10.009. PMC 3526105. PMID 23217742.
- ^ Erskine L, Reijntjes S, Pratt T, Denti L, Schwarz Q, Vieira JM, et al. (June 2011). «VEGF signaling through neuropilin 1 guides commissural axon crossing at the optic chiasm». Neuron. 70 (5): 951–65. doi:10.1016/j.neuron.2011.02.052. PMC 3114076. PMID 21658587.
- ^ Dell AL, Fried-Cassorla E, Xu H, Raper JA (July 2013). «cAMP-induced expression of neuropilin1 promotes retinal axon crossing in the zebrafish optic chiasm». The Journal of Neuroscience. 33 (27): 11076–88. doi:10.1523/JNEUROSCI.0197-13.2013. PMC 3719991. PMID 23825413.
- ^ Xu NJ, Henkemeyer M (February 2012). «Ephrin reverse signaling in axon guidance and synaptogenesis». Seminars in Cell & Developmental Biology. 23 (1): 58–64. doi:10.1016/j.semcdb.2011.10.024. PMC 3288821. PMID 22044884.
- ^ Pak W, Hindges R, Lim YS, Pfaff SL, O’Leary DD (November 2004). «Magnitude of binocular vision controlled by islet-2 repression of a genetic program that specifies laterality of retinal axon pathfinding». Cell. 119 (4): 567–78. doi:10.1016/j.cell.2004.10.026. PMID 15537545. S2CID 16663526.
- ^ Allen BL, Song JY, Izzi L, Althaus IW, Kang JS, Charron F, et al. (June 2011). «Overlapping roles and collective requirement for the coreceptors GAS1, CDO, and BOC in SHH pathway function». Developmental Cell. 20 (6): 775–87. doi:10.1016/j.devcel.2011.04.018. PMC 3121104. PMID 21664576.
- ^ Wang J, Chan CK, Taylor JS, Chan SO (June 2008). «Localization of Nogo and its receptor in the optic pathway of mouse embryos». Journal of Neuroscience Research. 86 (8): 1721–33. doi:10.1002/jnr.21626. PMID 18214994. S2CID 25123173.
- ^ Kenzelmann D, Chiquet-Ehrismann R, Leachman NT, Tucker RP (March 2008). «Teneurin-1 is expressed in interconnected regions of the developing brain and is processed in vivo». BMC Developmental Biology. 8: 30. doi:10.1186/1471-213X-8-30. PMC 2289808. PMID 18366734.
- ^ Herrera E, Marcus R, Li S, Williams SE, Erskine L, Lai E, Mason C (November 2004). «Foxd1 is required for proper formation of the optic chiasm». Development. 131 (22): 5727–39. doi:10.1242/dev.01431. PMID 15509772.
- ^ Sakai JA, Halloran MC (March 2006). «Semaphorin 3d guides laterality of retinal ganglion cell projections in zebrafish». Development. 133 (6): 1035–44. doi:10.1242/dev.02272. PMID 16467361.
- ^ Villegas GM (July 1960). «Electron microscopic study of the vertebrate retina». The Journal of General Physiology. 43(6)Suppl (6): 15–43. doi:10.1085/jgp.43.6.15. PMC 2195075. PMID 13842313.
External links[edit]
- Diagram at mit.edu
- Overview and diagrams at webexhibits.org
- Neuronbank Wiki page on RGCs
- NIF Search — Retinal Ganglion Cell via the Neuroscience Information Framework
Сетчатка является внутренней чувствительной оболочкой глаза (tunica interna sensoria bulbi, или retina), которая выстилает полость глазного яблока изнутри и выполняет функции восприятия световых и цветовых сигналов, их первичной обработки и трансформации в нервное возбуждение.
В сетчатке выделяют две функционально различные части – зрительную (оптическую) и слепую (ресничную). Зрительная часть сетчатой оболочки глаза – это большая часть сетчатки, которая свободно прилегает к сосудистой оболочке и прикрепляется к подлежащим тканям только в области диска зрительного нерва и у зубчатой линии. Свободнолежащая часть сетчатки, непосредственно соприкасающаяся с сосудистой оболочкой, удерживается за счет давления, создаваемого стекловидным телом, а также за счет тонких связей пигментного эпителия. Ресничная часть сетчатки покрывает заднюю поверхность ресничного тела и радужки, доходя до зрачкового края.
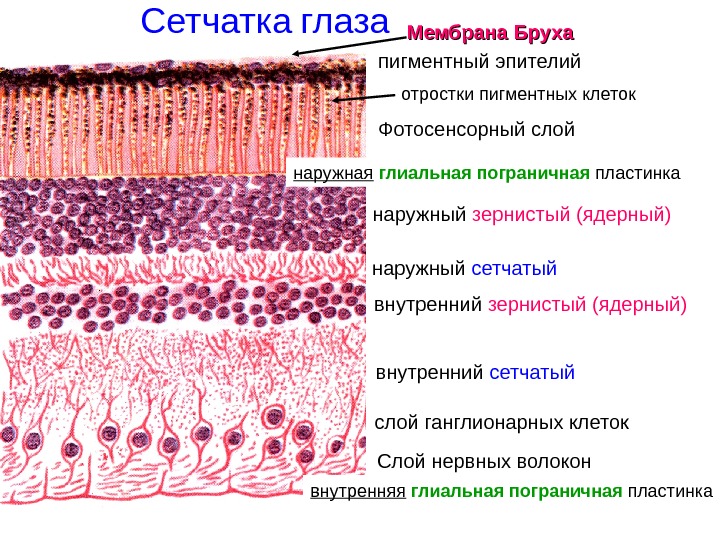
Наружная часть сетчатки называется пигментной, внутренняя – светочувствительной (нервной) частью. Сетчатка состоит из 10 слоев, в состав которых входят разные типы клеток. Сетчатка на срезе представлена в виде трех радиально расположенных нейронов (нервных клеток): наружного – фоторецепторного, среднего – ассоциативного, и внутреннего – ганглионарного. Между этими нейронами располагаются т.н. плексиформные (от лат. plexus — сплетение) слои сетчатой оболочки, представленные отростками нервных клеток (фоторецепторов, биполярных и ганглиозных нейронов), аксонами и дендритами. Аксоны проводят нервный импульс от тела данной нервной клетки к другим нейронам или иннервируемым органам и тканям, дендриты же проводят нервные импульсы в обратном направлении — к телу нервной клетки. Помимо этого в сетчатке расположены интернейроны, представленные амакриновыми и горизонтальными клетками.
Слои сетчатки
Сетчатка имеет 10 слоев:
- Первый слой сетчатки – это пигментный эпителий, который прилежит непосредственно к мембране Бруха сосудистой оболочки глаза. Его клетки окружают фоторецепторы (колбочкии палочки), частично заходя между ними в виде пальцевидных выпячиваний, благодаря чему площадь контакта между слоями увеличивается. Под действием света включения пигмента перемещаются из тела пигментных клеток к их отросткам, что предотвращает рассеивание света между соседними фоторецепторными клетками (колбочками или палочками). Клетки этого слоя фагоцитируют отторгающиеся сегменты фоторецепторов, а также обеспечивают доставку кислорода, солей, метаболитов от хориоидеик фоторецепторам и в обратном направлении, тем самым регулируя баланс электролитов в сетчатке и определяя ее биоэлектрическую активность и степень антиоксидантной защиты. Клетки пигментного эпителия удаляют жидкость из субретинального пространства, способствуют максимально плотному прилеганию зрительной сетчатки к сосудистой оболочке глаза, принимают участия в процессах рубцевания при заживлении очага воспаления.
- Второй слой сетчатки представлен наружными сегментами светочувствительных клеток, колбочек и палочек – специализированных высокодифференцированных нервных клеток. Колбочки и палочки имеют цилиндрическую форму, в которой различают наружный сегмент, внутренний сегмент, а также пресинаптическое окончание, к которому подходят нервные отростки (дендриты) горизонтальных и биполярных клеток. Строение палочек и колбочек различно: наружный сегмент палочек представлен в виде тонкого палочкоподобного цилиндра, содержащего зрительный пигмент родопсин, в то время как наружный сегмент колбочек конически расширен, он короче и толще, чем у палочек, и содержит зрительный пигмент иодопсин.
Наружный сегмент фоторецепторов имеет важное значение: именно здесь происходят сложные фотохимические процессы, в ходе которых происходит первичная трансформация энергии света в физиологическое возбуждение. Функциональное назначение колбочек и палочек также различно: колбочки отвечают за цветоощущение и центральное зрение, обеспечивают периферическое зрение в условиях высокой освещенности; палочки обеспечивают зрение в условиях низкой освещенности (сумеречное зрение). В темноте периферическое зрение обеспечивается совместными усилиями колбочек и палочек.
- Третий слой сетчатки представлен наружной пограничной мембраной, или окончатой мембраной Верхофа, это так называемая полоса межклеточных сцеплений. Сквозь эту мембрану в субретинальное пространство проходят наружные сегменты колбочек и палочек.
- Четвертый слой сетчатки называется наружным ядерным слоем, поскольку образован ядрами колбочек и палочек.
- Пятый слой – наружный плексиформный слой, его также называют сетчатым слоем, он отделяет наружный ядерный слой от внутреннего.
- Шестой слой сетчатой оболочки – это внутренний ядерный слой, он представлен ядрами нейронов второго порядка (биполярных клеток), а также ядрами горизонтальных, амакриновых и мюллеровских клеток.
- Седьмой слой сетчатки – внутренний плексиформный слой, он состоит из клубка переплетенных отростков нервных клеток и отделяет внутренний ядерный слой от слоя ганглиозных клеток. Седьмой слой разделяет внутреннюю сосудистую часть сетчатой оболочки и наружную бессосудистую, которая всецело зависит от поступления кислорода и питательных веществ из прилежащей сосудистой оболочки.
- Восьмой слой сетчатки образован нейронами второго порядка (ганглиозными клетками), по направлению от центральной ямки к периферии его толщина отчетливо уменьшается: непосредственно в области вокруг ямки данный слой представлен как минимум пятью рядами ганглиозных клеток, к периферии число рядов нейронов постепенно уменьшается.
- Девятый слой сетчатки представлен аксонами ганглиозных клеток (нейронов второго порядка), которые образуют зрительный нерв.
- Десятый слой сетчатки – последний, он покрывает поверхность сетчатой оболочки изнутри и представляет собой внутреннюю пограничную мембрану. Это основная мембрана сетчатки, образованная основаниями нервных отростков клеток Мюллера (нейроглиальных клеток).
Клетки Мюллера представляют собой гигантские высокоспециализированные, которые проходят чрез все слои сетчатой оболочки, выполняя изолирующую и опорную функции. Клетки Мюллера принимают участие в генерировании биоэлектрических электрических импульсов, активно транспортируя метаболиты. Мюллеровские клетки заполняют узкие щели между нервными клетками сетчатки и разделяют их рецептивные поверхности.
Палочковый путь проведения нервного импульса представлен палочковым фоторецептором, биполярными и ганглиозными клетками, амакриновыми клетками нескольких видов (промежуточными нейронами). Палочковые фоторецепторы контактируют только с биполярными клетками, которые под действием света деполяризуются.
Колбочковый путь проведения нервных импульсов характеризуется тем, что уже в пятом слое (наружный плексиформный слой) синапсы колбочек связывают их с биполярными нейронами различных типов, образуя как световой, так и темновой путь проведения импульса. Благодаря этому колбочки макулярной области формируют каналы контрастной чувствительности. По мере удаления от области макулы количество фоторецепторов, соединенных с множеством биполярных клеток, уменьшается, в то же время число биполярных нейронов, соединенных с одной биполярной клеткой, увеличивается.
Световой импульс активирует превращение зрительного пигмента, запуская возникновение рецепторного потенциала, который распространяется вдоль аксона к синапсу, где вызывает выделение нейромедиатора. Этот процесс приводит к возбуждению нейронов сетчатки, которые осуществляют первичную обработку зрительной информации. Далее эта информация предается по зрительному нерву в зрительные центры головного мозга.
В процессе передачи нервного возбуждения по нейронам сетчатки важное значение имеют соединения из группы эндогенных трансмиттеров, к которым относятся аспартат (специфичен для палочек), глутамат, ацетилхолин (является трансмиттером амакриновых клеток), допамин, мелатонин (синтезируется в фоторецепторах), глицин, серотонин. Ацетилхолин является трансмиттером возбуждения, а гамма-аминомасляная кислота (ГАМК) – торможения, оба эти соединения содержатся в амакриновых клетках. Тонкий баланс указанных веществ обеспечивает функционирование сетчатки, а нарушение такового может приводить к развитию различных патологий сетчатки (пигментный ретинит, лекарственная ретинопатия и т.п.)
+7 (727) 230 11 11
+7 (727) 317 23 66
Ссылки
Новости
Серова Н.К.
НИИ нейрохирургии им. Н.Н. Бурденко РАМН, Москва
Еричев В.П.
ФГБУ «Научно-исследовательский институт глазных болезней» РАМН, Москва
Панюшкина Л.А.
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, Российская Федерация, 119021
Структурные изменения сетчатки и зрительного нерва при поражении центрального неврона зрительного пути
Авторы:
Елисеева Н.М., Серова Н.К., Еричев В.П., Панюшкина Л.А.
Как цитировать:
Елисеева Н.М., Серова Н.К., Еричев В.П., Панюшкина Л.А. Структурные изменения сетчатки и зрительного нерва при поражении центрального неврона зрительного пути. Вестник офтальмологии.
2017;133(4):25‑30.
Eliseeva NM, Serova NK, Erichev VP, Panyushkina LA. Structural retinal and optic nerve changes in patients with post-geniculate visual pathway damage. Vestnik Oftalmologii. 2017;133(4):25‑30. (In Russ.)
https://doi.org/10.17116/oftalma2017133425-30

Различные заболевания головного мозга, в том числе опухоли, сосудистые поражения, а также черепно-мозговая травма, нередко приводят к повреждению различных участков зрительного анализатора. Зрительный путь, пострадавший в результате нейрохирургической патологии, является моделью, позволяющей изучать развитие такого патологического процесса, как атрофия нервного волокна.
Известно, что нервные волокна, составляющие передний отрезок зрительного пути (зрительные нервы, хиазма, зрительные тракты), представляют собой аксоны ганглиозных клеток сетчатки, которые имеют определенную топографию как на уровне сетчатки, так и по ходу всего зрительного пути [1—3]. Зрительные волокна, идущие от носовых половин сетчатки, перекрещиваются в хиазме. Волокна, идущие от височных половин сетчатки, остаются неперекрещенными. Зрительные тракты образуют аксоны ганглиозных клеток височной половины сетчатки ипсилатерального глаза и носовой половины сетчатки контралатерального глаза.
В наружном коленчатом теле заканчивается передний отрезок зрительного пути. Здесь аксоны ганглиозных клеток сетчатки через синапсы передают нервный импульс клеткам центрального неврона.
При поражении зрительного пути его атрофия может идти в антеградном направлении. Экспериментальные исследования доказали существование ретроградной транссинаптической дегенерации зрительного пути у животных [4, 5]. Но до недавнего времени считалось, что при приобретенном поражении центрального неврона зрительного пути человека атрофия нервного волокна заканчивается на уровне синапсов в наружном коленчатом теле и не распространяется на передний отрезок зрительного пути [6]. В последние годы появились работы, в которых на основании данных оптической когерентной томографии (ОКТ) показана возможность существования приобретенной транссинаптической ретроградной дегенерации нервных волокон зрительного пути человека [7, 8].
Цель исследования — оценить возможность существования ретроградной транссинаптической атрофии нервных волокон при приобретенном поражении центрального неврона зрительного пути.
Материал и методы
Обследованы 22 пациента в возрасте от 13 до 70 лет (медиана 44 года) с поражением центрального неврона зрительного пути. У 19 пациентов выявлены опухоли (у 17 — внутримозговые, у 2 — внемозговые), у 1 — артериовенозная мальформация сосудов головного мозга, 1 больной перенес острое нарушение мозгового кровообращения, 1 — черепно-мозговую травму.
Всем пациентам проводили исследование остроты зрение, поля зрения (в зависимости от общего состояния пациента — методом кинетической или автоматической статической периметрии), офтальмоскопию, ОКТ сетчатки и зрительного нерва, магнитно-резонансную томографию (МРТ) головного мозга, компьютерную томографию (КТ) головного мозга в послеоперационном периоде.
Автоматическую статическую периметрию выполняли с помощью анализатора полей зрения Humpyrey Visual Field Analyzer II-I Series по пороговой стратегии с применением программы 30−2 SITA Standard.
ОКТ сетчатки и зрительного нерва проводили с использованием аппарата RTVue-100 («Optovue»). Каждому пациенту осуществляли сканирование в режиме линейных сканов (cross line), определяли параметры диска зрительного нерва (протоколы ONH и RNFL), анализировали карту толщины комплекса ганглиозных клеток сетчатки (протокол Ganglion Cell Complex — GCC). Определяли показатели уровня фокальных и глобальных потерь комплекса ганглиозных клеток сетчатки (FLV и GLV соответственно). Параметр FLV определяется как средняя величина отклонения от нормативных данных для областей с существенными значениями потерь комплекса ганглиозных клеток сетчатки (GCC). Под существенными потерями подразумеваются потери, превышающие на 65% величину стандартного отклонения (стандартное отклонение 5% от нормативного значения для данной точки). Уровень фокальных потерь измеряется в процентах и отражает глубину потерь GCC. Параметр GLV определяется как сумма всех относительных дефектов, нормализованная к общей площади карты измерений, т. е. усредненный по площади процент потерь комплекса GCC.
Оценивали локализацию преимущественного истончения комплекса ганглиозных клеток сетчатки по обе стороны от условной вертикальной линии, проходящей на уровне фовеолы, и соответствие стороны истончения комплекса ганглиозных клеток сетчатки стороне поражения головного мозга.
Анализировали топографию поражения перипипиллярного слоя нервных волокон и ее соответствие стороне поражения центрального неврона зрительного пути в головном мозге.
У 10 пациентов патологический очаг располагался в височной доле головного мозга, у 2 — в затылочной доле, у 3 — в височно-затылочной, у 3 — в теменно-затылочной, у 1 — в височно-теменной, у 1 — в области подкорки мозга, у 1— в области фалькстенториального угла, у 1 — в области задней трети верхнего сагиттального синуса.
Больных с поражением центрального неврона зрительного пути в левом полушарии головного мозга было 14, в правом полушарии — 8. Соответственно очагу поражения больных с правосторонней гомонимной гемианопсией было 14, с левосторонней — 8. Неполная верхнеквадрантная гомонимная гемианопсия выявлена у 4 пациентов, полная — у 2, неполная гомонимная гемианопсия с сужением как в верхнем, так и нижнем квадранте — у 7 больных, полная гомонимная гемианопсия — у 10.
Давность гемианопсии составила от 7 дней до 8 лет (медиана 1 год). У 10 пациентов давность появления гемианопсии была менее 6 мес, у 12 — более 6 мес.
Из исследования были исключены пациенты с сопутствующей патологией глазного яблока, которая могла вызывать нарушение поля зрения и истончение комплекса ганглиозных клеток сетчатки и перипапиллярного слоя нервных волокон (в частности, глаукома, ишемическая оптическая нейропатия, макулодистрофия).
Результаты и обсуждение
При исследовании 22 пациентов с поражением центрального неврона зрительного пути у 14 выявлено патологическое истончение GCC и/или перипапиллярного слоя нервных волокон (RNFL), у 5 из них определялось патологическое истончение только GCC, у 7 имелось сочетание истончения GCC и RNFL, у 2 — патологическое истончение лишь RNFL. У 8 больных патологии GGC и RNFL не выявлено.
При исследовании уровня фокальных и глобальных потерь GCC патологические значения чаще встречались при определении FLV (у 11 из 12 пациентов). Показатели FLV колебались от 1,3 до 12,6%, медиана составила 4,4%.
Уровень GLV имел нормальные значения в 3 случаях из 12, пограничные — в 2, патологические — в 7 наблюдениях. Значения GLV колебались от 5,3 до 33%, медиана составила 12,4%.
Патологические значения средней толщины комплекса ганглиозных клеток сетчатки (Avg GСС) выявлены у 7 больных. Avg GCC колебалась от 65,55 до 98,07 µm, медиана составила 84,47 µm.
Как видно из вышесказанного, истончение комплекса ганглиозных клеток сетчатки выявлено у 12 пациентов. Мы сопоставили локализацию преимущественного истончения GCC с топографией поражения центрального неврона зрительного пути. Согласно анатомо-физиологическим данным, волокна центрального неврона зрительного пути в каждом полушарии головного мозга через синапсы контактируют с аксонами ганглиозных клеток одноименной стороны сетчатки и «отвечают» за противоположную половину поля зрения [1]. У всех 12 пациентов сторона поражения центрального неврона зрительного пути совпадала со стороной истончения комплекса GCC. У 8 из этих больных выявлены поражение центрального неврона зрительного пути в левом полушарии головного мозга (рис. 1, а) и истончение комплекса GCC слева от вертикальной линии, делящей сетчатку на две половины (см. рис. 1, б). У этих пациентов обнаружена правосторонняя гомонимная гемианопсия (cм. рис. 1, в). У 4 пациентов с поражением центрального неврона зрительного пути в правом полушарии головного мозга на этой же стороне отмечено истончение комплекса GCC, у них выявлена левосторонняя гомонимная гемианопсия.
При исследовании перипапиллярного слоя нервных волокон у 9 пациентов зафиксировано их истончение. У 6 из них установлено поражение центрального неврона зрительного пути в левом полушарии головного мозга (правосторонняя гомонимная гемианопсия), у 3 — поражение центрального неврона зрительного пути в правом полушарии головного мозга (левосторонняя гомонимная гемианопсия).
Мы проанализировали соответствие топографии истончения перипапиллярного слоя нервных волокон локализации поражения центрального неврона зрительного пути. Известно, что сетчатка делится на носовую и височную часть условной вертикальной линией, проходящей на уровне фовеолы. Аксоны, идущие от ганглиозных клеток, расположенных в макулярной области, идут к височной половине диска зрительного нерва (ДЗН) и формируют папилломакулярный пучок. Аксоны ганглиозных клеток, расположенных с носовой стороны от ДЗН и фовеолярной области, идут к носовой стороне ДЗН.
Таким образом, аксоны ганглиозных клеток, расположенных в носовой по отношению в фовеоле стороне, подходят к носовой и височной границам ДЗН в виде «пояска». Аксоны ганглиозных клеток от височной половины сетчатки делают дугу и подходят к верхней и нижней границам ДЗН [1—3] (см. рис. 2).
В отличие от данных, полученных при исследовании комплекса GCC, полное соответствие топографии истончения RNFL стороне поражения центрального неврона зрительного пути отмечено не у всех, а лишь у 2 пациентов. У них перипапиллярный слой нервных волокон, перекрещенных в хиазме, истончался в виде «пояска» с височной и носовой стороны ДЗН; перипапиллярный слой нервных волокон, не перекрещенных в хиазме, истончался по верхней и нижней границе ДЗН.
У остальных 7 пациентов выявлено истончение перипапиллярного слоя нервных волокон, но четких топографических соответствий с поражением центрального неврона зрительного пути отмечено не было.
Таким образом, более точное совпадение топографии поражения зрительных волокон и данных ОКТ прослеживается при исследовании комплекса GCC.
Истончение GCC и RNFL зависело от срока зрительных нарушений. Достоверно чаще (р<0,0009) истончение GCC и RNFL встречалось у пациентов со сроком зрительных нарушений более 6 мес (у всех 12 пациентов) по сравнению с больными, у которых давность поражения центрального неврона зрительного пути составляла менее 6 мес (у 2 из 10 пациентов).
Индекс FLV у больных с давностью гемианопсического дефекта поля зрения до 6 мес колебался от 0,01 до 4,4%, медиана составила 0,5%. Аналогичный параметр у пациентов с давностью гемианопсического дефекта поля зрения более 6 мес колебался от 0,04 до 12,6%, медиана 4,4% (рис. 3).
Мы не выявили достоверных различий объема глобальных и фокальных потерь комплекса ганглиозных клеток сетчатки у пациентов с дефектами поля зрения различной степени выраженности (р>0,05) при давности заболевания более 6 мес. Возможно, последнее обусловлено небольшим количеством наблюдений.
Вопрос существования ретроградной транссинаптической атрофии зрительных волокон человека до настоящего времени оставался дискутабельным. J. Van Buren [4], A. Hendrickson и соавт. [5] в экспериментах на обезьянах показали существование транссинаптической ретроградной дегенерации зрительного пути. Наличие последней в клинической практике описано W. Hoyt и соавт. [2] у пациентов с врожденным поражением центрального неврона зрительного пути. Однако до недавнего времени считалось недоказанным существование транссинаптической ретроградной атрофии зрительных волокон человека при приобретенной патологии [6].
Новые возможности прижизненного исследования структуры сетчатки и зрительного нерва дает ОКТ, которая позволяет хорошо различить слой нервных волокон и ганглиозных клеток сетчатки и измерить их толщину.
Этот метод широко используется в диагностике нейродегенеративных изменений сетчатки и зрительного нерва при глаукоме [9], наследственных оптических нейропатиях [10] и других заболеваниях, характеризующихся поражением переднего отрезка зрительного пути [11—13]. В литературе обсуждается возможность применения ОКТ для раннего выявления болезни Альцгеймера [14].
В настоящее время появились первые работы, где с помощью ОКТ доказывается возможность существования транссинаптической ретроградной атрофии зрительных волокон человека [7, 8, 15, 16]. P. Jindahra и соавт. [8], исследуя с помощью ОКТ перипапиллярный слой нервных волокон, выявили его истончение через 3 мес после ишемического поражении затылочной доли головного мозга.
В ряде последних публикаций [15, 16] отмечается, что при поражении центрального неврона зрительного пути в большей степени страдает комплекс ганглиозных клеток сетчатки, что согласуется c полученными нами результатами.
Заключение
Наше исследование показало возможность существования ретроградной транссинаптической атрофии зрительной системы человека. Истончение комплекса ганглиозных клеток сетчатки соответствует топографии поражения центрального неврона зрительного пути, а его возникновение зависит от сроков заболевания. ОКТ может быть использована для объективной диагностики, уточнения топографии и мониторинга поражения различных отделов зрительного пути, а также для прогноза динамики зрительных функций.
Участие авторов:
Концепция и дизайн исследования: Н.Е., Н.С., В.Е., Л.П.
Сбор и обработка материала: Н.Е., Л.П.
Статистическая обработка: Н.Е.
Написание текста: Н.Е.
Редактирование: Н.С., В.Е., Л.П.
Авторы заявляют об отсутствии конфликта интересов.