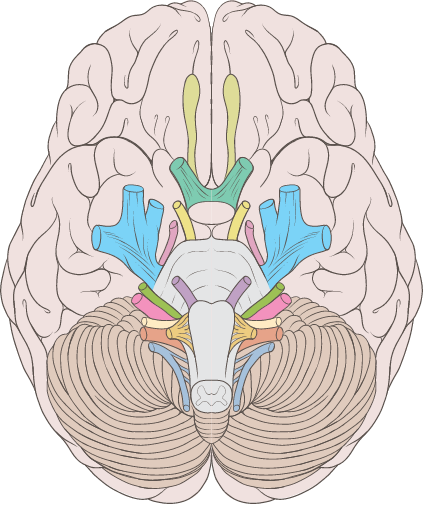
Это нервы специальной
чувствительности – состоят из
висцерочувствительных волокон
(воспринимают химическое раздражение
– запахи). В отличие от других черепных
чувствительных нервов обонятельные
нервы не имеют чувствительного ядра и
узла. Поэтому их называют ложными
черепными нервами. Первый нейрон
располагается на периферии в regio
olfactoria
слизистой оболочки полости носа (верхняя
носовая раковина и верхняя часть
перегородки носа). Дендриты обонятельных
клеток направляются к свободной
поверхности слизистой оболочки, где
заканчиваются обонятельными пузырьками,
а аксоны образуют обонятельные нити,
fili olfactorii,
по 15-20 с каждой стороны, которые через
продырявленную пластинку решетчатой
кости проникают в полость черепа. В
полости черепа они подходят к обонятельным
луковицам, расположенным на нижней
поверхности лобной доли полушарий
мозга, где и заканчиваются. В обонятельных
луковицах находятся вторые нейроны,
аксоны которых образуют обонятельный
тракт, tractus
olfactorius. Этот
тракт идет по нижней поверхности лобной
доли в одноименной борозде и заканчивается
в обонятельном треугольнике, передней
продырявленной субстанции и прозрачной
перегородке, где находятся третьи
нейроны обонятельного пути. Аксоны
третьих нейронов делятся на три пучка:
1. Боковой пучок
направляется к коре крючка, uncus, отдавая
часть волокон миндалевидному телу,
corpus
amygdaloideum.
2. Промежуточный
обонятельный пучок переходит на
противоположную сторону, образуя
переднюю мозговую спайку, и через свод
и бахромку морского коня тоже направляется
в крючок, uncus.
3. Медиальный пучок
тянется вокруг мозолистого тела, а затем
по зубчатой извилине к коре крючка.
Таким образом, обонятельный путь
заканчивается в корковом конце
обонятелъного анализатора – крючке
извилины около морского конька, uncus
gyri parahyppocampalis.
Односторонняя
утрата обоняния, (аносмия) или его
понижение наблюдаются при развитии
патологических процессов в лобной доле
и на основании мозга передней черепной
ямки. Двустороннее расстройство обоняния
чаще является результатом заболеваний
носовой полости и носовых ходов.
II пара – зрительный нерв, nervus opticus. Зрительный и зрачково-рефлекторный пути
Как и обонятельные
нервы, относится к ложным черепным
нервам, не имеет узла и ядра.
Является нервом
специальной чувствительности (световой)
и состоит из волокон, которые представляют
собой совокупность аксонов мультиполярных
ганглиозных клеток сетчатки. Зрительный
нерв начинается диском зрительного
нерва в области зрительной части
сетчатки, ее слепого пятна. Прободая
сосудистую и фиброзные оболочки, выходит
из глазного яблока кнутри и книзу от
заднего полюса глазного яблока. В
соответствии с топографией в зрительном
нерве выделяют четыре части:
– внутриглазную,
прободающую сосудистую оболочку и
склеру глазного яблока;
– глазничную,
простирающуюся от глазного яблока до
зрительного канала;
– внутриканальную,
соответствующую длине зрительного
канала;
– внутричерепную,
расположенную в подпаутинном пространстве
основания головного мозга, протяженностью
от зрительного канала до зрительного
перекреста.
В глазнице,
зрительном канале и в полости черепа
зрительный нерв окружен влагалищем,
листки которого по своему строению
соответствуют оболочкам головного
мозга, а межвлагалищные пространства
соответствуют межоболо-чечным
пространствам.
Три первых нейрона
находятся в сетчатке. Совокупность
светочувствительных клеток сетчатки
(палочек и колбочек) является первыми
нейронами зрительного пути; гигантских
и мел-ких биполярных клеток – вторым
нейроном; мультиполярных, ганглиозных
клеток – третьим нейроном. Аксоны этих
клеток образуют зрительный нерв. Из
глазницы в полость черепа нерв проходит
через зрительный канал, саnа1is
орticus. В
области борозды перекреста, 2/3 всех
нервных волокон, идущих от медиальных
полей зрения перекрещиваются. Эти
волокна идут от внутренних отделов
сетчатки, которая благодаря перекресту
пучков света в хрусталике воспринимает
зрительную информацию с латеральных
сторон. Неперекрещивающиеся волокна,
приблизительно 1/3, направляются в
зрительный тракт своей стороны. Они
идут от латеральных отделов сетчатки,
которая воспринимает свет с носовой
половины поля зрения (эффект хрусталика).
Неполный перекрест зрительных путей
позволяет передавать импульсы из каждого
глаза в оба полушария, обеспечивая
бинокулярное стереоскопическое зрение
и возможность синхронного движения
глазных яблок. После этого частичного
перекреста образуются зрительные
тракты, которые огибают ножки мозга с
латеральной стороны и выходят на
дорсальную часть ствола мозга. Каждый
зрительный тракт содержит волокна от
одноименных половин сетчатки обоих
глаз. Так, в составе правого зрительного
тракта проходят неперекрещенные волокна
от наружной половины правого глаза и
перекрещенные волокна от внутренней
части левого глаза. Следовательно,
правый зрительный тракт проводит нервный
импульс от латеральной части поля зрения
левого глаза и медиальной (носовой)
части поля зрения правого глаза.
Каждый зрительный
тракт разделяется на 3 пучка, которые
идут к подкорковым центрам зрения
(четвертый нейрон зрительного пути):
– верхние бугорки
крыши среднего мозга, colliculi
superiores tecti mesencephalici;
– подушка зрительного
бугра промежуточного мозга, pulvinar
thalami;
– латеральные
коленчатые тела промежуточного мозга,
corpora geniculata
laterale.
Главным подкорковым
центром зрения являются латеральные
коленчатые тела, где заканчивается
большая часть волокон зрительного пути.
Именно здесь располагаются его четвертые
нейроны. Аксоны этих нейронов компактным
пучком проходят через заднюю треть
задней ножки внутренней капсулы, затем
веерообразно рассыпаются образую
зрительную лучистость, radiatio
optica, и
заканчиваются на нейронах коркового
центра зрения медиальной поверхности
затылочной доли по сторонам от шпорной
борозды.
Небольшое количество
волокон зрительных трактов направляется
к нейронам задних ядер зрительного
бугра. Аксоны нейронов этих ядер передают
зрительную информацию в интеграционный
центр промежуточного мозга – медиальное
ядро таламуса, имеющее связи с двигательными
ядрами экстрапирамидной и лимбической
систем гипоталамуса. Указанные структуры
регулируют тонус мускулатуры, осуществляют
эмоционально-поведенческие реакции,
изменяют работу внутренних органов в
ответ на зрительные раздражения.
В верхние бугорки
идет часть волокон, обеспечивающих
безусловно-рефлекторную реакцию глазного
яблока и осуществление зрачкового
рефлекса в ответ на световые раздражения.
Аксоны клеток ядра верхнего бугорка
направляются к двигательным ядрам III,
IV, VI пар черепных нервов, к добавочному
ядру глазодвигательного нерва (ядро
Якубовича), к ядрам ретикулярной формации,
к ядру Кахаля и в интеграционный центр
среднего мозга, который располагается
также в верхних бугорках.
Связи нейронов
верхнего бугорка с двигательными ядрами
Ш, IV, VI пар черепных нервов обеспечивают
двигательную реакцию мышц глазного
яблока на световые раздражения
(бинокулярное зрение), с нейронами ядер
Кахаля позволяет осуществлять
согласованное движение глазных яблок
и головы (поддержание равновесия тела).
От клеток интеграционного центра
среднего мозга начинается
покрышечно-спинномозговой и
покрышечно-ядерные пути, осуществляющие
безусловно-рефлекторные двигательные
реакции мускулатуры туловища, конечностей,
головы и глазных яблок на внезапные
сильные световые раздражения. От клеток
ретикулярной формации начинаются
ретикулопетальные и ретикулоспинальные
пути, регулирующие мышечный тонус во
взаимосвязи с экзогенными раздражениями.
Клетки добавочного ядра глазодвигательного
нерва посылают аксоны к ресничному
узлу, осуществляющему парасимпатическую
иннервацию мышцы, суживающей зрачок и
ресничной мышцы, обеспечивающей
аккомодацию глаза. Цепь нейронов,
обеспечивающих эти реакции, получила
название пути зрачкового рефлекса.
Соседние файлы в папке анатомия
- #
- #
- #
- #
- #
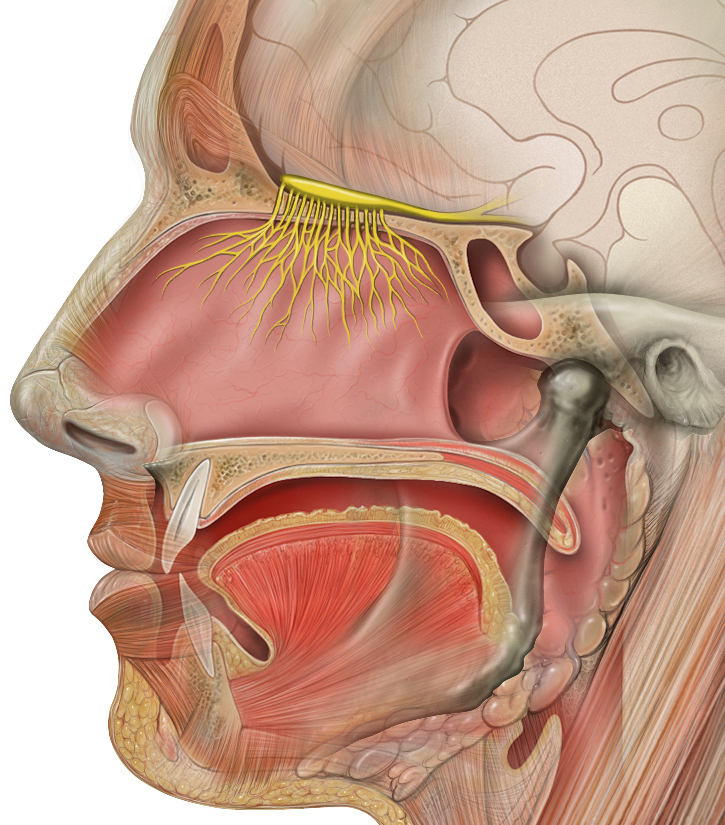
Обонятельный нерв (обонятельные нервы) (лат. nervi olfactorii) — первый из черепномозговых (черепных) нервов, отвечающий за обонятельную чувствительность.
Анатомия
Обонятельные нервы представляют собой нервы специальной чувствительности — обонятельной. Они начинаются от обонятельных нейросенсорных клеток, образующих первый нейрон обонятельного пути и залегающих в обонятельной области слизистой оболочки полости носа. В виде 15-20 тонких нервных стволов (обонятельные нити), состоящих из безмиелиновых нервных волокон, они, не образуя общего ствола обонятельного нерва, проникают через горизонтальную пластинку решётчатой кости (лат. lamina cribrosa os ethmoidale) в полость черепа, где вступают в обонятельную луковицу (лат. bulbus olfactorius) (здесь лежит тело второго нейрона), переходящую в обонятельный тракт (лат. tractus olfactorius), представляющий собой аксоны клеток, залегающих в (лат. bulbus olfactorius). Обонятельный тракт переходит в обонятельный треугольник (лат. ). Последний состоит преимущественно из нервных клеток и разделяется на две обонятельные полоски, вступающие в переднее продырявленное вещество (лат. substantia perforata anterior), лат. area subcallosa и прозрачную перегородку (лат. septum pellucidum), где находятся тела третьих нейронов. Затем волокна клеток этих образований различными путями достигают коркового конца обонятельного анализатора, залегающего в области крючка (лат. uncus) и парагиппокампальную извилины лат. gyrus parahyppocampalis височной доли больших полушарий мозга.
Функция
Схема внечерепной части обонятельного нерва, обонятельной луковицы и обонятельных трактов (показаны жёлтым)
Обонятельные нервы — нервы специальной чувствительности.
Система обоняния начинается с обонятельной части слизистой носа (область верхнего носового хода и верхней части носовой перегородки). В ней находятся тела первых нейронов обонятельного анализатора. Эти клетки являются биполярными.
Как уже было отмечено выше, обонятельный анализатор представляет собой трёхнейронную цепь:
- Тела первых нейронов представлены биполярными клетками, находящимися в слизистой носа. Их дендриты оканчиваются на поверхности слизистой носа и образуют рецепторный аппарат обоняния. Аксоны этих клеток в виде обонятельных нитей заканчиваются на телах вторых нейронов, морфологически находящихся в обонятельных луковицах
- Аксоны вторых нейронов формируют обонятельные тракты, которые оканчиваются на телах третьих нейронов в переднем продырявленном веществе (лат. substantia perforata anterior), лат. area subcallosa и прозрачной перегородке (лат. septum pellucidum)
- Тела третьих нейронов также называются первичными обонятельными центрами. Важно отметить, что первичные обонятельные центры связаны с корковыми территориями как своей, так и противоположной стороны; переход части волокон на другую сторону происходит через переднюю спайку (лат. comissura anterior). Кроме этого, она обеспечивает связь с лимбической системой. Аксоны третьих нейронов направляются к передним отделам парагиппокампальной извилины, где расположено цитоархитектоническое поле Бродмана 28. В этой области коры представлены проекционные поля и ассоциативная зона обонятельной системы.
Запах, вызывающий аппетит, вызывает одновременно рефлекс слюноотделения, тогда как неприятный запах приводит к тошноте и рвоте. Эти реакции связаны с эмоциями. Запахи, могут быть приятными или неприятными. Основными волокнами, обеспечивающими связь обонятельной системы с автономными зонами мозга, являются волокна медиальных пучков переднего мозга и мозговых полосок зрительного бугра.
Медиальный пучок переднего мозга состоит из волокон, которые восходят от базальной обонятельной области, периминдалевидной области и ядер перегородки. На своём пути через гипоталамус часть волокон заканчивается на ядрах подбугорной области. Большинство же волокон направляется в ствол мозга и осуществляет контакт с вегетативными зонами ретикулярной формации, со слюноотделительными и дорсальными ядрами лат. n.intermedius (нерв Врисберга), языкоглоточного (лат. n. glossopharyngeus) и блуждающего (лат. n.vagus) нервов.
Мозговые полоски зрительного бугра отдают синапсы к ядрам поводка. От этих ядер к межножковому ядру (узлу Гансера) и к ядрам покрышки идёт поводково-ножковый путь, а от них волокна направляются к вегетативным центрам ретикулярной формации ствола мозга.
Волокна, осуществляющие связь обонятельной системы со зрительным бугром, гипоталамусом и лимбической системой, вероятно, и обеспечивают сопровождение обонятельных раздражителей эмоциями. Область перегородки, кроме прочих мозговых зон, связана через ассоциативные волокна с поясной извилиной (лат. gyrus cinguli).
Клиника поражения
Аносмия и гипосмия
Аносмия (отсутствие обоняния) или гипосмия (снижение обоняния) с обеих сторон чаще отмечается при заболеваниях слизистой носа. Гипосмия или аносмия с одной стороны — обычно признак серьёзного заболевания.
Возможные причины аносмии:
- Недоразвитие обонятельных путей.
- Заболевания обонятельной слизистой носа (ринит, опухоли носа и т. д.).
- Разрыв обонятельных нитей при переломе lamina cribrosa решётчатой кости вследствие черепно-мозговой травмы.
- Деструкция обонятельных луковиц и путей при очаге ушиба по типу противоудара, наблюдаемый при падении на затылок
- Воспаление пазух решётчатой кости (лат. os ethmoidale, воспалительный процесс прилежащей мягкой мозговой оболочки и окружающих областей.
- Срединные опухоли или другие объёмные образования передней черепной ямки.
Следует обратить внимание, что прерывание целостности путей, идущих от первичных обонятельных центров, не ведёт к аносмии, так как они являются двусторонними.
Гиперосмия
Гиперосмия — повышенное обоняние отмечается при некоторых формах истерии и иногда у кокаиновых наркоманов.
Паросмия
Извращённое ощущение запаха наблюдается в некоторых случаях шизофрении, поражения крючка парагиппокампальной извилины и при истериях. К паросмии можно отнести получение приятных эмоций от запаха бензина и других технических жидкостей у больных железодефицитной анемией.
Обонятельные галлюцинации
Обонятельные галлюцинации наблюдаются при некоторых психозах. Могут являться аурой эпилептического припадка, которые вызываются наличием патологического очага в области височной доли.
Также
Обонятельный нерв может служить входными воротами для инфекций мозга и менингеальных оболочек. Больной может не осознавать потерю обоняния. Вместо этого он в связи с исчезновением обоняния может жаловаться на нарушение вкусовых ощущений, поскольку восприятие запахов очень важно для формирования вкуса пищи (прослеживается связь между обонятельной системой и лат. nucleus tractus solitarii).
Методика исследования
Состояние обоняния характеризуется способностью восприятия запахов различной интенсивности каждой половиной носа в отдельности и идентификации (узнавания) различных запахов. При спокойном дыхании и закрытых глазах проводится прижатие пальцем крыла носа с одной стороны и постепенное приближение пахучего вещества к другой ноздре. Лучше использовать знакомые нераздражающие запахи (летучие масла): хозяйственное мыло, розовую воду (или одеколон), горькоминдальную воду (или валериановые капли), камфору. Следует избегать использования раздражающих веществ, таких как нашатырный спирт или уксус, так как при этом одновременно возникает раздражение окончаний тройничного нерва (лат. n.trigeminus). Отмечается, правильно ли идентифицируются запахи. При этом необходимо иметь в виду, свободны ли носовые пути или имеются катаральные явления из них. Хотя обследуемый может быть неспособным назвать тестируемое вещество, само осознание наличия запаха исключает аносмию.
Olfactory nerve
Jean-Pierre Barral, Alain Croibier, in Manual Therapy for the Cranial Nerves, 2009
10.1.1 Olfactory nerve
The olfactory nerve is shown in Figure 10.1.
Origin
The olfactory nerve originates on the caudal surface of the olfactory bulb and crosses the cribriform plate of the ethmoid bone from one part of the crista galli process to the other, in order to reach the olfactory region of the nasal cavity.
Caudally, the olfactory nerve roots are located superior to the origin of the optic nerve and the anterior cerebral artery.
Pathway
The axons are collected into small bundles that make their way through the subarachnoid space. Sheathed in pia mater, they cross the foramina of the cribriform plate.
The most common cause of injury to the nerves at this level is a fracture of the anterior cranial fossa or the development of an olfactory meningioma.
Terminal branches
The olfactory nerves terminate in the nasal mucosa, which occupies a small surface on the roof of the nasal cavity.
- •
-
The lateral olfactory nerves (12–20) are found in the superior nasal concha.
- •
-
The medial olfactory nerves (12–16) descend along the nasal septum.
One of these medial nerves, the terminal (vomeronasal) nerve, descends obliquely in front of the incisor canal to the vomeronasal organ, a little-known structure to which we will return later.
Note: The olfactory nerves are non-myelinated and consist of bundles of slender fibers held together by thin strips of connective tissue.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780702031007500136
Olfactory Glomeruli: Structure and Circuitry
M.T. Shipley, A.C. Puche, in Encyclopedia of Neuroscience, 2009
The ON→ET→PG Circuit
ON provides monosynaptic input to all ET cells, which in turn monosynaptically excite PG cells. ON-evoked monosynaptic EPSCs in ET cells are followed by a longer latency, compound inhibitory postsynaptic current, which is due to GABAergic input from PG cells. Thus, one extension of the ON→ET→PG circuit is an ON→ET→PG→ET feedback circuit. The temporal sequence of excitation followed by feedback inhibition generated by this circuit may function to shape postsynaptic responses to sensory input possibly by creating a temporal ‘window of opportunity’ for sensory signals to achieve glomerular throughput and influence downstream olfactory circuits. Since only 20% of PG cells receive monosynaptic ON input, some of the intraglomerular inhibition of M/T cell dendrites, classically attributed to the ON→M/T→PG→M/T circuit, may actually be due to the operation of an ON→ET→PG→MT cell circuit.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469018131
Olfactory Nerve
Paul Rea, in Clinical Anatomy of the Cranial Nerves, 2014
The olfactory nerve is the first cranial nerve and conveys special sensory information related to smell. It is the shortest of the cranial nerves and passes from its receptors in the nasal mucosa to the forebrain. It enters the skull through the cribriform plate of the ethmoid bone. It then sends its impulses to be interpreted at various brain regions including the temporal lobe, amygdala, and entorhinal cortex. Simple bedside testing of the olfactory nerve can be done using vanilla essence or coffee extracts. The sense of smell can be altered due to a variety of conditions referred to as hyperosmia, hypoosmia, anosmia, and dysosmia. However, the most common pathology to affect the olfactory nerve is the common cold.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128008980000014
Cranial Nerve Impairments
In Clinical Neurology for Psychiatrists (Sixth Edition), 2007
Olfactory (First)
Olfactory nerves transmit the sensation of smell to the brain. As the work that led to the 2004 Nobel Prize in Physiology or Medicine has shown, olfaction begins with highly complex, genetically determined specific G protein‐coupled odorant receptors. Odoriferous molecules bind onto one or more receptors, which leads to their identification. Rats, who live by their sense of smell, have about 1400 olfactory receptor genes. Humans have about 350 olfactory receptor genes, which comprise almost 1.5% of their total genome.
From the olfactory receptors located deep in the nasal cavity, branches of the pair of olfactory nerves pass upward through the multiple holes in the cribriform plate of the skull to several areas of the brain. Some terminate on the undersurface of the frontal cortex, home of the olfactory sensory areas. Others terminate deep in the hypothalamus and amygdala—cornerstones of the limbic system (see Fig. 16‐5). The olfactory nerves’ input into the limbic system, at least in part, accounts for the influence of smell on psychosexual behavior and memory.
To test the olfactory nerve, the patient is asked to identify certain substances by smelling through one nostril while the examiner compresses the other nostril. Testing must be done with readily identifiable and odoriferous but innocuous substances, such as coffee. Volatile and irritative substances, such as ammonia and alcohol, are not suitable because they may trigger intranasal trigeminal nerve receptors and bypass a possibly damaged olfactory nerve. For detailed testing, physicians might use a commercial set of “scratch and sniff” odors.
When disorders impair both olfactory nerves, patients, who are then said to have anosmia, cannot perceive smells or appreciate the aroma of food. Anosmia has potentially life‐threatening consequences, as when people cannot smell escaping gas. More commonly, food without a perceptible aroma is left virtually tasteless. Thus, people with anosmia, to whom food is completely bland, tend to have a decreased appetite.
One‐sided anosmia may result from tumors adjacent to the olfactory nerve, such an olfactory groove meningioma. In the classic Foster‐Kennedy syndrome, a meningioma compresses the olfactory nerve and the nearby optic nerve. The damage to those two nerves causes the combination of unilateral blindness and anosmia. If the tumor grows into the frontal lobe, it can also produce personality changes, dementia, or seizures.
In most cases of bilateral anosmia, the underlying disturbance is mundane. Anosmia is routine in anyone with nasal congestion and those who regularly smoke cigarettes. Head trauma, even from minor injuries, can shear off the olfactory nerves as they pass through the cribriform plate and cause anosmia (see Head Trauma, Chapter 22).
With advancing age, otherwise normal individuals begin to lose their sense of smell. Studies have shown that more than 50% of individuals older than 65 years and 75% of those older than 80 years have some degree of anosmia. Patients with Alzheimer’s disease, Parkinson’s disease, or other neurodegenerative diseases have even a higher incidence of anosmia. Some researchers have even proposed that testing smell can detect Alzheimer’s disease before cognitive function overtly deteriorates. Schizophrenic patients also have an increased incidence of anosmia but not to the degree of those with the neurodegenerative diseases.
Studies have also shown that loss of olfactory acuity—inability to identify smells—is a risk factor for Alzheimer’s disease. In both older age and neurodegenerative illnesses, particularly Alzheimer’s and Parkinson’s diseases, anosmia reflects degeneration of the olfactory tracts rather than the brain’s olfactory center. In Alzheimer’s disease, portions of the olfactory bulb have the same plaques and tangles that characterize the changes in the cerebral cortex. Similarly, in Creutzfeldt‐Jakob disease, the olfactory nerves contain the same spongiform changes found in the cerebral cortex (see Chapter 7).
Humans with genetic defects in their G protein‐coupled receptor complex have anosmia for one or more specific odors.
Anosmia may, of course, be psychogenic. A psychogenic origin can be revealed when a patient reports being unable to smell either irritative or innocuous, aromatic substances. Such a complete sensory loss would be possible only if an illness completely obliterated both pairs of trigeminal and olfactory nerves.
Olfactory hallucinations may represent the first phase or aura (Latin, breeze) of partial complex seizures that originate in the medial‐inferior surface of the temporal lobe. These auras usually consist of several second episodes of ill‐defined and unpleasant, but often sweet or otherwise pleasant, smells superimposed on impaired consciousness and behavioral disturbances (see Chapter 10). Also, although most migraine auras are visual hallucinations, some individuals experience an olfactory migraine aura (see Chapter 9).
On the other hand, olfactory hallucinations can be purely psychogenic. In contrast to smells induced by uncinate seizures, psychogenic “odors” are almost always foul smelling, are continuous, and not associated with impaired consciousness. However, most abnormal smells, which are typically putrid, originate in sinusitis and other cranial, dental, and cervical infections.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9781416030744100049
Olfactory Bulb Physiology
A.V. Masurkar, W.R. Chen, in Encyclopedia of Neuroscience, 2009
Olfactory Nerve Synapses
Olfactory nerve terminals make excitatory synapses with mitral/tufted cells and certain types of juxtaglomerular cells. These synapses are glutamatergic, and postsynaptic effects involve α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid (AMPA) and N-methyl-d-aspartate (NMDA) receptors as well as metabotropic glutamate receptors. Transmitter release is highly reliable at these terminals, with a release probability of ≥0.8 and a linear dependence on extracellular calcium concentration. The synapses show strong paired pulse depression due to presynaptic activation of γ-aminobutyric acid (GABA) class-B (GABAB) receptors and dopamine D2 receptors by GABA and dopamine released from juxtaglomerular cells. Therefore, monosynaptic and disynaptic activation of GABAergic and dopaminergic juxtaglomerular cells can provide feedback inhibition onto olfactory nerve terminals (Figure 1(a), upper-left inset).
Figure 1. (a) Intraglomerular circuits. Upper-left circular inset, γ-aminobutyric acid (GABA) or dopamine released from periglomerular cells can act presynaptically via GABAB and dopamine D2 receptors on olfactory nerve terminals to inhibit olfactory sensory input. Lower-left inset, a mitral cell glomerular dendritic branch releases glutamate to excite an inhibitory periglomerular cell dendrite, which in turn releases GABA back onto the mitral cell dendrite. Glutamate released from the mitral cell tuft branch can also act on autoreceptors, causing further regenerative release of glutamate. (Upper-right) Glutamate released from one mitral cell dendritic branch spills over to another mitral cell dendrite, causing lateral excitation. (Lower-right) Glutamate released from one mitral cell dendrite acts on autoreceptors, causing self-excitation which spreads into another mitral cell dendrite via electrical coupling to mediate lateral excitation. (b) Interglomerular circuits. Mitral cells, external tufted cells, and subpopulations of periglomerular cells receive monosynaptic inputs from olfactory nerve terminals. Excitation of GABAergic and dopaminergic periglomerular cells can inhibit olfactory nerve input by a presynaptic mechanism. Both mitral and external tufted cells can excite periglomerular cells, which can provide recurrent inhibition. The external tufted cell excites the short-axon cell, which in turn activates the GABAergic periglomerular cell in another glomerulus, causing interglomerular lateral inhibition. EPL, external plexiform layer; ET, external tufted cell; GL, glomerular layer; ON, olfactory nerve; ONL, olfactory nerve layer; PG, periglomerular cell; SA, short-axon cell. Adapted from Aungst, JL, Hayward, PM, Puche, AC, et al. (2003) Centre-surround inhibition among olfactory bulb glomeruli. Nature 426: 623–629. (c) Slow rhythmic activity synchrony between two mitral cells projecting to a common glomerulus. Adapted from Carlson GC, Shipley MT, and Keller A (2000) Long-lasting depolarizations in mitral cells of the rat olfactory bulb. Journal of Neuroscience 20: 2011–2021.
The mitral cell response to olfactory nerve electric stimulation usually exhibits a long-lasting excitatory postsynaptic potential that is mediated by AMPA, NMDA, and type-1 metabotropic glutamate receptors. This process is initially triggered by release of glutamate from olfactory axon terminals and then prolonged by secondary and regenerative glutamate release from excited mitral/tufted-cell dendrodendritic synapses in the glomerulus. Such recurrent excitation further involves glutamate spillover within a glomerulus (Figure 1(a), lower-left and upper-right insets). One likely function for these mechanisms is to amplify weak olfactory input. They are also involved in coordinating intraglomerular neuronal synchrony, as described further below in the section titled ‘Intraglomerular microcircuits.’
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469016879
Cranial Nerve Impairments
David Myland Kaufman MD, … Mark J. Milstein MD, in Kaufman’s Clinical Neurology for Psychiatrists (Eighth Edition), 2017
Olfactory (First)
Olfactory nerves transmit the sensation of smell to the brain. As the work that led to the 2004 Nobel Prize in Physiology or Medicine has shown, olfaction begins with highly complex, genetically determined specific G protein-coupled olfactory receptors. Odiferous molecules bind to one or more receptors that lead to their identification. Rats, which live by their sense of smell, have about 1400 olfactory receptor genes. Humans have about 350 olfactory receptor genes, but they comprise almost 1.5% of our total genome.
From the olfactory receptors located deep in the nasal cavity, branches of the pair of olfactory nerves pass upward through the multiple holes in the cribriform plate of the skull to several areas of the brain. Some branches terminate in entorhinal cortex and other regions on the undersurface of the frontal lobe. Others terminate deep in the hypothalamus and amygdala – cornerstones of the limbic system (see Fig. 16.5). The olfactory nerves’ input into the limbic system accounts, at least in part, for the influence of smell on sexual behavior and memory. Also, unlike other sensations – touch, vision, and hearing – whose pathways synapse in the thalamus or geniculate bodies en route to the cerebral cortex, some olfactory pathways project directly to cortex without an intervening synapse in the diencephalon.
To test the olfactory nerve, neurologists compress one nostril and ask the patient to identify certain substances by smelling through the other. Neurologists use readily identifiable and aromatic but innocuous substances, such as coffee. They do not use volatile or irritative substances, such as ammonia and alcohol, because they may trigger intranasal trigeminal nerve receptors and bypass a possibly damaged olfactory nerve. Patients are unreliable when estimating their sense of smell. For qualitative and quantitative testing, especially for research, neurologists utilize a commercial, standardized set of “scratch and sniff” odors, such as the University of Pennsylvania Smell Identification Test.
When disorders impair both olfactory nerves, patients cannot perceive smells or appreciate the aroma of food. Neurologists say that these patients have anosmia. Anosmia carries potentially life-threatening consequences, for example when patients cannot smell escaping gas. More commonly, their food, without perceptible aroma, is left tasteless. Thus, people with anosmia, to whom food is bland, tend to have a decreased appetite and lose weight.
Lack of smell sensation in one nostril may result from head trauma or a tumor adjacent to the olfactory nerve, such as an olfactory groove meningioma. In the classic Foster–Kennedy syndrome, a meningioma compresses the olfactory nerve and the nearby optic nerve. Damage to those two nerves causes the combination of unilateral blindness and anosmia. If the tumor grows into the frontal lobe, it can also produce personality changes, dementia, or seizures.
Anosmia commonly afflicts anyone with nasal congestion and those who regularly smoke cigarettes. With advancing age, otherwise normal individuals begin to lose their sense of smell. More than 50% of individuals older than 65 years and 75% of those older than 80 years have some degree of anosmia. Also, individuals with genetic mutations in their G protein-coupled receptor complex have anosmia for one or more specific odors.
Although mundane problems underlie most cases of bilateral anosmia, it may reflect more serious issues. Inadvertently inhaling zinc, which had been a constituent of popular “cold remedies,” has caused anosmia. Another situation where inhaled metal caused anosmia has occurred in welders who routinely inhale fumes containing vaporized iron, chromium, aluminum, and other metals. Head trauma, even from minor injuries, can shear the olfactory nerves as they pass through the cribriform plate and cause anosmia (see Traumatic Brain Injury, Chapter 22).
Loss of the sense of smell is also a manifestation of many neurodegenerative illnesses. For example, almost 90% of patients with Parkinson, dementia with Lewy bodies, Wilson, Creutzfeldt–Jakob, and Alzheimer diseases develop anosmia. In fact, among Parkinson disease patients, more have anosmia than tremor, and anosmia correlates with the most disabling manifestation of the illness – dementia. Similarly, anosmia serves as a risk factor for Alzheimer disease. Recent studies have found that the olfactory bulb manifests the same pathology as the cerebral cortex (see Chapter 7) in Alzheimer and Creutzfeldt–Jakob diseases. Schizophrenic patients also have an increased incidence of anosmia, but not to the degree brought on by neurodegenerative diseases.
In a situation opposite to anosmia, sometimes individuals have a heightened sense of smell: hyperosmia. Migraine patients before or during an attack and pregnant women frequently report hypersensitivity to smells or irritation by common, innocuous ones.
Anosmia may, of course, be psychogenic. A psychogenic origin can be revealed when a patient reports being unable to “smell” irritative substances. Such a complete sensory loss would be possible only if an illness completely obliterated both pairs of trigeminal as well as olfactory nerves.
Olfactory hallucinations may represent the first phase or aura (Latin, breeze) of seizures that originate in the medial-inferior surface of the temporal lobe, the uncus. These auras usually consist of a series of several-second episodes of ill-defined and unpleasant, but occasionally sweet or otherwise pleasant, smells preceding or superimposed on impaired consciousness and behavioral disturbances (see Chapter 10). Also, although most migraine auras consist of visual hallucinations, sometimes olfactory hallucinations represent an aura (see Chapter 9).
On the other hand, olfactory hallucinations as well as anosmia can be psychogenic. In contrast to smells induced by seizures, psychogenic “odors” are typically foul-smelling, continuous, and not associated with impaired consciousness. Olfactory hallucinations or delusions may constitute a manifestation of a psychiatric illness. As for identifying malingering, two tests are helpful. Malingerers may claim inability to “smell” a noxious, volatile substance, such as ammonia, that actually stimulates the trigeminal nerve. In the other test, given a forced-choice test of four smells, the malingering individual chooses a correct response less frequently than by chance, i.e., less than 25%.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323415590000046
Nanoparticle systems for nose-to-brain delivery
Qingfeng Liu, Qizhi Zhang, in Brain Targeted Drug Delivery System, 2019
3.1 Olfactory nerve pathways
Olfactory nerve pathways are considered as a major component of nose-to-brain delivery. It was reported that the intranasally administrated 3 kDa fluorescein dextran was transferred in the connective tissue surrounding the olfactory nerve bundles to the olfactory bulb within 15 min (Jansson and Bjork, 2002). The drug concentrations in the olfactory bulbs are generally higher than other CNS parts (Graff et al., 2005; Thorne et al., 2008), and increase of the drug concentration in the olfactory bulbs results in simultaneous increase of drug concentrations in other CNS parts (Dhuria et al., 2009).
Olfactory pathways arise in the olfactory region, which contains four major cell types: ciliated olfactory receptor neurons, supporting cells, basal cells, and microvillar cells (Moran et al., 1982). Olfactory neurons mediate the sense of smell by conveying sensory information from the nasal cavity to the CNS. The dendrites of olfactory neurons extend into the mucous layer of the olfactory epithelium. The axons of these bipolar neurons extend along the lamina propria, pass through the cribriform plate of the ethmoid bone and the subarachnoid space containing cerebrospinal fluid (CSF), and terminate on mitral cells in the olfactory bulbs. Then the neural projections extend to multiple brain regions including the olfactory tract, anterior olfactory nucleus, piriform cortex, amygdala, and hypothalamus (Buck, 2000). Besides, chemosensory neurons in the Grueneberg ganglion project axons to glomeruli in the olfactory bulbs (Fuss et al., 2005).
Olfactory neurons in the olfactory epithelium regenerate every 3–4 weeks because of their direct and frequent contact with foreign toxins. Therefore, the proteolytic enzymes, tight junction proteins, and efflux transporters in the nasal passages may not be fully functional during the maturation of olfactory neurons, resulting in a “leaky” nasal barrier to the CNS (Balin et al., 1986). In addition, olfactory ensheathing cells envelope the axons of olfactory neurons, creating continuous, fluid-filled perineurial channels that remain open despite the degeneration and regeneration of olfactory neurons (Luzzati et al., 2004).
Given the unique characteristics of the olfactory mucosa and olfactory neurons, it is possible for intranasally administered drugs to reach the CNS via extracellular or intracellular mechanisms along olfactory nerves. Extracellular transport mechanisms involve the rapid movement of drugs between cells in the nasal epithelium, and only several minutes are needed for a drug to reach the olfactory bulbs and other CNS parts (Frey, 2002). Transport may involve bulk flow mechanisms within the channels created by the olfactory ensheathing cells (Thorne et al., 2004). Drugs may also be transported within these channels by the structural changes that occur during depolarization and axonal propagation of the action potential in adjacent axons (Luzzati et al., 2004). Intracellular transport mechanisms involve the uptake of drugs into olfactory neurons by passive diffusion, receptor-mediated endocytosis, or adsorptive endocytosis, followed by slower axonal transport, taking several hours to days for a drug to appear in the olfactory bulbs and other brain areas (Broadwell and Balin, 1985). It has been reported that small, lipophilic molecules such as gold particles (Gopinath et al., 1978) and aluminum salts (Perl and Good, 1987) can be transported through intracellular mechanisms. However, intracellular mechanisms may be not the dominating way of drug transport. Most of the published studies about nose-to-brain delivery showed rapid delivery of drugs to the CNS, almost immediately after or within an hour of intranasal administration, consistent with the rapid extracellular mechanisms (Charlton et al., 2008; Hanson et al., 2004). Further, receptor-mediated transport mechanisms cannot be the main way of transport because of the need of various kinds of specific receptors. Although some large molecules, such as galanin-like peptide, exhibit saturable transport pattern into the CNS (Nonaka et al., 2008), most of large molecules such as nerve growth factor and insulin-like growth factor-I (Thorne et al., 2004) are delivered into the brain in a nonsaturable and not receptor-mediated way.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012814001700010X
Neurology
ProfessorCrispian Scully CBE, MD, PhD, MDS, MRCS, FDSRCS, FDSRCPS, FFDRCSI, FDSRCSE, FRCPath, FMedSci, FHEA, FUCL, FBS, DSc, DChD, DMed (HC), Dr (hc), in Scully’s Medical Problems in Dentistry (Seventh Edition), 2014
Olfactory Nerve (Cranial Nerve I)
The olfactory nerve permits the smelling of odours. Unilateral anosmia is often unnoticed but bilateral anosmia causes loss of ability to smell odours; in practice, the patient may complain of loss of taste rather than of smell. Anosmia is common in upper respiratory infections and after head injuries, as the nerves may be torn as they pass through the cribriform plate; this is experienced especially in Le Fort III fractures of the middle third of the facial skeleton. Olfactory neuroblastoma is a rare tumour linked tentatively to dental staff. An olfactory lesion is confirmed by inability to smell substances, such as orange, soap, coffee, cloves or peppermint oil. Each nostril is tested separately. Ammoniacal solutions must not be used, as they stimulate the trigeminal rather than the olfactory nerve.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780702054013000138
Neurologic Aspects of Systemic Disease Part I
Allan Krumholz, Barney J. Stern, in Handbook of Clinical Neurology, 2014
Cranial nerve I
Olfactory nerve dysfunction can occur secondary to meningeal sarcoidosis involving the subfrontal region. However, anosmia or hyposmia may also result from local nasal granulomatous invasion by sarcoidosis, and, therefore, in a patient with olfactory complaints, an otolaryngological evaluation is necessary before attributing impaired olfaction to CNS disease.
Cranial nerve II
Optic nerve involvement in sarcoidosis is much less frequent than other ocular manifestations of sarcoidosis such as uveitis. Optic nerve involvement can present with an acute or subacute, painful, or chronic, painless visual loss (Graham et al., 1986; Stern and Corbett, 2007; Pawate et al., 2009). This visual loss may be due to bulbar or retrobulbar invasion of the optic nerve by granulomas, compression of the optic nerve by a granulomatous mass, or optic atrophy. Optic disc edema may be secondary to papilledema due to sarcoidosis-induced increased intracranial pressure or as a direct local invasive effect of sarcoidosis. A chiasmal syndrome has also been reported (Gelwan et al., 1988).
Cranial nerves III, IV, and VI
Disorders of ocular motility may follow involvement of the III, IV, or VI cranial nerves in the granulomatous process (Stern et al., 1985). Typically, these nerves are damaged in their extra-axial course in the subarachnoid space as they traverse the meninges. However, they may also be involved via local orbital disease, and rarely, brainstem intra-axial central nervous system pathways can be affected by sarcoidosis (Kirkham and Kline, 1976). Uncommonly, disordered ocular motility may be due to sarcoidosis involving the extraocular muscles themselves (Obenauf et al., 1978). Occasionally, pupillary dysfunction is caused by neurosarcoidosis (Henkind and Gottlieb, 1973; Kirkham and Kline, 1976; Cohen and Reinhardt, 1982; Poole, 1984). For instance, Horner’s syndrome due to disruption of the cervical sympathetic nerves has been reported (Cohen and Reinhardt, 1982).
Cranial nerve V
Trigeminal nerve disease may present as facial numbness or, rarely, trigeminal neuralgia (Stern et al., 1985). Headache may also represent trigeminal nerve dysfunction intracranially. Involvement of the muscles of mastication is unusual.
Cranial nerve VII
Of all the cranial nerve syndromes, peripheral facial cranial nerve (VII) palsy is the most common, and it is also the single most frequent neurologic manifestation of sarcoidosis. It develops in 25–50% of all patients with neurosarcoidosis. Although usually unilateral, bilateral facial palsy also can occur presenting with either simultaneous or sequential paralysis. Over half of all patients with facial palsy also have other forms of nervous system involvement. In patients with a solitary facial palsy, spinal fluid examination typically has been reported as normal, but in individuals in whom there are other associated forms of neurosarcoidosis, the spinal fluid examination is reported to be abnormal in 80% of patients. The specific reason for a facial nerve palsy in sarcoidosis may vary. Rarely is the facial palsy caused by parotid inflammation. More likely, the nerve is compromised as it traverses the meninges and subarachnoid space, and as suggested by Oksanen (Oksanen, 1986; Oksanen and Salmi, 1986), facial paresis probably is also due to intra-axial sarcoidosis-induced inflammation involving the facial nerve. In general the prognosis for the facial palsy is good with over 80% of patients having a good outcome in terms of recovery of facial function (Stern et al., 1985; Luke et al., 1987).
Cranial nerve VIII
Eighth cranial nerve involvement is the second most common form of cranial nerve dysfunction in sarcoidosis. Sarcoidosis may involve the auditory or vestibular portions of the nerve. When either loss of hearing or vestibular dysfunction occur, they may be sudden or insidious and often fluctuate over time (Hybels and Rice, 1976; Jahrsdoerfer et al., 1981; Colvin, 2006). If hearing loss occurs, it is typically a sensorineural loss. As with facial nerve palsy, bilateral VIII nerve disease may occur. In fact, either bilateral VII or VIII nerve dysfunction is suggestive of neurosarcoidosis (Wiederholt and Siekert, 1965; Stern et al., 1985; Oksanen and Salmi, 1986).
Cranial nerves IX and X
Glossopharyngeal and vagus nerve involvement by sarcoidosis causes dysphagia and dysphonia. Hoarseness is more commonly due to laryngeal nerve dysfunction from intrathoracic disease than CNS inflammation involving the vagus nerve (El-Kassimi et al., 1990).
Cranial nerves XI and XII
Eleventh and twelfth cranial nerve disease can occur but seems to be quite rare in sarcoidosis.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780702040863000217
Smell and Taste
Harvey B. Sarnat, Laura Flores-Sarnat, in Handbook of Clinical Neurology, 2019
Myelination of the olfactory bulb and tract
Primary olfactory nerve axons remain unmyelinated throughout life, related to continuous turnover and regeneration from progenitor cells in the olfactory epithelium. Myelin forms around axons of mitral and tufted cells of the olfactory bulb, including their projection through the olfactory tract. In the full-term neonate no myelination has as yet been identified by luxol fast blue myelin stain or even by the more sensitive myelin basic protein immunoreactivity (Sarnat and Yu, 2016). Myelination proceeds postnatally during the first few months of age. Secondary postsynaptic projections of the anterior olfactory nucleus and tertiary olfactory fibers in the amygdala, hypothalamus, and neocortex myelinate even later, their cycles extending beyond infancy.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444638557000034