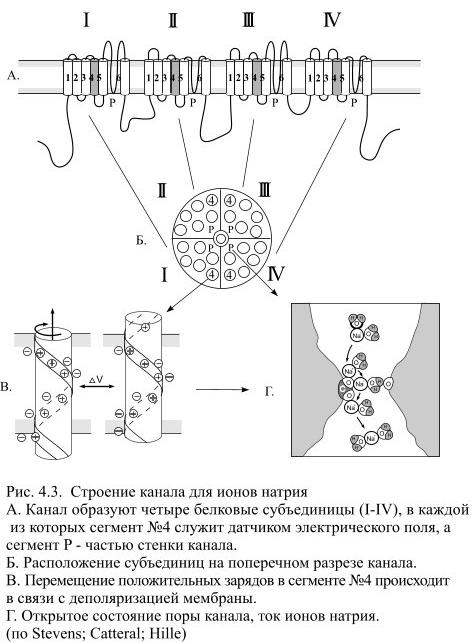
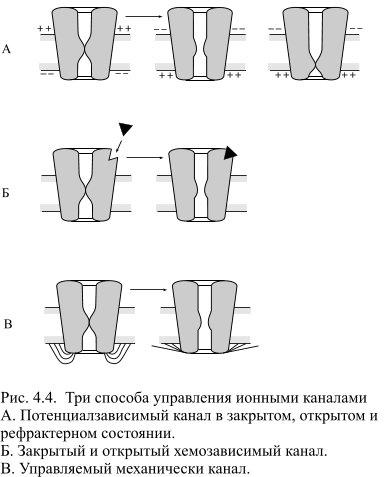
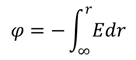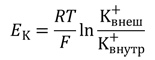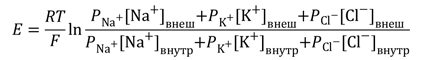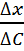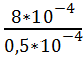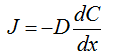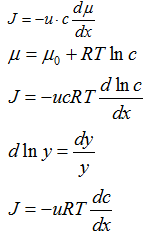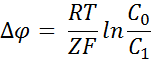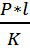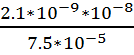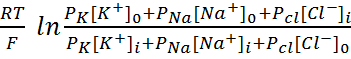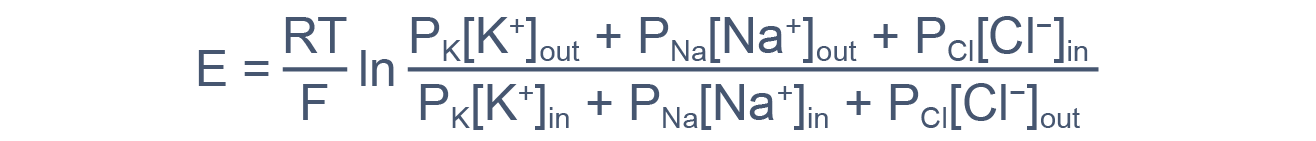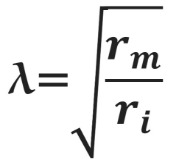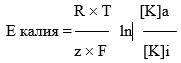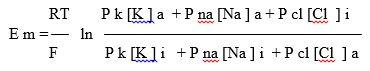натрия из внеклеточной жидкости (где он является основным катионом) в протоплазму мала и лишь незначительно снижает ПП, обусловленный ионами К+.
В скелетных мышечных волокнах в возникновении потенциала покоя важную роль играют также ионы Cl—, диффундирующие внутрь клетки. Следствием ПП является ток покоя, регистрируемый между поврежденным и интактным участками нерва или мышцы при приложении отводящих электродов. Мембраны нервных и мышечных клеток (волокон) способны изменять ионную проницаемость в ответ на сдвиги мембранного потенциала. При увеличении ПП (гиперполяризация мембраны) проницаемость поверхностных клеточных мембран для Na+ и К+ падает, а при уменьшении ПП (деполяризация) она возрастает, причѐм скорость изменений проницаемости для Na+ значительно превышает скорость увеличения проницаемости мембраны для К+. Более точные значения для ПП вычисляются по формуле Гольдмана- Ходжкина-Катца (ГХК), которая учитывает проницаемость КМ в покое не только для ионов калия, но и для ионов натрия и хлора:
|
RT |
PK |
K |
PNa |
Na |
PCl |
Cl |
|||
|
ln |
i |
i |
0 |
, |
|||||
|
ПП |
F |
PK |
K |
PNa |
Na |
PCl |
Cl |
||
|
0 |
0 |
i |
где PK, PNa , PCl – проницаемость КМ для ионов калия, натрия и хлора, выражения […]i и […]0 обозначают концентрации соответствующих молекул внутри и вне клетки.
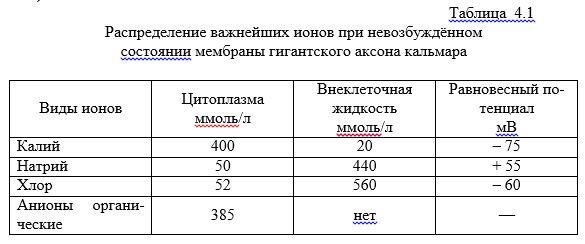
В качестве примера вычислим величину ПП для гигантского аксона кальмара. Концентрации ионов внутри и вне аксона приведены ниже (см. таблицу 3).
|
Ион |
Концентрация (моль на 1 кг воды) |
|
|
Внутри (i) аксона |
Вне (0) аксона кальмара |
|
|
калльмара |
||
|
Na+ |
70 |
420 |
|
K+ |
360 |
10 |
|
Cl— |
160 |
500 |
Таблица 3. Концентрации ионов Na+, K+, Cl— внутри и снаружи аксона кальмара
111

В состоянии покоя при физиологических условиях соотношение коэффициентов проницаемости равно:
Рк : РNa : PCl = 1 : 0,04 : 0,45.
Диффузия ионов калия и хлора идет через КМ в обе стороны. Натрий за счет механизма пассивного транспорта проникает внутрь аксона и за счет активного транспорта выносится из клетки. Следовательно, основной вклад в формирование ПП вносят ионы калия и хлора. Подставив численные значения проницаемостей и концентраций для ионов калия хлора в формулу Гольдмана-Ходжкина-Катца для температуры t=300 C вычислим:
|
8,3 303 |
ln |
1 360 |
0, 04 70 |
0, 45 500 |
46 мВ |
||
|
ПП |
96500 |
1 10 |
0, 04 |
420 |
0, 45 160 |
||
Значение ПП, вычисленное по формуле Нернста, равно:
|
8,3 303 |
ln |
1 360 |
93 мВ |
|
|
н |
96500 |
1 10 |
||
Формула Нернста дает несколько заниженное значение потенциала покоя, а формула ГХК приводит к более реалистичным значениям ПП, измеренным экспериментально на крупных клетках.
Следует также отметить, что ни формула Нернста, ни формула ГХК не учитывают механизма активного транспорта.
Формула Томаса для ПП учитывает работу электрогенных ионных Na-K- насосов и имеет вид:
|
RT |
m PK |
K |
PNa |
Na |
|||
|
ln |
i |
i |
, |
||||
|
T |
F |
m PK |
K |
PNa |
Na |
||
|
0 |
0 |
где m – отношение количества ионов натрия к количеству ионов калия, переносимых натрий-калиевым насосом через КМ. Наиболее распространенный режим работы Na+-K+-АТФ-азы наблюдается при m=3/2. В уравнении Томаса отсутствуют члены
112

PCl[Cl—], так как нет активного транспорта для ионов хлора через КМ.
Численное значение ПП по формуле Томаса равно:
|
8, 3 303 |
ln |
1, 5 1 360 |
0, 04 70 |
75 мВ . |
||
|
ПП |
||||||
|
96500 |
1, 5 1 10 |
0, 04 |
420 |
|||
Коэффициент m, применяемый в уравнении Томаса, усиливает вклад градиента концентрации ионов калия в формирование ПП. Поэтому ПП, рассчитанный по формуле Томаса, по абсолютному значению меньше ПП, рассчитанного по формуле ГХК. Значение ПП, полученное с помощью формулы Томаса, хорошо совпадает со значениями ПП, измеренными экспериментально на мелких клетках.
4. Механизм генерации потенциала действия
Потенциал действия (ПД)
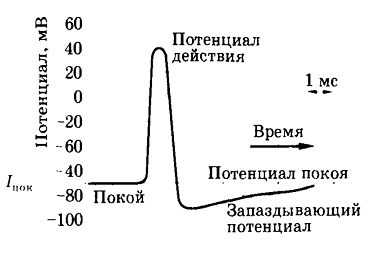
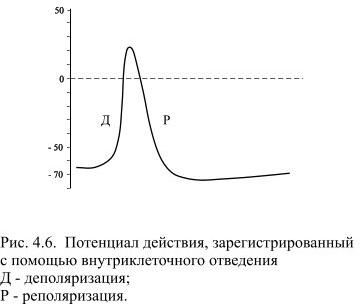
Все раздражители, действующие на клетку, вызывают в первую очередь снижение ПП, когда оно достигает критического значения (порога), возникает активный распространяющийся ответ − ПД. Во время восходящей фазы ПД кратковременно изменяется потенциал на мембране: еѐ внутренняя сторона, заряженная в покое электроотрицательно, приобретает в это время положительный потенциал. Достигнув вершины, ПД начинает падать (нисходящая фаза ПД), и потенциал на мембране возвращается к уровню, близкому к исходному, − ПП (см. рисунок 39)
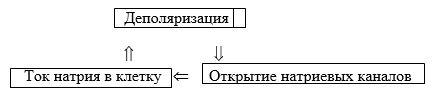
Полное восстановление ПП происходит только после окончания следовых колебаний потенциала − следовой деполяризации или гиперполяризации, длительность которых обычно значительно превосходит продолжительность пика ПД. Согласно мембранной теории, деполяризация мембраны, вызванная действием раздражителя, приводит к усилению потока Na+ внутрь клетки, что уменьшает отрицательный потенциал внутренней стороны мембраны − усиливает еѐ деполяризацию.
113

Рисунок 39. Изменение потенциала КМ при возбуждении
Это, в свою очередь, вызывает дальнейшее повышение проницаемости для Na+ и новое усиление деполяризации и т.д. В результате такого взрывного кругового процесса, т. н. регенеративной деполяризации, происходит изменение мембранного потенциала, характерное для ПД.
Повышение проницаемости для Na+ очень кратковременно и сменяется еѐ падением, а следовательно, уменьшением потока Na+ внутрь клетки. Проницаемость для К+, в отличие от проницаемости для Na+, продолжает увеличиваться, что приводит к усилению потока К+ из клетки. В результате этих изменений ПД начинает падать, что ведѐт к восстановлению ПП. Таков механизм генерации ПД в большинстве
возбудимых тканей. Существуют, однако, клетки (мышечные волокна ракообразных,
нервные клетки у ряда брюхоногих моллюсков, некоторые растительные клетки), у которых восходящая фаза ПД обусловлена повышением проницаемости мембраны не для ионов Na+, а для ионов Ca+. Своеобразен также механизм генерации ПД в мышечных волокнах сердца, для которых характерно длительное плато на нисходящей фазе ПД. Неравенство концентраций ионов К+ и Na+ (или Ca+) внутри и снаружи клетки (волокна) поддерживается специальным механизмом (т. н. «натриевым насосом»), выталкивающим ионы Na+ из клетки и нагнетающим ионы К+ в протоплазму, требующим затраты энергии, которая черпается клеткой в процессах обмена веществ.
Амплитуда ПД большинства нервных и мышечных волокон примерно одинакова: 110-120 мВ. Длительность ПД варьирует в
114

широких пределах: у теплокровных животных длительность ПД нервных волокон, наиболее быстро проводящих возбуждение − 0,3-0,4 мс, у волокон же мышц сердца – 50-600 мс. В растительных клетках пресноводной водоросли хара ПД продолжается около 20 с.
Характерной особенностью ПД, отличающей его от других форм ответа клетки на раздражение, является то, что он подчиняется правилу «всѐ или ничего», т. е. возникает только при достижении раздражителем некоторого порогового значения, и дальнейшее увеличение интенсивности раздражителя уже не сказывается ни на амплитуде, ни на продолжительности ПД.
5.Распространение потенциала действия по миелиновым
ибезмиелиновым нервным волокнам
Впервые скорость распространения потенциала действия (возбуждения) по нервному волокну была измерена профессором физиологии Кенигсбергского университета Германом Гельмгольцем в 1850 году – спустя год после того как ученый И. Физо измерил скорость распространения света. Оказалось, что скорость распространения возбуждения составляет всего порядка 30 м/с. Значения скорости распространения ПД было примерно в 10 000 000 меньше скорости распространения электрического тока по металлическому проводнику и даже в 10 раз медленнее скорости распространения звука в воздухе.
Полученные результаты, с одной стороны, нанесли удар по сторонникам теории мгновенного распространения возбуждения, но одновременно и поставили исследователей перед необходимостью более детально изучить различия механизмов проведения электрического потенциала в проводниках и нервном волокне. Прежде всего, следовало дать ответ на вопросы: почему возбуждение способно распространяться по нервному волокну и от чего зависит скорость распространения нервного импульса.
Для того чтобы ответить на эти вопросы, рассмотрим электрические свойства нервного волокна. Оно представляет собой цилиндр, боковую поверхность которого образует мембрана, отделяющая внутренний раствор электролита от
115

наружного. Это придает волокну свойства коаксиального кабеля, изоляцией которого служит клеточная мембрана. Но нервное волокно − очень плохой кабель. Сопротивление изоляции этого живого кабеля примерно в 105 раз меньше, чем у обычного кабеля, так как в первом случае ее толщина составляет 10 ~6 см, а во втором − около 10 см. Кроме того, внутренняя жила живого кабеля − это раствор электролита, удельное сопротивление которого в миллионы раз больше сопротивления металла. Поэтому невозбужденное нервное волокно плохо приспособлено для передачи электрических сигналов на большие расстояния. Было установлено, что уменьшение электрического потенциала на мембране нервного волокна по мере удаления от источника возбуждения убывает по экспоненциальному закону
|
l |
|||
|
l |
0 e , |
где 0 – значение потенциала в точке возбуждения, l – значение потенциала в точке, расположенной на расстоянии l от источника возбуждения, − константа длины нервного волокна, равная расстоянию, на котором величина потенциала убывает в e
(е=2,718281828…) раз.
Константа 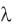
m r
2 i
Чем больше , тем больше скорость распространения нервного возбуждения. Как следует из приведенной выше формулы, тем больше, чем больше радиус нервного волокна и чем больше удельное электрическое сопротивление мембраны нервного волокна.
Для повышения скорости Природа использовала обе возможности. Для простейших организмов она создала нервные волокна большого диаметра – можно вспомнить гигантский аксон кальмара, диаметр которого достигает 0,5 мм.
Для более развитых животных такой путь был совершенно неприемлем – слишком много места в тканях занимали бы
116

гигантские нервные волокна. Природа пошла по другому пути: создала «бронированные» нервные волокна, покрытые
|
миелиновой |
изоляцией. |
|||
|
Миелин представляет собой |
||||
|
жироподобное |
вещество, |
|||
|
которое |
повышает |
|||
|
электроизоляцию нервных |
||||
|
волокон |
(увеличивает |
|||
|
удельное |
электрическое |
|||
|
Рисунок 40. Миелинизированное нервное |
сопротивление |
клеточной |
||
|
волокно |
мембраны). Причем миелин |
|||
|
покрывает нервное волокно |
сегментами, длиной около 1 мм, а между сегментами имеются оголенные участки нервного волокна длиной около 1 мкм. Участки волокна, не покрытые миелином, получили название перехватов Ранвье. В области перехватов Ранвье мембрана имеет непосредственный контакт с внешним раствором (см. рисунок 40). Наличие миелиновой оболочки позволяет увеличить скорость распространения возбуждения примерно в 25 раз по сравнению с немиелинизированным волокном, уменьшает энергозатраты организма, так как уменьшается общее количество ионов, пересекающих мембрану – ионы перемещаются только в области перехватов Ранвье.
Рассмотрим процесс распространения возбуждения по безмиелиновым нервным волокнам.
При возбуждении участка нервного волокна (см. рисунок 41) происходит деполяризация данного участка. При деполяризации с наружной стороны мембран возникает отрицательный электрический потенциал, а с внутренней стороны – положительный потенциал. Между возбужденным и невозбужденным участками нервного волокна возникнут локальные электрические токи, так у возбужденного участка внутренняя поверхность имеет положительный заряд, а у невозбужденного участка – отрицательный электрический заряд и между ними возникает разность потенциалов. По поверхности нервного волокна локальный электрический ток течет от невозбужденного участка к возбужденному, внутри волокна
117

электрический ток течет в обратном направлении – от возбужденного участка к невозбужденному.
Эти локальные токи являются раздражителями для невозбужденных участков, непосредственно примыкающих к
|
возбужденному участку. В них также |
возникает возбуждение |
|||||
|
(потенциал действия). В |
||||||
|
то же время локальные |
||||||
|
токи приводят к тому, |
||||||
|
что |
возбужденные |
|||||
|
участки |
приходят |
в |
||||
|
состояние покоя – в них |
||||||
|
ПД сменяется ПП. |
||||||
|
Возбужденные |
||||||
|
участки, |
в |
свою |
||||
|
Рисунок 41. Распространение потенциала |
||||||
|
очередь, |
предают |
|||||
|
действия по волокну |
||||||
|
сигнал |
дальше, |
и |
||||
процесс распространяется вдоль аксона. (Существует внешняя аналогия между распространением нервного импульса и распространением огня по бикфордову шнуру).
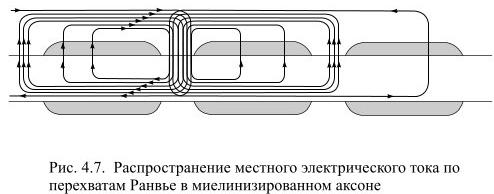
В миелинизированном волокне распространение импульса возбуждение происходит за счет локальных токов, которые вынуждены циркулировать между соседними перехватами Ранвье (см. рисунок 42). Передача возбуждения происходит быстрее, чем в немиелинизированном волокне.
Рисунок 42. Распространение потенциала действия по миелинизированному волокну
Калиевые и натриевые каналы открываются только в перехватах Ранвье, так как миелин является хорошим изолятором, таким образом, импульс «перескакивает» с одного перехвата на другой – такое поведение называется сальтаторным.
118

Миелинизация аксона позволяет достигать высокой скорости передачи импульса при очень малом диаметре волокна. Это дало позвоночным важное эволюционное преимущество, и во многом обусловило их дальнейшее развитие.
119

ВНЕШНИЕ ЭЛЕКТРИЧЕСКИЕ ПОЛЯ ТКАНЕЙ И ОРГАНОВ
1. Электрическое поле и его характеристики
Электрическое поле – это разновидность материи, посредством которой осуществляется силовое воздействие на электрические заряды, находящиеся в этом поле.
Силовой характеристикой электрического поля является напряженность (E), равная отношению силы, действующей в данной точке поля на точечный заряд, к величине этого заряда.
F E
q
Напряженность – вектор, направление которого совпадает с направлением силы, действующей в данной точке поля на положительный точечный заряд. Напряженность электрического поля, созданная точечным зарядом q на расстоянии r от него, равна:
|
E |
q |
|
|
4 0 r 2 |
||
Электрическое поле изображается графически силовыми линиями, касательные к которым совпадают с направлением напряженности поля в соответствующих точках. Силовые линии направлены от положительных зарядов к отрицательным. Линии проводят с такой густотой, чтобы число линий, проходящих через единичную площадку, перпендикулярную им, было пропорционально значению напряженности электрического поля в месте расположения площадки. Электрическое поле называют однородным, если напряженность во всех точках пространства
одинакова по величине и направлению (см. рисунок 43):
E const.
120
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Статья на конкурс «био/мол/текст»: Потенциал покоя — это важное явление в жизни всех клеток организма, и важно знать, как он формируется. Однако это сложный динамический процесс, трудный для восприятия целиком, особенно для студентов младших курсов (биологических, медицинских и психологических специальностей) и неподготовленных читателей. Впрочем, при рассмотрении по пунктам, вполне возможно понять его основные детали и этапы. В работе вводится понятие потенциала покоя и выделяются основные этапы его формирования с использованием образных метафор, помогающих понять и запомнить молекулярные механизмы формирования потенциала покоя.
«Био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Мембранные транспортные структуры — натрий-калиевые насосы — создают предпосылки для возникновения потенциала покоя. Предпосылки эти — разность в концентрации ионов на внутренней и наружной сторонах клеточной мембраны. Отдельно проявляет себя разность концентрации по натрию и разность концентрации по калию. Попытка ионов калия (K+) выровнять свою концентрацию по обе стороны мембраны приводит к его утечке из клетки и потере вместе с ними положительных электрических зарядов, за счёт чего значительно усиливается общий отрицательный заряд внутренней поверхности клетки. Эта «калиевая» отрицательность составляет бóльшую часть потенциала покоя (−60 мВ в среднем), а меньшую его часть (−10 мВ) составляет «обменная» отрицательность, вызванная электрогенностью самого ионного насоса-обменника.
Давайте разбираться подробнее.
Зачем нам нужно знать, что такое потенциал покоя и как он возникает?
Вы знаете, что такое «животное электричество»? Откуда в организме берутся «биотоки»? Как живая клетка, находящаяся в водной среде, может превратиться в «электрическую батарейку» и почему она моментально не разряжается?
Совершенно очевидно, что для понимания того, как работает нервная система, необходимо вначале разобраться, как работает её отдельная нервная клетка — нейрон. Главное, что лежит в основе работы нейрона — это перемещение электрических зарядов через его мембрану и появление вследствие этого на мембране электрических потенциалов. Можно сказать, что нейрон, готовясь к своей нервной работе, вначале запасает энергию в электрической форме, а затем использует ее в процессе проведения и передачи нервного возбуждения.
Таким образом, наш самый первый шаг к изучению работы нервной системы — это понять, каким образом появляется электрический потенциал на мембране нервных клеток. Этим мы и займёмся, и назовём этот процесс формированием потенциала покоя.
Определение понятия «потенциал покоя»
В норме, когда нервная клетка находится в физиологическом покое и готова к работе, у неё уже произошло перераспределение электрических зарядов между внутренней и наружной сторонами мембраны. За счёт этого возникло электрическое поле, и на мембране появился электрический потенциал — мембранный потенциал покоя.
Как известно из физики, электрические заряды (движущиеся и неподвижные) формируют в пространстве электромагнитное поле, которое влияет на тела, обладающие электрическим зарядом. С точки зрения электромагнетизма клеточную мембрану можно представить как плоский конденсатор, заполненный однородным диэлектриком из неполярных молекул. Если конденсатор заряжен, то внутри него возникает электрическое поле, обусловленное поверхностной плотностью заряда. На поверхности мембраны возникают некомпенсированные заряды: положительные у «отрицательной» поверхности и отрицательные — у «положительной» [6].
Таким образом, мембрана оказывается поляризованной. Это означает, что она имеет разный электрический потенциал наружной и внутренней поверхностей. Разность между этими потенциалами вполне возможно зарегистрировать.
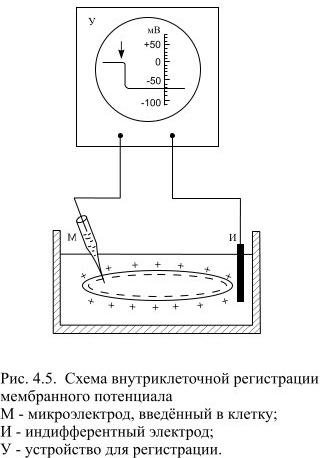
В этом можно убедиться, если ввести внутрь клетки микроэлектрод, соединённый с регистрирующей установкой. Как только электрод попадает внутрь клетки, он мгновенно приобретает некоторый постоянный электроотрицательный потенциал по отношению к электроду, расположенному в окружающей клетку жидкости. Величина внутриклеточного электрического потенциала у нервных клеток и волокон, например, гигантских нервных волокон кальмара, в покое составляет около −70 мВ. Эту величину называют мембранным потенциалом покоя (МПП). Во всех точках аксоплазмы этот потенциал практически одинаков.
Ещё немного физики. Макроскопические физические тела, как правило, электрически нейтральны, т.е. в них в равных количествах содержатся как положительные, так и отрицательные заряды. Зарядить тело можно, создав в нем избыток заряженных частиц одного вида, например, трением о другое тело, в котором при этом образуется избыток зарядов противоположного вида. Учитывая наличие элементарного заряда (e), полный электрический заряд любого тела можно представить как q = ±N×e, где N — целое число.
Потенциал электростатического поля φ определяется как отношение потенциальной энергии W пробного заряда q к величине этого заряда: φ = W/q, откуда следует, что потенциал численно равен потенциальной энергии, которой обладает в данной точке поля единичный положительный заряд. Единицей измерения потенциала служит вольт (1 В) [4]. В некоторых случаях потенциал электрического поля нагляднее определяется как физическая величина, численно равная работе внешних сил против сил электрического поля E при перемещении единичного положительного точечного заряда из бесконечности в данную точку. Последнее определение удобно записать следующим образом:
В электрофизиологии кроме потенциала покоя рассматриваются и другие электрические потенциалы: локальные постсинаптические и рецепторные потенциалы (возбуждающие и тормозные), электротонические и следовые потенциалы, миниатюрные потенциалы концевой пластинки, концентрационный потенциал и потенциал действия [5].
Потенциал покоя — это разность электрических потенциалов, имеющихся на внутренней и наружной сторонах мембраны, когда клетка находится в состоянии физиологического покоя. Его величина измеряется изнутри клетки, она отрицательна и составляет в среднем −70 мВ (милливольт), хотя в разных клетках может быть различной: от −35 мВ до −90 мВ.
Важно учитывать, что в нервной системе электрические заряды представлены не электронами, как в обычных металлических проводах, а ионами — химическими частицами, имеющими электрический заряд. И вообще в водных растворах в виде электрического тока перемещаются не электроны, а ионы. Поэтому все электрические токи в клетках и окружающей их среде — это ионные токи.
Итак, изнутри клетка в покое заряжена отрицательно, а снаружи — положительно. Это свойственно всем живым клеткам, за исключением, разве что, эритроцитов, которые, наоборот, заряжены отрицательно снаружи. Если говорить конкретнее, то получается, что снаружи вокруг клетки будут преобладать положительные ионы (катионы Na+ и K+), а внутри — отрицательные ионы (анионы органических кислот, не способные свободно перемещаться через мембрану, как Na+ и K+).
Теперь нам всего лишь осталось объяснить, каким же образом всё получилось именно так. Хотя, конечно, неприятно сознавать, что все наши клетки кроме эритроцитов только снаружи выглядят положительными, а внутри они — отрицательные.
Термин «отрицательность», который мы будем применять для характеристики электрического потенциала внутри клетки, пригодится нам для простоты объяснения изменений уровня потенциала покоя. В этом термине ценно то, что интуитивно понятно следующее: чем больше отрицательность внутри клетки — тем ниже в отрицательную сторону от нуля смещён потенциал, а чем меньше отрицательность — тем ближе отрицательный потенциал к нулю. Это намного проще понять, чем каждый раз разбираться в том, что же именно означает выражение «потенциал возрастает» — возрастание по абсолютному значению (или «по модулю») будет означать смещение потенциала покоя вниз от нуля, а просто «возрастание» — смещение потенциала вверх к нулю. Термин «отрицательность» не создаёт подобных проблем неоднозначности понимания.
Сущность формирования потенциала покоя
Попробуем разобраться, откуда берётся электрический заряд нервных клеток, хотя их никто не трёт, как это делают физики в своих опытах с электрическими зарядами.
Здесь исследователя и студента поджидает одна из логических ловушек: внутренняя отрицательность клетки возникает не из-за появления лишних отрицательных частиц (анионов), а, наоборот, из-за потери некоторого количества положительных частиц (катионов)!
Так куда же деваются из клетки положительно заряженные частицы? Напомню, что это покинувшие клетку и скопившиеся снаружи ионы натрия — Na+ — и калия — K+.
Главный секрет появления отрицательности внутри клетки
Сразу откроем этот секрет и скажем, что клетка лишается части своих положительных частиц и заряжается отрицательно за счёт двух процессов:
- вначале она обменивает «свой» натрий на «чужой» калий (да-да, одни положительные ионы на другие, такие же положительные);
- потом из неё происходит утечка этих «наменянных» положительных ионов калия, вместе с которыми из клетки утекают положительные заряды.
Эти два процесса нам и надо объяснить.
Первый этап создания внутренней отрицательности: обмен Na+ на K+
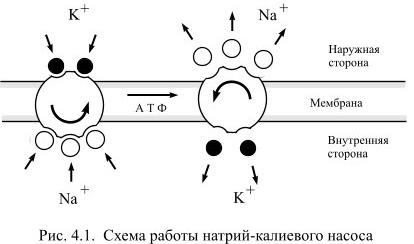
В мембране нервной клетки постоянно работают белковые насосы-обменники (аденозинтрифосфатазы, или Na+/K+-АТФазы), встроенные в мембрану. Они меняют «собственный» натрий клетки на наружный «чужой» калий.
Но ведь при обмене одного положительного заряда (Na+) на другой такой же положительный заряд (K+) никакого дефицита положительных зарядов в клетке возникать не может! Правильно. Но, тем не менее, из-за этого обмена в клетке остаётся очень мало ионов натрия, потому что они почти все ушли наружу. И в то же время клетка переполняется ионами калия, которые в неё накачали молекулярные насосы. Если бы мы могли попробовать на вкус цитоплазму клетки, мы бы заметили, что в результате работы насосов-обменников она превратилась из солёной в горько-солёно-кислую, потому что солёный вкус хлорида натрия сменился сложным вкусом довольно-таки концентрированного раствора хлорида калия. В клетке концентрация калия достигает 0,4 моль/л. Растворы хлорида калия в пределах 0,009–0,02 моль/л имеют сладкий вкус, 0,03–0,04 — горький, 0,05–0,1 — горько-солёный, а начиная с 0,2 и выше — сложный вкус, состоящий из солёного, горького и кислого [8].
Важно здесь то, что обмен натрия на калий — неравный. За каждые отданные клеткой три иона натрия она получает всего два иона калия. Это приводит к потере одного положительного заряда при каждом акте ионного обмена. Так что уже на этом этапе за счёт неравноценного обмена клетка теряет больше «плюсов», чем получает взамен. В электрическом выражении это составляет примерно −10 мВ отрицательности внутри клетки. (Но помните, что нам надо ещё найти объяснение для оставшихся −60 мВ!)
Чтобы легче было запомнить работу насосов-обменников, образно можно выразиться так: «Клетка любит калий!» Поэтому клетка и затаскивает калий к себе, несмотря на то, что его и так в ней полно. И поэтому она невыгодно обменивает его на натрий, отдавая 3 иона натрия за 2 иона калия. И поэтому она тратит на этот обмен энергию АТФ. И как тратит! До 70% всех энергозатрат нейрона может уходить на работу натрий-калиевых насосов. (Вот что делает любовь, пусть она даже и не настоящая!)
Кстати, интересно, что клетка не рождается с готовым потенциалом покоя. Ей его ещё надо создать. Например, при дифференцировке и слиянии миобластов потенциал их мембраны изменяется от −10 до −70 мВ, т.е. их мембрана становится более отрицательной — поляризуется в процессе дифференцировки. А в экспериментах на мультипотентных мезенхимальных стромальных клетках костного мозга человека искусственная деполяризация, противодействующая потенциалу покоя и уменьшающая отрицательность клеток, даже ингибировала (угнетала) дифференцировку клеток [1].
Образно говоря, можно выразиться так: Создавая потенциал покоя, клетка «заряжается любовью». Это любовь к двум вещам:
- любовь клетки к калию (поэтому клетка насильно затаскивает его к себе);
- любовь калия к свободе (поэтому калий покидает захватившую его клетку).
Механизм насыщения клетки калием мы уже объяснили (это работа насосов-обменников), а механизм ухода калия из клетки объясним ниже, когда перейдём к описанию второго этапа создания внутриклеточной отрицательности. Итак, результат деятельности мембранных ионных насосов-обменников на первом этапе формирования потенциала покоя таков:
- Дефицит натрия (Na+) в клетке.
- Избыток калия (K+) в клетке.
- Появление на мембране слабого электрического потенциала (−10 мВ).
Можно сказать так: на первом этапе ионные насосы мембраны создают разность концентраций ионов, или градиент (перепад) концентрации, между внутриклеточной и внеклеточной средой.
Второй этап создания отрицательности: утечка ионов K+ из клетки
Итак, что начинается в клетке после того, как с ионами поработают её мембранные натрий-калиевые насосы-обменники?
Из-за образовавшегося дефицита натрия внутри клетки этот ион при каждом удобном случае норовит устремиться внутрь: растворённые вещества всегда стремятся выровнять свою концентрацию во всём объёме раствора. Но это у натрия получается плохо, поскольку ионные натриевые каналы обычно закрыты и открываются только при определённых условиях: под воздействием специальных веществ (трансмиттеров) или при уменьшении отрицательности в клетке (деполяризации мембраны).
В то же время в клетке имеется избыток ионов калия по сравнению с наружной средой — потому что насосы мембраны насильно накачали его в клетку. И он, тоже стремясь уравнять свою концентрацию внутри и снаружи, норовит, напротив, выйти из клетки. И это у него получается!
Тут ещё важно понять то, что ионы натрия и калия как бы «не замечают» друг друга, они реагируют только «на самих себя». Т.е. натрий реагирует на концентрацию натрия же, но «не обращает внимания» на то, сколько вокруг калия. И наоборот, калий реагирует только на концентрацию калия и «не замечает» натрий. Получается, что для понимания поведения ионов надо по отдельности рассматривать концентрации ионов натрия и калия. Т.е. надо отдельно сравнить концентрацию по натрию внутри и снаружи клетки и отдельно — концентрацию по калию внутри и снаружи клетки, но не имеет смысла сравнивать натрий с калием, как это, бывает, делается в учебниках.
По закону выравнивания химических концентраций, который действует в растворах, натрий «хочет» снаружи войти в клетку; туда же его влечёт и электрическая сила (как мы помним, цитоплазма заряжена отрицательно). Хотеть-то он хочет, но не может, так как мембрана в обычном состоянии плохо его пропускает. Натриевые ионные каналы, имеющиеся в мембране, в норме закрыты. Если все же его заходит немножко, то клетка сразу же обменивает его на наружный калий с помощью своих натрий-калиевых насосов-обменников. Получается, что ионы натрия проходят через клетку как бы транзитом и не задерживаются в ней. Поэтому натрий в нейронах всегда в дефиците.
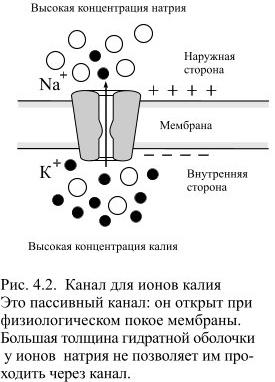
А вот калий как раз может легко выходить из клетки наружу! В клетке его полно, и она его удержать не может. Он выходит наружу через особые каналы в мембране — «калиевые каналы утечки», которые в норме открыты и выпускают калий [5, 7].
К+-каналы утечки постоянно открыты при нормальных значениях мембранного потенциала покоя и проявляют взрывы активности при сдвигах мембранного потенциала, которые длятся несколько минут и наблюдаются при всех значениях потенциала. Усиление К+-токов утечки ведёт к гиперполяризации мембраны, тогда как их подавление — к деполяризации. …Однако, существование канального механизма, ответственного за токи утечки, долгое время оставалось под вопросом. Только сейчас стало ясно, что калиевая утечка — это ток через специальные калиевые каналы.
От химического — к электрическому
А теперь — ещё раз самое главное. Мы должны осознанно перейти от движения химических частиц к движению электрических зарядов.
Калий (K+) положительно заряжен, и поэтому он, когда выходит из клетки, выносит из неё не только самого себя, но и положительный заряд. За ним изнутри клетки к мембране тянутся «минусы» — отрицательные заряды. Но они не могут просочиться через мембрану — в отличие от ионов калия — т.к. для них нет подходящих ионных каналов, и мембрана их не пропускает. Помните про оставшиеся необъяснёнными нами −60 мВ отрицательности? Это и есть та самая часть мембранного потенциала покоя, которую создаёт утечка ионов калия из клетки! И это — большая часть потенциала покоя.
Для этой составной части потенциала покоя есть даже специальное название — концентрационный потенциал [5]. Концентрационный потенциал — это часть потенциала покоя, созданная дефицитом положительных зарядов внутри клетки, образовавшимся за счёт утечки из неё положительных ионов калия.
Ну, а теперь немного физики, химии и математики для любителей точности.
Электрические силы связаны с химическими по уравнению Гольдмана. Его частным случаем является более простое уравнение Нернста, по формуле которого можно рассчитать трансмембранную диффузионную разность потенциалов на основе различной концентрации ионов одного вида по разные стороны мембраны. Так, зная концентрацию ионов калия снаружи и внутри клетки, можно рассчитать калиевый равновесный потенциал EK:
где Ек — равновесный потенциал, R — газовая постоянная, Т — абсолютная температура, F — постоянная Фарадея, К+внеш и K+внутр — концентрации ионов К+ снаружи и внутри клетки, соответственно. По формуле видно, что для расчёта потенциала между собой сравниваются концентрации ионов одного вида — K+.
Более точно итоговая величина суммарного диффузионного потенциала, который создаётся утечкой нескольких видов ионов, рассчитывается по формуле Гольдмана-Ходжкина-Катца. В ней учтено, что потенциал покоя зависит от трех факторов: (1) полярности электрического заряда каждого иона; (2) проницаемости мембраны Р для каждого иона; (3) [концентраций соответствующих ионов] внутри (внутр) и снаружи мембраны (внеш). Для мембраны аксона кальмара в покое отношение проводимостей РK : PNa :PCl = 1 : 0,04 : 0,45 [5].
Заключение
Итак, поте нциал покоя состоит из двух частей:
- −10 мВ, которые получаются от «несимметричной» работы мембранного насоса-обменника (ведь он больше выкачивает из клетки положительных зарядов (Na+), чем закачивает обратно с калием).
- Вторая часть — это всё время утекающий из клетки калий, уносящий положительные заряды. Его вклад — основной: −60 мВ. В сумме это и дает искомые −70 мВ.
Что интересно, калий перестанет выходить из клетки (точнее, его вход и выход уравниваются) только при уровне отрицательности клетки −90 мВ. В этом случае сравняются химические и электрические силы, проталкивающие калий через мембрану, но направляющие его в противоположные стороны. Но этому мешает постоянно подтекающий в клетку натрий, который несёт с собой положительные заряды и уменьшает отрицательность, за которую «борется» калий. И в итоге в клетке поддерживается равновесное состояние на уровне −70 мВ.
Вот теперь мембранный потенциал покоя окончательно сформирован.
Схема работы Na+/K+-АТФазы наглядно иллюстрирует «несимметричный» обмен Na+ на K+: выкачивание избыточного «плюса» в каждом цикле работы фермента приводит к отрицательному заряжению внутренней поверхности мембраны. Чего в этом ролике не сказано, так это того, что АТФаза ответственна за менее чем 20% потенциала покоя (−10 мВ): оставшаяся «отрицательность» (−60 мВ) появляется за счет выхода из клетки через «калиевые каналы утечки» ионов K+, стремящихся выровнять свою концентрацию внутри клетки и вне нее.
- Jacqueline Fischer-Lougheed, Jian-Hui Liu, Estelle Espinos, David Mordasini, Charles R. Bader, et. al.. (2001). Human Myoblast Fusion Requires Expression of Functional Inward Rectifier Kir2.1 Channels. J Cell Biol. 153, 677-686;
- Liu J.H., Bijlenga P., Fischer-Lougheed J. et al. (1998). Role of an inward rectifier K+ current and of hyperpolarization in human myoblast fusion. J. Physiol. 510, 467–476;
- Sarah Sundelacruz, Michael Levin, David L. Kaplan. (2008). Membrane Potential Controls Adipogenic and Osteogenic Differentiation of Mesenchymal Stem Cells. PLoS ONE. 3, e3737;
- Павловская М.В. и Мамыкин А.И. Электростатика. Диэлектрики и проводники в электрическом поле. Постоянный ток / Электронное пособие по общему курсу физики. СПб: Санкт-Петербургский государственный электротехнический университет;
- Ноздрачёв А.Д., Баженов Ю.И., Баранникова И.А., Батуев А.С. и др. Начала физиологии: Учебник для вузов / Под ред. акад. А.Д. Ноздрачёва. СПб: Лань, 2001. — 1088 с.;
- Макаров А.М. и Лунева Л.А. Основы электромагнетизма / Физика в техническом университете. Т. 3;
- Зефиров А.Л. и Ситдикова Г.Ф. Ионные каналы возбудимой клетки (структура, функция, патология). Казань: Арт-кафе, 2010. — 271 с.;
- Родина Т.Г. Сенсорный анализ продовольственных товаров. Учебник для студентов вузов. М.: Академия, 2004. — 208 с.;
- Кольман Я. и Рем К.-Г. Наглядная биохимия. М.: Мир, 2004. — 469 с.;
- Шульговский В.В. Основы нейрофизиологии: Учебное пособие для студентов вузов. М.: Аспект Пресс, 2000. — 277 с..
Гигантский аксон кальмара достигает примерно 0,5 — 1 мм в диаметре и нескольких сантиметров в длину (рис. 19-10). Электрод в виде стеклянного капилляра, заполненного проводящим раствором, может быть введен глубоко в цитоплазму по направлению оси клетки. С помощью такого электрода можно измерить разность потенциалов межд цитоплазмой и наружной поверхностью клетки — мембранный потенциал — во время прохождения импульса. Импульс можно вызвать коротким электрическим раздражением одного из концов аксона. В каком конце аксона это происходит, не важно, поскольку возбуждение может распространяться в любом направлении сила стимуляции, если она превысит определенный порог, тоже не имеет значения потенциал действия подчиняется закону все или ничего . [c.299]
Как внутри, так и снаружи аксона наиболее многочисленны ионы Ма , и СГ. Как и в других клетках, Ма К — насос поддерживает концентрационный градиент концентрация ионов натрия внутри клетки примерно в 9 раз меньше, чем снаружи, тогда как внутри — клеточная концентрация К почти в 20 раз выше по сравнению с внеклеточной средой. Какие ионы важны для потенциала действия Размеры гигантского аксона кальмара настолько велики, что можно выдавить из него цитоплазму, словно зубную пасту из тюбика, а затем [c.299]
Гигантский аксон кальмара занимает особое место в истории наших представлений о мембранном потенциале и потенциале действия. Благодаря его большим размерам (0,2-1,0 мм в диаметре и 5-10 см в длину) в него можно вводить электроды, и в прошлом такие электроды, хотя и очень крупные по сравнению с современными, позволили впервые измерить разность электрических потенциалов между цитоплазмой и внеклеточной жидкостью. При введении электрода в интактный гигантский аксон регистрируется мембранный потенциал, равный —70 мВ. Если аксон, помещенный в сосуд с морской водой, стимулировать, то при проведении нервного импульса мембранный потенциал временно возрастает от -70 мВ до +40 мВ. [c.61]
Как показали три простых наблюдения, для синаптической передачи необходим приток ионов кальция в окончание аксона. Во-первых, если в момент прибытия нервного импульса во внеклеточной среде вокруг окончания аксона эти ионы отсутствуют, то медиатор не высвобождается и передачи сигнала не происходит. Во-вторых, если через микропипетку искусственно ввести Са в цитоплазму нервного окончания, выход нейромедиатора происходит тотчас даже без электрической стимуляции аксона (это трудно осуществить на нервно-мышечном соединении из-за малых размеров окончания аксона, поэтому такой эксперимент был проведен на синапсе между гигантскими нейронами кальмара) В-третьих, искусственная деполяризация окончания аксона (тоже в синапсе между гигантскими нейронами) без нервного импульса и в условиях блокады натриевых и калиевых каналов специфическими токсинами [c.306]
В настоящее время более общепринятой является не ионообменная гипотеза, а гипотеза существования в клетках ионного насоса, выкачивающего из клеток ионы На+ и накачивающего в них ионы К+. Для. изучения этого процесса были использованы различные методические подходы. Из гигантского аксона кальмара можно, например, удалять всю цитоплазму, а оста ВШуюся клеточную оболочку заполнять различными ионными растворами. Сходным образом можно заполнить и тени эритроцитов. Наличие переноса ионов внутрь клеток и из клеток в окружающую среду наблюдалось как на указанных выше объектах, так и на различных интактных клетках других типов. Оказалось, чтО перенос ионов блокируется ингибиторами, например цианидом, который, как известно, нарушает почти все процессы окислительного метаболизма в клетках. Однако блокирование цианидом сним-ается при добавлении к клеткам АТР или других фосфатных соединений, характеризующихся высоким значением потенциала переноса групп. [c.361]
Гигантский аксон кальмара можно извлечь из тела животного, а его цитоплазму выдавить, как зубную пасту из тюбика. Если капельку вьщавленной аксоплазмы расплющить покровным стеклом и заснять через микроскоп на видеопленку (разд. 4.1.6), то можно увидеть, как органеллы движутся вдоль тонких нитевидных дорожек . Методом иммунофлуоресценции в сочетании с электронной микроскопией удается показать, что эти дорожки представляют собой отдельные микротрубочки. [c.311]
Цитоплазма, окружающая органеллы нервных клеток, состоит главным образом из воды, белков и неорганических солей (рис. 6.1). К белкам относятся как структурные макромолекулы и высокомолекулярные ферменты, так и более низкомолекулярные вещества типа полипептидов, пептидов и различных аминокислот. Концевые группы многих подобных молекул диссоциируют в водной среде цитоплазмы, и благодаря этому молекулы приобретают электрический заряд, т. е. превращаются в ионы. Содержание этих органических ионов в гигантском аксоне кальмара можно определить путем простого выдавливания цитоплазмы с ее последующим анализом. Подобный анализ показал, что главным органическим ионом нервных клеток является изетионат. Поскольку суммарный заряд этого иона отрицателен, он представляет собой органический анион (А ). Полагают, что в других типах нервных клеток содержатся глутамат, аспартат и органические фосфаты. Все подобные молекулы несут отрицательный суммарный заряд, т. е. являются анионами. [c.129]
Na/ a-обмен может обеспечивать как вход Са + в клетку, так и его выброс в межклеточное пространство в зависимости от потенциала на мембране и соотношения градиентов Na и Са +. Так, в цитоплазме возбужденной клетки концентрация свободного кальция в среднем увеличивается от 0,1 до 1 мкмоль/л и трансмембранный Ес , согласно уравнению Нернста (см. гл. 3), уменьшается примерно на 30 мВ, что создает условия для активации выброса Са + из клетки. Из этих данных, однако, не следует, что два разнонаправленных обменных потока представляют собой полностью симметричные процессы. Оказалось, что в ряде органов и тканей, включая сердце, обмен катионов существенно активируется в присутствии АТФ с цитоплазматической стороны мембраны. С помощью аналога АТФ—[у-5]АТФ, в котором кислород терминального фосфата заменен на серу и который по этой причине является субстратом протеинкиназ, но не АТФаз, показано четырехкратное ускорение процесса Na/Са-обмена в гигантских аксонах кальмара (R. DiPolo, L. Beauge, 1987). Таким образом, данный процесс может быть подвержен чрезвычайно тонкой регуляции, опосредованной протеинкиназными реакциями фосфорилирования и дефосфорилирования самого переносчика или соседнего минорного белка. [c.44]
Чтобы экспериментально определить число ионов натрия, входящих в клетку во время потенциала действия, гигантский аксон кальмара (диаметром 1 мм, длиной 5 см) был помещен в резервуар с раствором, содержащим радиоактивный Na» [удельная активность 2 х 10имп/(мин-моль)], и по всей длине аксона был передан единичный потенциал действия. Когда цитоплазму проанализировали на радиоактивность, оказалось, что внутрь аксона вошло 340 имп/мин. [c.62]
Два простых наблюдения показывают, что для синаптической передачи необходим приток нонов Са в окончание аксона. Во-первых, если во внеклеточной среде Са отсутствует, медиатор не высвобождается и передачи сигнала не происходит. Во-вторлх, если искусственно ввести Са в цитоплазму нервного окончания при помощи микропипетки, выход нейромедиатора происходит даже без электрической стимуляции аксона, рто трудно осуществить на нервно-мышечном соединении из-за малых размеров окончани аксона поэтому такой эксперимент был проведен на синапсе между гигантскими нейронами кальмара.) Эти наблюдения позволили воссоздать последо вательность событий, происходящих в окончании аксона, которая описана ниже. [c.96]
Основы биофизики
Задача 1
Чему равна плотность потока формамида через
плазматическую мембрану Chara
ceratophylla толщиной 8 нм,
если коэффициент диффузии его составляет 1,4*10-8 см2 * с-1, концентрация
формамида в начальный момент времени снаружи была равна 2 * 10-4 М (моль/литр),
внутри в 10 раз меньше
Дано:
x = 8 нм = 8 * 10-9
м = 8 * 10-7 см
D = 1,4*10-8 см2 *
с-1
С0 = 2 * 10-4 М
Сi
= 2 * 10-5 М
Найти: J
Решение:
Воспользуемся уравнением Фика
J = — D
Jdx = — DdC
Продифференцируем левую и правую
части:
J= -D
В итоге получаем:
J = 1.4* 10-8
* 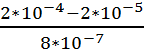
М*см/с
Задача 2
Бислойная липидная мембрана (БЛМ)
толщиной 10 нм разделяет камеру на две части. Плотность потока метиленового
синего через БЛМ постоянна и равна 3 * 10-4 М * см/с, причем концентрация его с
одной стороны мембраны составляет 10-2 М, а с другой 2 * 10-3 М. чему равен
коэффициент диффузии этого вещества через БЛМ?
Дано:
x = 10 нм =
10 * 10-9 м = 10-6 см
J = 3 *10-4 М
* см/с
С0 = 10-2 М
Сi = 3 * 10-3
М
Найти: D
Решение:
Воспользуемся уравнением Фика
J = — D
Очевидно, что в нашем случае можно
записать
J = — D
Тогда,
D = -J
D = — 3 *
10-4 * 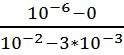
10-8 см2 * с-1
Задача 3
Найти коэффициент проницаемости
плазматической мембраны Mycoplasma для
формамида, если при разнице концентраций этого вещества внутри и снаружи
мембраны, равной 5 * 10-4 М, плотность потока через мембрану — 8 * 10-4М *см/с.
Дано:
J = 8 * 10-4
М * см/с
Найти: Р
Решение:
Воспользуемся формулой:
Р = К* (1)
где К — коэффициент распределения
вещества
х — толщина мембраны
Толщину мембраны можно найти из
уравнения Фике:
J = — D
x = — D
подставим его в первое уравнение:
Р = К* = К*
В итоге получаем, принимая К = 1: Р
= К* = 16 см/с
Задача 4
Потенциал покоя нервного волокна
кальмара равен — 60 мВ а потенциал действия +35мВ.
Вследствие чего происходит такое
изменение мембранного потенциала?
Ответ:
Все живые клетки при действии
различных раздражителей переходят в возбужденное сост. При возбуждении разность
потенциалов между клеткой и окружающей средой изменяется. Появляется
электрический импульс.
Потенциал действия — разность
потенциалов между цитоплазмой и окружающей средой при возбуждении.
Распространение импульса определяется изменением состояния мембраны. В
состоянии покоя в результате активного транспорта, значение концентрации ионов
калия K+ выше в
мембране, чем в окружающей среде. Для ионов натрия все Na+ наоборот.
При этом на внутренней поверхности мембраны будет отрицательный «-» заряд, в
рассматриваемом варианте он равен — 60 мВ. При возбуждении будет происходить
следующее:
. Вначале увеличивается
проницаемость мембраны для ионов натрия Na+.
Натривевые каналы открываются лишь при возбуждении. Ионы Na+ входят в
мембрану, в результате чего внутренняя поверхностьть мембраны меняет свой заряд
с «-« на «+», т.е. происходит деполяризация мембран. Натриевый канал открыт
малое время и в течении этого времени происходит изменение мембранного
потенциала до +35мВ.
. Во время генерации импульса
натриевый канал закрывается и открывается калиевый канал. Ионы K+ выходят
наружу, что приводит к восстановлению — заряда на внутренней стороне мембраны.
Во время импульса проницаемость мембраны увеличивается более чем в 5000 раз.
. Наступает реполяризация. Это
приводит к возникновению потенциалов действия на соседних невозбужденных
участках. Вновь возбужденный участок в свою очередь вновь становится
электроотрицательным, а возникающий локальный ток возбуждает следующий участок
и т. д.
Все эти процессы можно представить
на графике
Задача 5
Показать, что уравнение Фика для
диффузии является частным случаем уравнения Теорелла
Ответ:
Скорость диффузии подчиняется
важному феноменологическому закону, который называется I законом Фика:
Поток равен числу частиц,
диффундирующих вдоль оси Х в единицу времени через единичную площадку,
перпендикулярную это оси.
Поток прямо пропорционален
коэффициенту диффузии и градиенту концентрации dС/dх в данной точке оси х в
данный момент времени.
Чисто феноменологически первый закон
Фика можно рассматривать как некий частный случай общей формулы теоремы для
потока:
движущая сила,×
Концентрация ×Поток =
Подвижность
где поток есть количество вещества в
молях, которое проходит в единицу времени через единичную площадку,
перпендикулярно направлению движения.
Обозначив uRT = D , получим I закон
диффузии Фика
Задача 6
Определить равновесный мембранный
потенциал, создаваемый на бислойной липидной мембране ионами калия (К+) при
температуре 200С, если концентрация калия с одной стороны мембраны равна 10-3
М, а с другой — 10-5М
Дано:
С0 = 10-3 М
С1 = 10-5 М
Т = 200С = 293 К
Найти:
Решение:
По уравнению Нернста:
где R —
универсальная газовая постоянная (8,31 Дж/моль*К)
F —
постоянная Фарадея (9,652*107 Кл*кг/моль)
Z — заряд иона
(для К+ = 1)
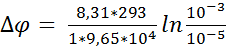
Задача 7
Рассчитать потенциал покоя
гигантского аксона кальмара, если известно, что концентрация ионов натрия
снаружи равна 440 мМ, а внутри — 49 мМ. Температура равна 200С.
Дано:
С0 = 440 мМ
С1 = 49 мМ
Т = 200С = 293 К
Найти:
Решение:
По уравнению Нернста:
где R —
универсальная газовая постоянная (8,31 Дж/моль*К)
F —
постоянная Фарадея (9,652*107 Кл*кг/моль)
Z — заряд
иона (для Na+ = 1)
= 0,025226 * 2.195 = 55.371 мВ
Задача 8
Потенциал покоя нерва конического
краба равен 89 мВ.
Чему равна концентрация ионов калия
внутри нерва, если снаружи она составляет 12 мМ?
Принять температуру равной 200С.
Дано:
= 89 мВ = 89 * 10-3 B
С1 = 12 мМ = 12 * 10-3 M
Т = 200С = 293 К
Найти: С0
Решение:
По уравнению Нернста:
где R —
универсальная газовая постоянная (8,31 Дж/моль*К)
F —
постоянная Фарадея (9,652*107 Кл*кг/моль)
Z — заряд
иона (для К+ = 1)
=
— lnC1 =
=
+ lnC1= exp{
+ lnC1}= exp{
= exp{3.527 + (-4.423)} =
exp{-0.896}= 0.408 M410 мМ
Задача 9
Найти плотность потока (в начальный
момент времени), коэффициент диффузии глицерина через мембраны одноклеточных
водорослей, если глицерин в начальный момент времени введен в водный раствор,
содержащий клетки, в концентрации C0 = 2 * 10-5
М (моль/литр) и эта концентрация поддерживается постоянной.
Изобразить графически распределение
глицерина внутри клетки, в мембране и в окружающей среде:
А) в начальный момент времени;
Б) в некоторый промежуточный момент
времени;
В) в установившемся равновесном
состоянии.
Коэффициент проницаемости через
мембрану для глицерина Р = 2,1 * 10-9 м/с, коэффициент распределения вещества
между мембраной и водной средой К = 7,5 * 10-5. Толщина мембраны l = 10 нм.
Дано:
C0 = 2 * 10-5
моль/л = 2 * 10-5 моль/см3 = 2 * 10-2 моль/м3
Р = 2,1 * 10-9 м/с
К = 7,5 * 10-5.
l = 10 нм. =
10-8 м
Найти: J, D
Решение
Для нахождения плотности потока
используем формулу:
J = P(C0 — C1)
Учтем то, что в начальный момент
времени С1 = 0, тогда
J = P*C0
J = 2,1 *
10-9 *2 * 10-2 = 4,2 * 10-11 моль/м2*с
Коэффициент диффузии находим из
выражения:
D =
D = 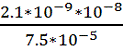
Строим графики:
А) в начальный момент времени
Б) в некоторый промежуточный момент
времени
В) в установившемся равновесном
состоянии.
Задача 10
Среднее значение концентрации ионов
калия, натрия и хлора в аксоплазме гигантского аксона кальмара равны
соответственно 410, 49, 40 моль/л (М). В морской воде концентрация этих же
ионов равна соответственно 10, 460, 540 моль/м3 (М).
Вычислить потенциал Нернста для
каждого из этих ионов при 270С
Дано:
Калий:
С0 [K+] = 10 М
С1 [K+]= 410 М
Натрий:
С0 [Na+] = 460 М
С1 [Na+]= 49 М
Хлор;
С0 [Сl-] = 540 М
С1 [Cl-]= 40 М
Т = 270С = 300 К
Найти:
Решение:
По уравнению Нернста:
где R —
универсальная газовая постоянная (8,31 Дж/моль*К)
F —
постоянная Фарадея (9,652*107 Кл*кг/моль)
Z — заряд
иона (для К+ = 1; для Na+ = 1; для Cl-1 = -1)
Для калия:
= 0,0258 * (- 3,713) = — 0,0959 В
96 мВ
Для натрия:
= 0,0258 * 2,24 = 0,05785 В
58 мВ
Для хлора:
= -0,0258 * 2,6 = — 0,06724 В
— 67 мВ
Найдем общий мембранный потенциал
для заданной аксоплазме гигантского аксона кальмара .
Уравнение Нернста — это частный
случай уравнения Гольдмана, которое превращается в первое , если проницаемость
для одного из ионов гораздо выше, чем для других.
Воспользуемся уравнением Гольдмана:
Мембранный потенциал
формамид
плазматический мембрана
Например, в гигантском аксоне
кальмара P — проницаемости: Na : Cl = 1 : 0,04 : 0,45, т. е. проницаемость для
К+ заметно выше, чем для других ионов.
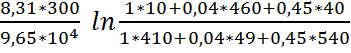
= 0,02583 *
ln 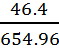
мВ
Литература
1. Волькенштейн
М.В. Биофизика. М.: Наука, 1988.
2. Рубин
А.Б. Биофизика: В 2 т. М.: Высшая школа, 2000.
. Кантор
Ч., Шиммел П. Биофизическая химия: В 3 т. М.: Мир, 1984.
. Блюменфельд
Л.А. Проблемы биологической физики. М., 1977.
. Ивков
В.Г., Берестовокий Г.Н. Липидный бислой биологических мембран. М., 1982.
. Конев
С.В., Волотовский И.Д. Фотобиология. Минск, 1979.
. Котык
А., Яначек К. Мембранный транспорт. М., 1980.
. Ходжкин
А. Нервный импульс. М., 1965.
. Давид
Р. Введение в биофизику. М.: Мир, 1982.

Химический состав живых клеток отличается от внешней среды, причем различия есть не только в сложных молекулах, таких как белки и нуклеиновые кислоты, но и в ионах. Например, во внеклеточной среде преобладают ионы натрия, а в клетке — ионы калия, причем последних на порядок больше. Сама по себе плазматическая мембрана клеток практически непроницаема для ионов, и поэтому для их переноса через мембрану существуют специальные транспортные механизмы — встроенные в мембрану белки. В геноме человека более 800 генов ионных каналов и транспортеров, а общую долю генов, вовлеченных в трансмембранный транспорт, оценивают в 10 % от всех генов, кодирующих белки[1]. В этой серии статей мы рассмотрим механизмы трансмембранного переноса ионов и разнообразие реализуемых ими клеточных функций. Мы также уделим внимание патологиям, вызванным мутациями в генах, кодирующих соответствующие каналы и транспортеры.
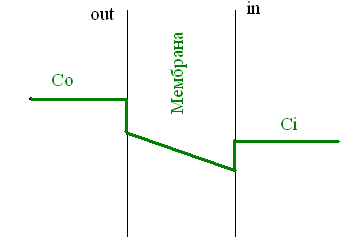
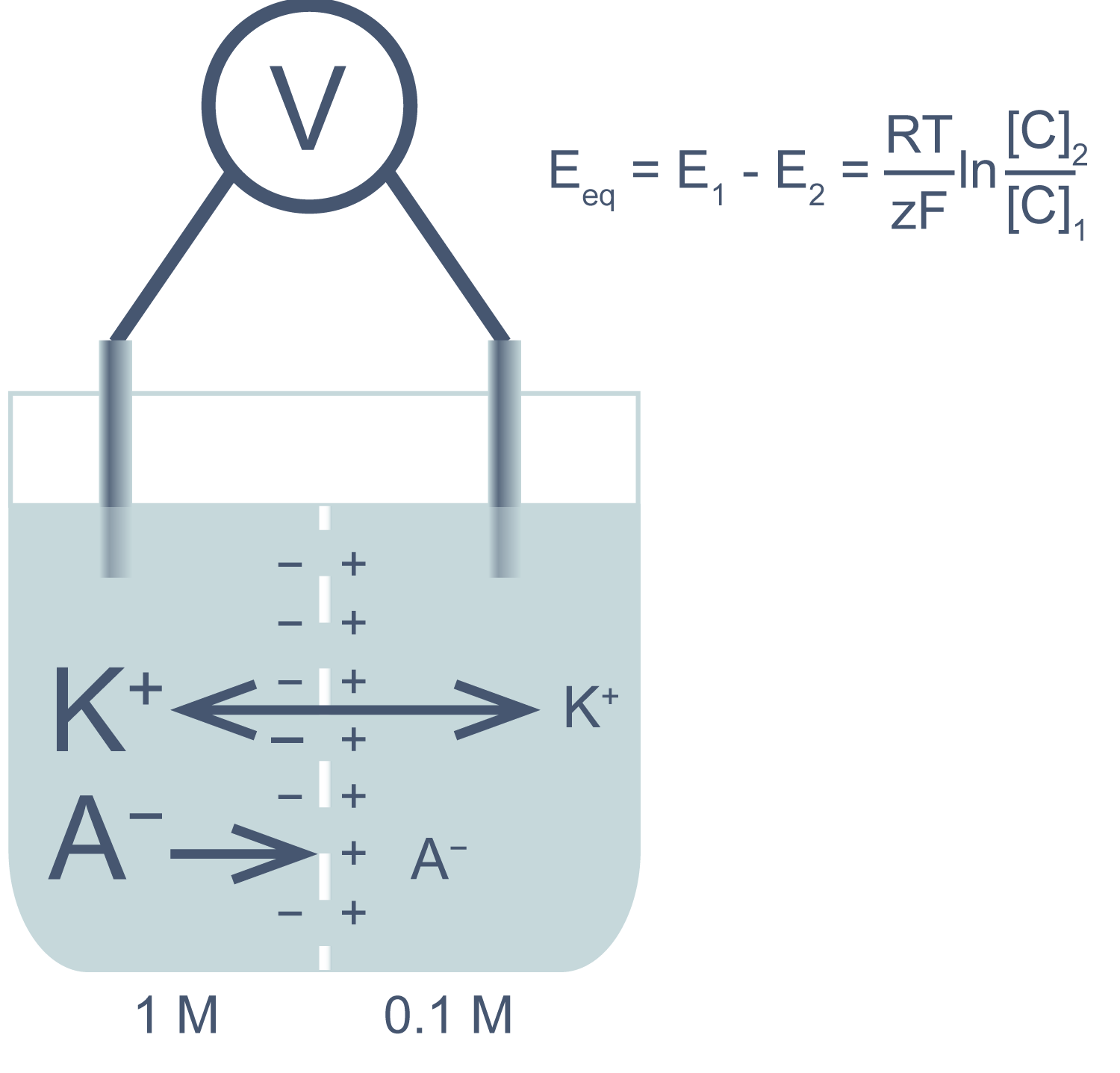
Представим себе электрохимическую ячейку — сосуд, разделенный пополам полупроницаемой мембраной, в левой части которого находится 1,0 М раствор KCl, а в правой — 0,1 М KCl. Через мембрану могут проходить катионы K+, но не анионы Cl−. Ионы K+ в результате процесса диффузии будут переходить из левого отсека в правый по градиенту концентрации*, тогда как ионы Cl−, неспособные последовать за катионами, останутся в исходном отсеке. Благодаря такому разделению зарядов на мембране будет накапливаться электрохимический потенциал: избыток анионов с левой стороны мембраны и избыток катионов с правой. Этот потенциал можно измерить, опустив в отсеки электроды, подсоединенные к вольтметру.
Асимметричный поток катионов не будет продолжаться бесконечно: накопленный электрический потенциал (с избытком положительного заряда с левой стороны мембраны) будет противодействовать диффузии ионов калия в левый отсек. Через некоторое время поток ионов K+ из правого отсека в левый сравняется по скорости с потоком из левого отсека в правый, и система достигнет равновесия. Для математического описания подобного равновесия применяют уравнение Нернста (рис. 1).
Рисунок 1 | Электрохимическая ячейка. V — вольтметр. Справа приведено уравнение Нернста, где Eeq — равновесный потенциал; E1 – E2 — разность потенциалов по обе стороны мембраны; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура (в кельвинах); F = 96485,55 Кл·моль–1 — константа Фарадея; z — степень окисления иона (его заряд); [C]1, 2 — равновесные концентрации ионов по обе стороны мембраны.
Если принять, что равновесные концентрации ионов K+ в нашем примере равны начальным, разность потенциала на мембране при 25 °C приблизительно равна –58 мВ.
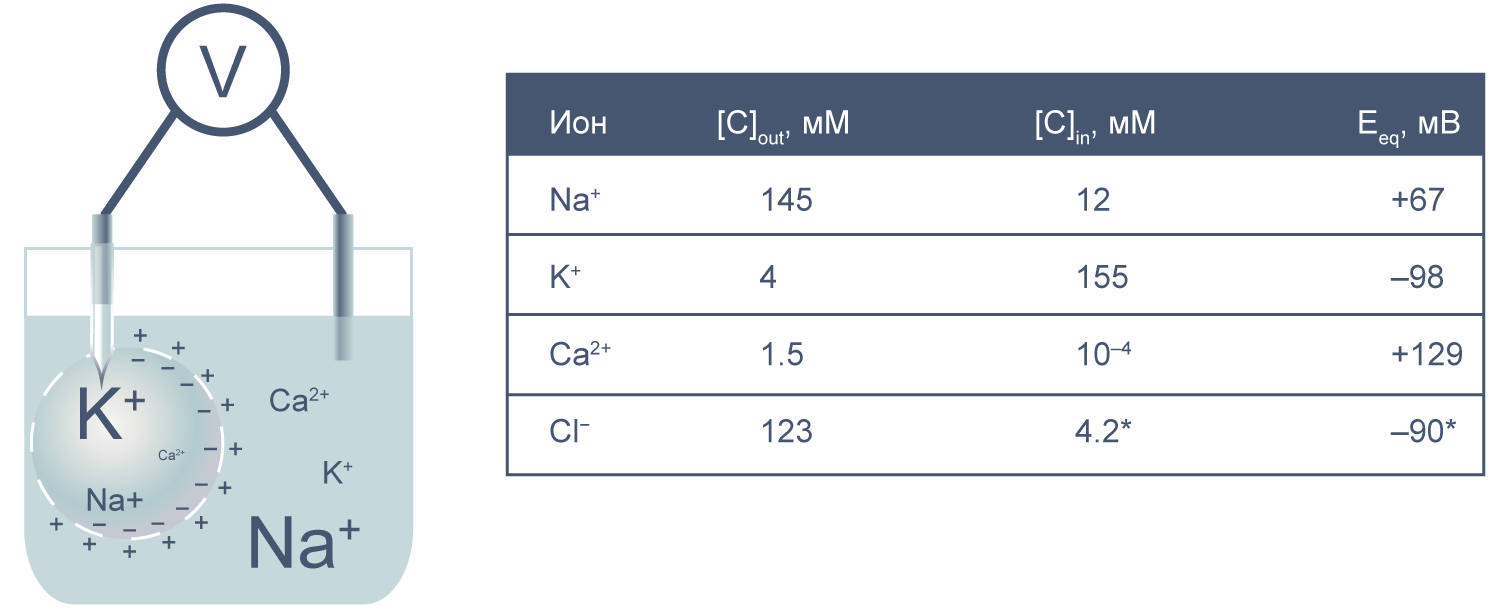
Рисунок 2 | Клетка как электрохимическая ячейка. Справа приведены концентрации основных ионов внутри и вне клетки[2].
Теперь представим, что левая часть нашей электрохимической ячейки — это живая клетка, а правая — внешняя среда. Добавим к этой картине концентрации других физиологически значимых ионов. На мембране клетки также будет накапливаться электрохимический потенциал. Величину электрической составляющей мембранного потенциала измеряют относительно потенциала вне клетки, принимая его за ноль.
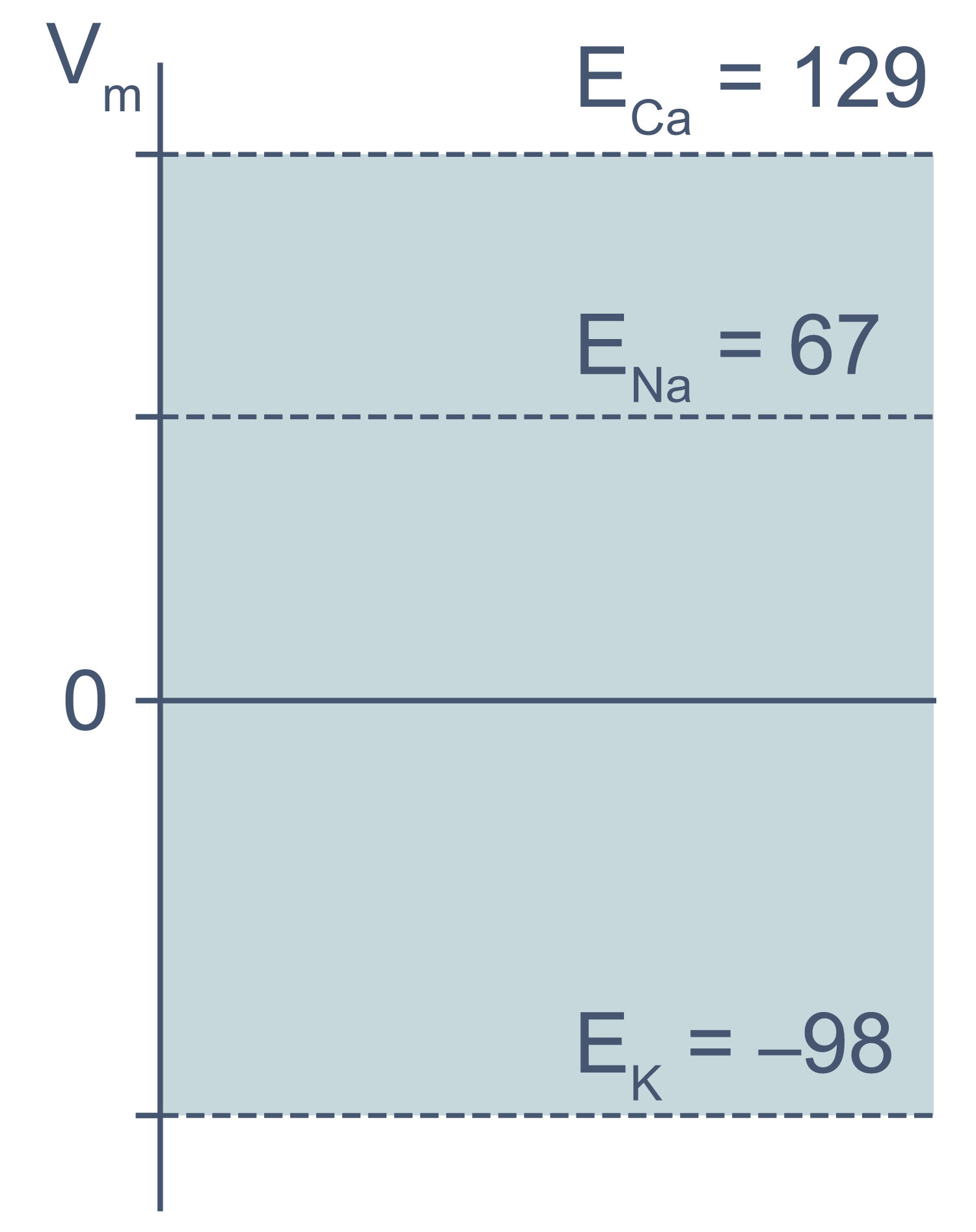
В первом приближении можно сказать, что мембрана клетки проницаема для калия и непроницаема для других катионов (Na+, Ca2+) и анионов (в первую очередь для Cl– и отрицательно заряженных участков макромолекул). Ионы калия, выходя из клетки, создают потенциал покоя. Его величина достаточно близка к значению равновесного потенциала для K+, однако строго не равна ему, поскольку в реальности другие катионы и Cl– могут участвовать в формировании потенциала покоя в различных типах клеток. Вычислив равновесные потенциалы для основных ионов, мы получим динамический диапазон величины потенциала на мембране клетки: он не может быть более отрицательным, чем EK, и не может достигать более положительных значений на пике потенциала действия, чем ECa. Причина такого поведения кроется в том, что система стремится к равновесию, и при малейших отклонениях мембранного потенциала в сторону более отрицательных значений, чем EK, K+ будет двигаться по электрохимическому градиенту внутрь клетки, возвращая мембранный потенциал к равновесному потенциалу для калия.
Рисунок 3 | Диапазон возможных значений мембранного потенциала от ЕK до ECa (показан голубым цветом).
Величина потенциала покоя зависит от типа клеток и равна около –30 мВ в невозбудимых клетках и около –80 мВ в возбудимых клетках (нейроны, мышечные и эндокринные клетки). Когда мембранный потенциал более отрицателен, чем потенциал покоя, говорят, что мембрана гиперполяризована, а когда он приближается к нулю или даже принимает положительные значения, говорят о деполяризации мембраны.
В общем случае мембранный потенциал можно вычислить согласно уравнению Гольдмана-Ходжкина-Катца, которое принимает в расчет все основные катионы и анионы:
где E — мембранный потенциал; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура; F = 96485,55 Кл·моль–1 — константа Фарадея; PX — проницаемость мембраны для иона X; [C]in, out — равновесные концентрации ионов внутри и вне клетки. N.B.: для анионов внеклеточная концентрация стоит в знаменателе, а внутриклеточная — в числителе.
Что же обеспечивает проницаемость мембраны для ионов? Заряженные частицы не могут самостоятельно пересекать гидрофобный внутренний слой плазматической мембраны, и поэтому требуются специальные белки, образующие гидрофильную пору, через которую ионы могут двигаться через мембрану. Такие белки называются ионными каналами. Основной вклад в поддержание потенциала покоя вносят калиевые каналы семейств Kir (inward rectifying K+ channels — калиевые каналы внутреннего выпрямления) и K2P (two—pore domain K+ channels — калиевые каналы с двумя поровыми доменами, которые часто называют каналами утечки), а каналы других семейств могут обеспечивать быстрое изменение мембранного потенциала в возбудимых клетках. Каналы могут селективно пропускать определенный тип ионов, например, K+ (как каналы семейства Kir), или более широкий спектр веществ, как, например, коннексины — белки щелевых контактов.
Каналы бывают потенциал-зависимые (потенциал-управляемые), лиганд-зависимые, термо- и механочувствительные — в зависимости от стимула, который управляет открытием и закрытием канала. В роли стимула, таким образом, могут выступать изменения мембранного потенциала, химические агенты, температура, свет, механические и другие стимулы. Один и тот же канал может открываться под действием различных эндо- и экзогенных стимулов. Так, канал TRPV1 активируется повышением температуры более 43 °C[3], кислым pH[4] и разнообразными химическими веществами: капсаицином (алкалоид из перцев рода Capsicum)[3], эндоканнабиноидом анандамидом[5], окситоцином[6] и др.
Физиологическая роль каналов крайне важна. К примеру, мутации в генах, кодирующих белки ионных каналов, лежат в основе патогенеза многих заболеваний человека: некоторых видов эпилепсии[7], муковисцидоза[8], некоторых аритмий[9, 10] и др. Ионные каналы служат мишенями действия многих лекарств, ядов и токсинов.
Однако для формирования потенциала покоя недостаточно одних лишь каналов, ведь нужно создавать и поддерживать концентрационные градиенты на мембране. Основной механизм поддержания градиентов концентрации калия и натрия — это Na/K-АТФаза, фермент, за счет гидролиза одной молекулы АТФ переносящий три Na+ наружу и два K+ внутрь клетки. Она осуществляет электрогенный транспорт: в каждом транспортном цикле при переносе одного дополнительного положительного заряда наружу генерируется некоторая разность потенциалов на мембране. Чтобы оценить этот вклад Na/K-АТФазы в поддержание потенциала покоя, можно заблокировать работу фермента алкалоидом оубаином. Тогда мембрана деполяризуется примерно на 10 мВ[11].
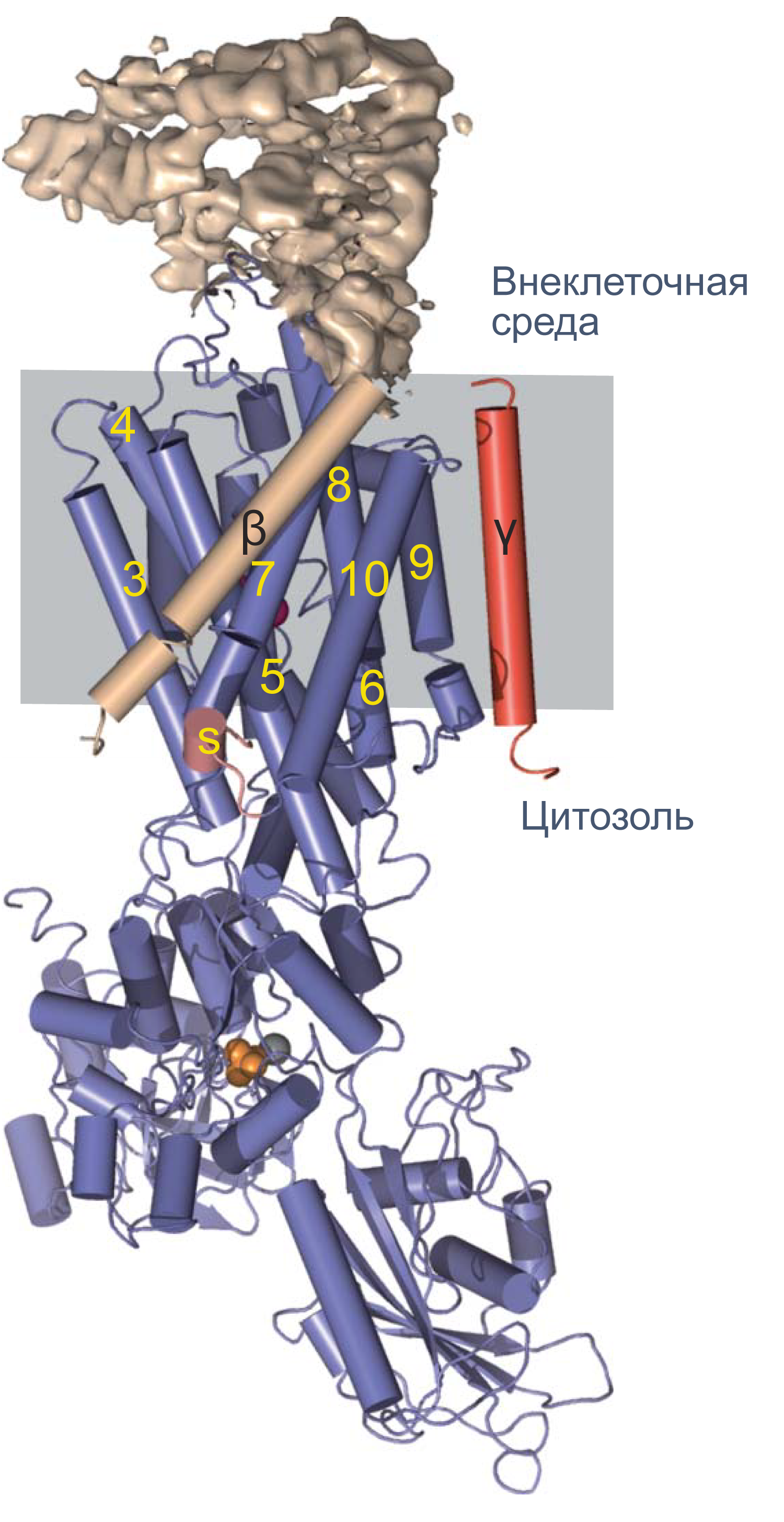
Рисунок 4 | Структура Na/K-АТФазы, полученная методом рентгеновской кристаллографии. Синим цветом показана α-субъединица, красным — γ-субъединица; β-субъединица показана бежевым цветом. Внеклеточная часть β-субъединицы показана в виде электронной плотности. Альфа-спирали изображены цилиндрами, бета-слои — плоскими стрелками[12].
Активный и пассивный транспорт веществ через мембрану
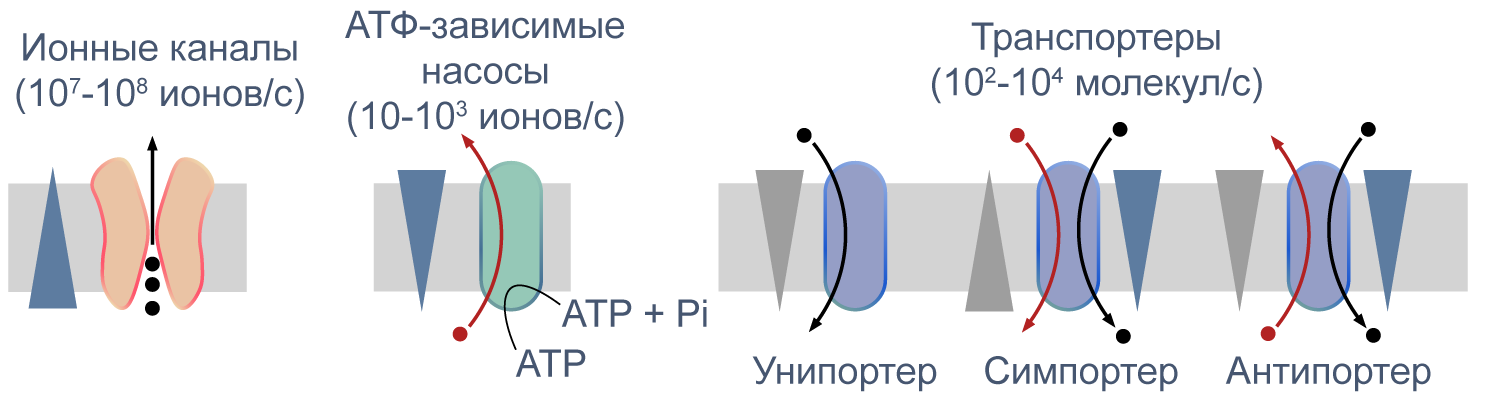
Процессы транспорта веществ через мембрану можно классифицировать по источнику энергии для транспорта. Пассивный транспорт — это движение вещества через канал или транспортер по градиенту концентрации*, то есть за счет энергии электрохимического градиента. Таким способом через калиевые каналы пассивно движутся ионы калия, или осуществляется перенос глюкозы через транспортер GLUT4 (такой тип транспорта еще называют облегченной диффузией, а транспортеры, переносящие только один субстрат — унипортерами). Кроме пассивного транспорта, существует активный транспорт, при котором субстраты переносятся против градиента концентрации с затратой энергии, запасенной клеткой в виде АТФ (например, Na/K-АТФаза).
Некоторые транспортеры сопрягают перенос ионов или молекул против градиента концентрации с движением ионов по градиенту концентрации. Симпортеры переносят различные частицы в одном направлении (например, KCC2 — K—Cl cotransporter 2 — K/Cl котранспортер 2), а антипортеры, или обменники, — в противоположных (например, NHE-1 — Na/H exchanger 1 — Na/H обменник, участвующий в поддержании клеточного pH). Такой транспорт называется вторично-активным.
Рисунок 5 | Пассивный и активный транспорт веществ через мембрану. Треугольниками показаны концентрационные градиенты. Черными стрелками показано движение по градиенту концентрации, красными — против градиента концентрации. По [13], с изменениями.
В старой литературе можно встретить концепцию «белков-переносчиков»: до открытия молекулярной идентичности многих каналов и транспортеров (т. е. какая молекула опосредует данный ионный ток и какой ген ее кодирует) существовало представление о переносчиках как о челноках, связывающих субстраты с одной стороны мембраны, диффундирующих через мембрану и высвобождающих субстраты с другой стороны. Однако, когда стали известны аминокислотные последовательности транспортных белков, стало понятно, что все они часто содержат многочисленные трансмембранные домены и образуют сквозной путь через мембрану.
Различия между каналами, транспортерами и насосами заключаются в механизме их работы и регуляции. Каналы представляют собой более или менее селективную пору, через которую ионы могут свободно диффундировать, не вызывая конформационных изменений в белке канала. При токе через отдельный канал в 1 пА по нему проходят 6×106 одновалентных ионов в секунду. Транспортер, связываясь с субстратом, изменяет свою конформацию для переноса субстрата. При ко-транспорте повышается аффинность транспортера в новой конформации к второму субстрату, и субстраты переносятся через мембрану сопряженно. Насосы, также называемые АТФазами, (ауто)фосфорилируются АТФ, и это фосфорилирование значительно изменяет их конформацию и приводит к транслокации субстратов через мембрану. Электрическая проводимость насосов очень мала: Na/K-АТФаза переносит всего около 300 Na+ и 200 K+ в секунду.
Граница между молекулами каналов и транспортеров не всегда строга. Например, семейство хлоридных каналов и транспортеров ClC (англ. Chloride Channel) включает в себя гомологичные друг другу каналы (ClC-1, 2, Ka и Kb) и Cl/H-обменники (ClC-3–7), которые можно превратить в каналы, внеся мутацию в единственный остаток глутамата (т. н. gating glutamate — воротный глутамат) [14]. Na/K-АТФазу также можно превратить в простую пору, например, с помощью палитоксина[15]. Хлоридный канал CFTR относится к группе ABC-транспортеров, однако он использует энергию АТФ не для транспорта ионов, а для регуляции открытия и закрытия канала[16]. Кроме того, существуют данные о том, что везикулярный транспортер глутамата VGLUT1 кроме обмена глутамата на протоны также опосредует не сопряженный с обменом ток Cl− [17].
Клеточная мембрана как электрическая цепь
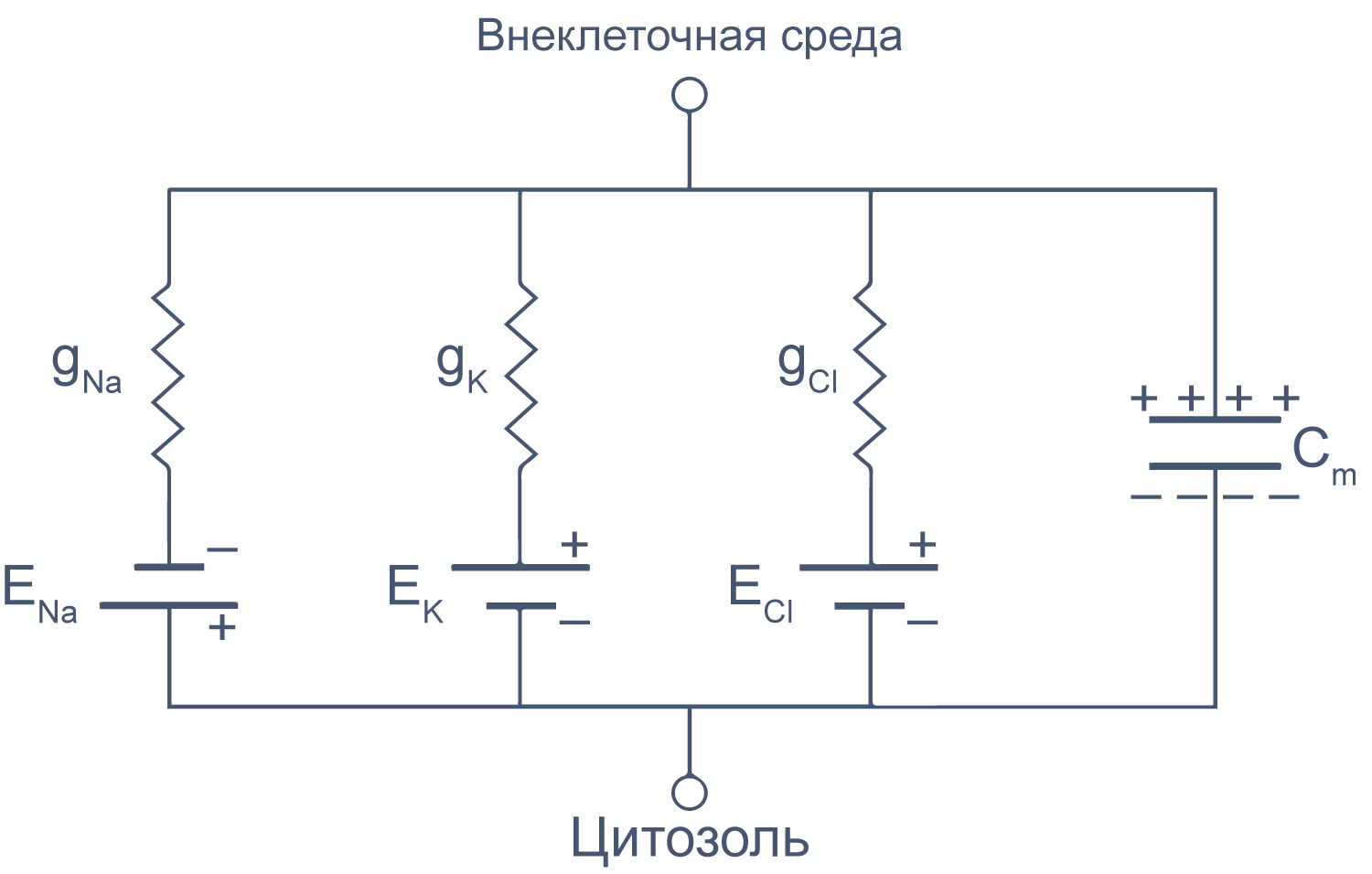
Липидный бислой мембраны можно представить как резистор (сопротивление) и конденсатор (емкость), соединенные параллельно. Величина сопротивления зависит от плотности каналов в мембране и их функционального состояния. Электроемкость возникает из-за разделения зарядов по обе стороны мембраны тонким слоем диэлектрика (гидрофобными хвостами фосфолипидов).
Рисунок 6 | Плазматическая мембрана, представленная в виде RC схемы. gNa, gK, gCl — проводимость** мембраны для ионов Na+, K+ и Cl–, соответственно; ENa, EK, ECl — электродвижущая сила, или равновесные потенциалы для соответствующих ионов, Сm — электроемкость мембраны.
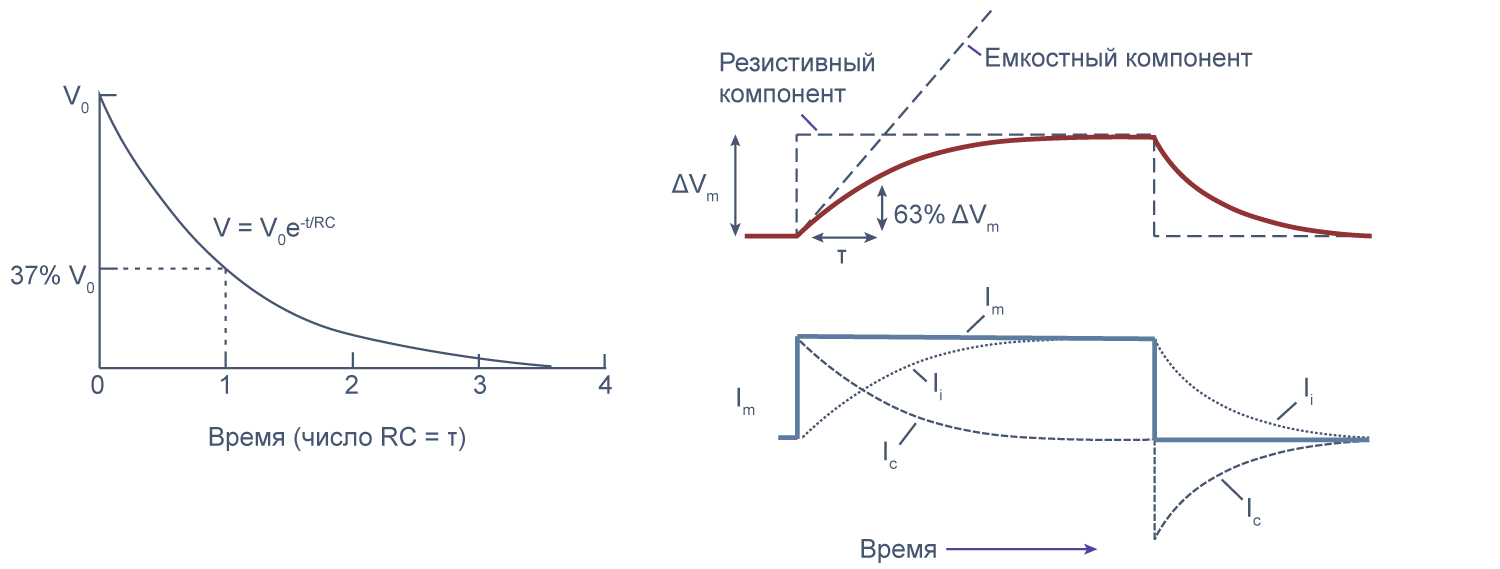
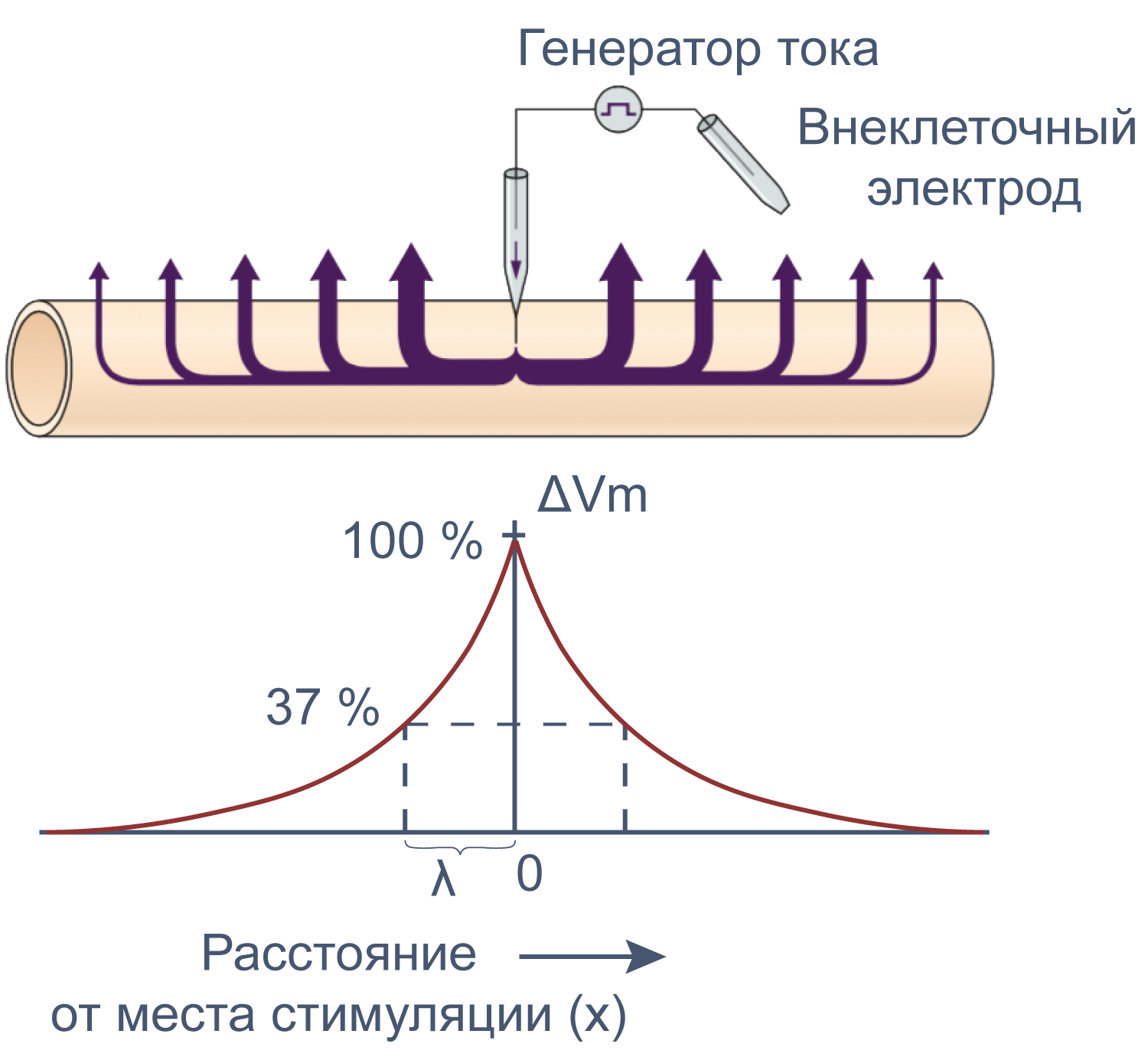
Можно считать, что проводимость (величина, обратная сопротивлению, измеряемая в сименсах) характеризует проницаемые для ионов компоненты структуры мембраны, а емкость — не проницаемые для ионов структуры. Удельная емкость мембраны составляет приблизительно 1 мкФ/см2 или 0,01 пФ/мкм2*** и мало зависит от типа клеток[2]. Это позволяет оценить размер клетки по ее электрическим характеристикам. Высокая электроемкость клеточных мембран задерживает изменения потенциала в ответ на ток. Эту задержку можно выразить через постоянную времени τ, которая равна произведению емкости и параллельно соединенного с ней сопротивления (RC). Если конденсатор зарядить на некоторую величину, а затем дать ему разрядиться через резистор, то потенциал будет убывать экспоненциально согласно формуле V = V0e–t/RC, то есть за каждые τ = RC секунд потенциал будет падать в 1/e раз (на 37 % от исходной величины). Этот расчет применим и к клеточной мембране: падение напряжения при разрядке мембраны будет подчиняться экспоненциальному закону. То есть, если приложить гипер- или деполяризующий стимул, то мембранный потенциал через время τ достигнет 63 % конечного сдвига.
Рисунок 7 | Падение напряжения при разрядке мембраны. Изменение мембранного потенциала при деполяризации мембраны на ΔVm [22], Ic — емкостный ток, Ii — ионный ток, Im — суммарный ток через мембрану. Пояснения в тексте.
Потенциал действия
Возбудимые клетки могут быстро изменять потенциал на мембране и этим запускать внутриклеточные процессы, например, мышечное сокращение или экзоцитоз везикул. Кратковременный локальный скачок мембранного потенциала от приблизительно –80 мВ (значения потенциала покоя) до 0…+20 мВ за счет изменения проницаемости мембраны для ионов называется потенциалом действия.
Для начала рассмотрим потенциал действия в аксонах нейрона на примере гигантского аксона кальмара. Выбор столь экзотического объекта обусловлен историческими причинами. Современная микроэлектродная техника — использование тонких стеклянных микропипеток, заполненных раствором электролита, — была предложена лишь в 1949 году Дж. Лингом и Р. Джерардом[18]. До этого поместить электрод, представлявший собой тонкую проволоку, внутрь клетки, не разрушив ее, можно было только в случае ее крупных размеров. Гигантский аксон кальмара стал идеальным модельным объектом для изучения потенциала действия: его диаметр может достигать 0,5–1 мм. Этот отросток служит для быстрой передачи нервных импульсов у беспозвоночных, у которых отсутствует миелинизация. Внутренним содержимым аксона легко манипулировать, заменяя ионный состав внутриклеточного раствора, а внутрь такого аксона можно поместить электрод для регистрации мембранного потенциала.
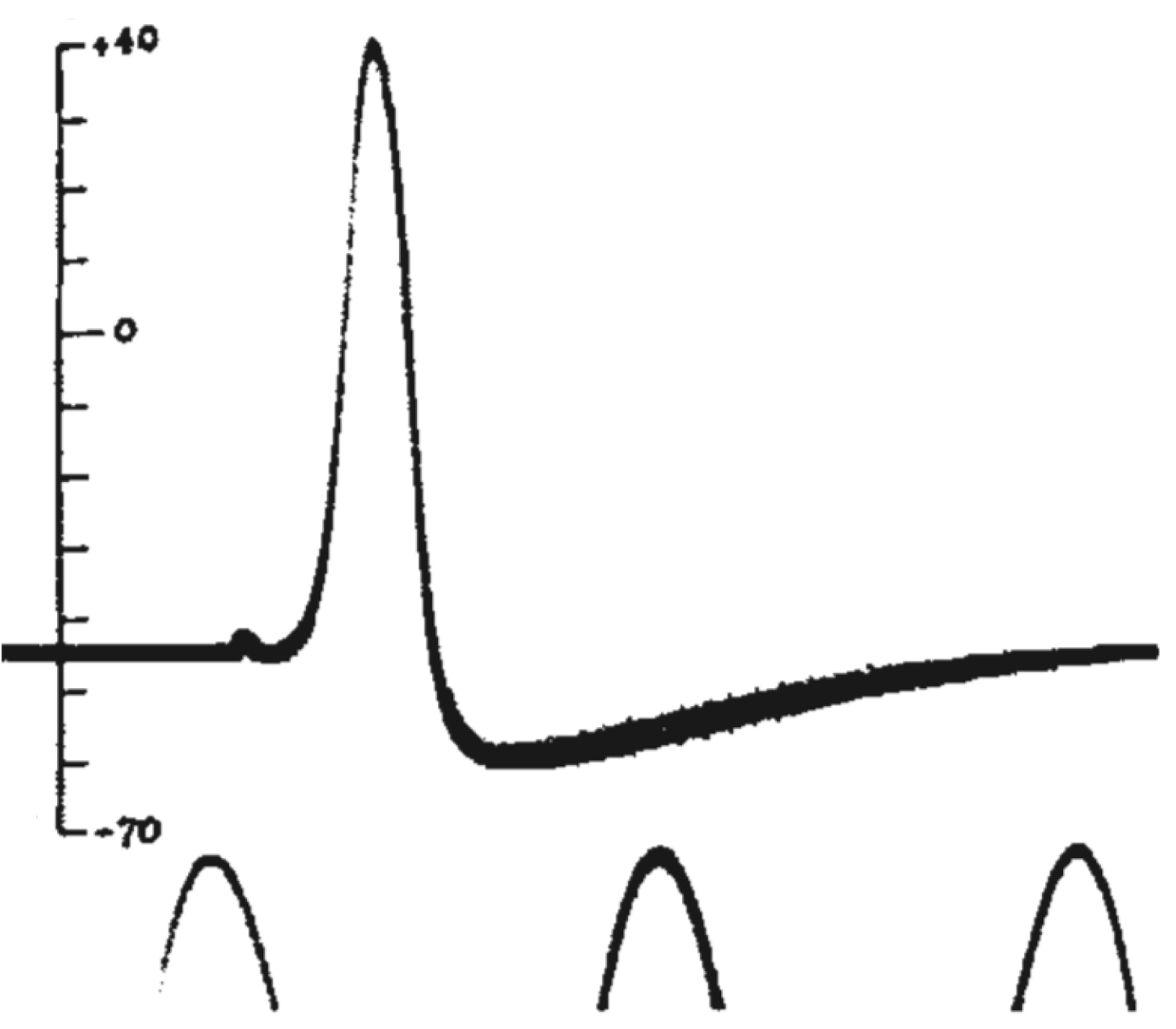
Так, в 1939 году А. Ходжкин и Э. Хаксли опубликовали в журнале Nature короткую заметку «Потенциалы действия, зарегистрированные внутри нервного волокна»[19], в которой они описали первый эксперимент по внутриклеточному измерению мембранного потенциала на гигантском аксоне кальмара. Посмотрим на потенциалы действия, которые зарегистрировали исследователи.
Рисунок 8 | Потенциал действия из статьи А. Ходжкина и Э. Хаксли 1939 года[19]. Потенциал действия был зарегистрирован как разность потенциала между внутренней средой аксона и внешней средой. Пики внизу рисунка — это фрагменты синусоидального сигнала с частотой 500 Гц. Вертикальной чертой отмечен потенциал внутреннего электрода в милливольтах, потенциал морской воды снаружи аксона был принят за ноль.
Мы видим резкую деполяризацию мембраны до положительных значений, а затем более плавное возвращение потенциала к отрицательным значениям, зачастую более отрицательным, чем величина потенциала покоя. Из этих наблюдений следовало два важных вывода: 1) потенциал действия генерируется мембраной клетки, что не было очевидно в 1930-е годы; 2) поскольку измеренная амплитуда потенциала действия была больше величины мембранного потенциала, генерация потенциала действия — это активный процесс, который нельзя объяснить временным «пробоем» в мембране (каким бы наивным такое представление нам не казалось сегодня, в 1930-е так думали многие физиологи). В том же году К. С. Коул и Х. Дж. Кертис[20] зарегистрировали кратковременное изменение проводимости мембраны с 1 мСм/см2 до 40 мСм/см2 при генерации потенциала действия. Эти данные также свидетельствовали о тонкой регуляции этого процесса.
После Второй мировой войны Ходжкин и Хаксли вернулись к своим исследованиям. В 1945 году они опубликовали статью с несколькими дополнительными экспериментами, подтверждающими сформулированные ранее выводы. Но и тогда ионные механизмы потенциала действия оставались неясными.
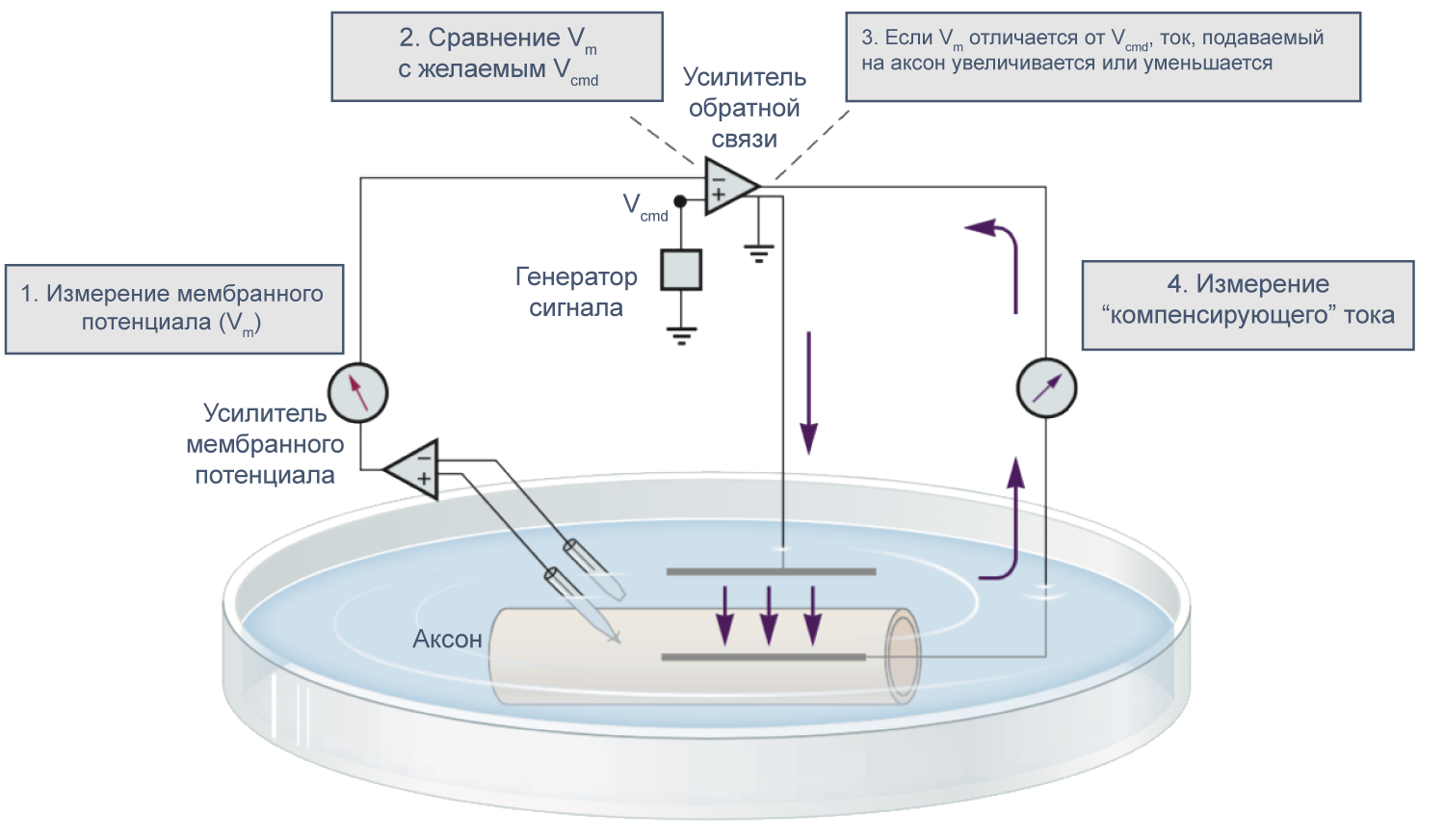
В 1952 году вышла серия статей, посвященных разгадке механизма генерации потенциала действия. Ведущую роль в этом открытии сыграл новый метод фиксации потенциала с помощью двух электродов (в англоязычной литературе TEVC — two-electrode voltage clamp), разработанный в конце 1940-х годов К. С. Коулом и Дж. Мармонтом[21]. Этот метод позволяет измерять не только потенциал, но и токи при заданном значении мембранного потенциала. Как же осуществляется фиксация потенциала с помощью двух электродов на заданном уровне (Vcmd — «командный потенциал»)? В клетку помещают два электрода, один из которых измеряет потенциал (относительно внеклеточного электрода сравнения) и передает его значение на специальный усилитель, который сравнивает измеренный потенциал со значением командного потенциала. Это устройство вычисляет ток, необходимый для компенсации этой разницы, и подает через второй внутриклеточный электрод ток такой величины, чтобы потенциал на мембране клетки стал равен Vcmd (Vm = Vcmd). Из амплитуды тока, необходимого для компенсации сдвига потенциала до Vcmd, можно сделать вывод о токе через мембрану при данном значении мембранного потенциала. Ток при данном значении потенциала равен току, подаваемому на второй электрод, взятому с обратным знаком.
Рисунок 9 | Схема фиксации потенциала с помощью двух электродов[21].
В 1970–80-х годах Эрвин Неер и Берт Сакман (Erwin Neher, Bert Sakmann) предложили метод локальной фиксации потенциала (англ. patch clamp), позволяющий работать с мелкими клетками и токами малой амплитуды и даже регистрировать активность отдельных каналов. Тем не менее, метод фиксации потенциала двумя электродами в микроэлектродной конфигурации используется и сегодня при работе с такими крупными клетками, как ооциты лягушки Xenopus laevis.
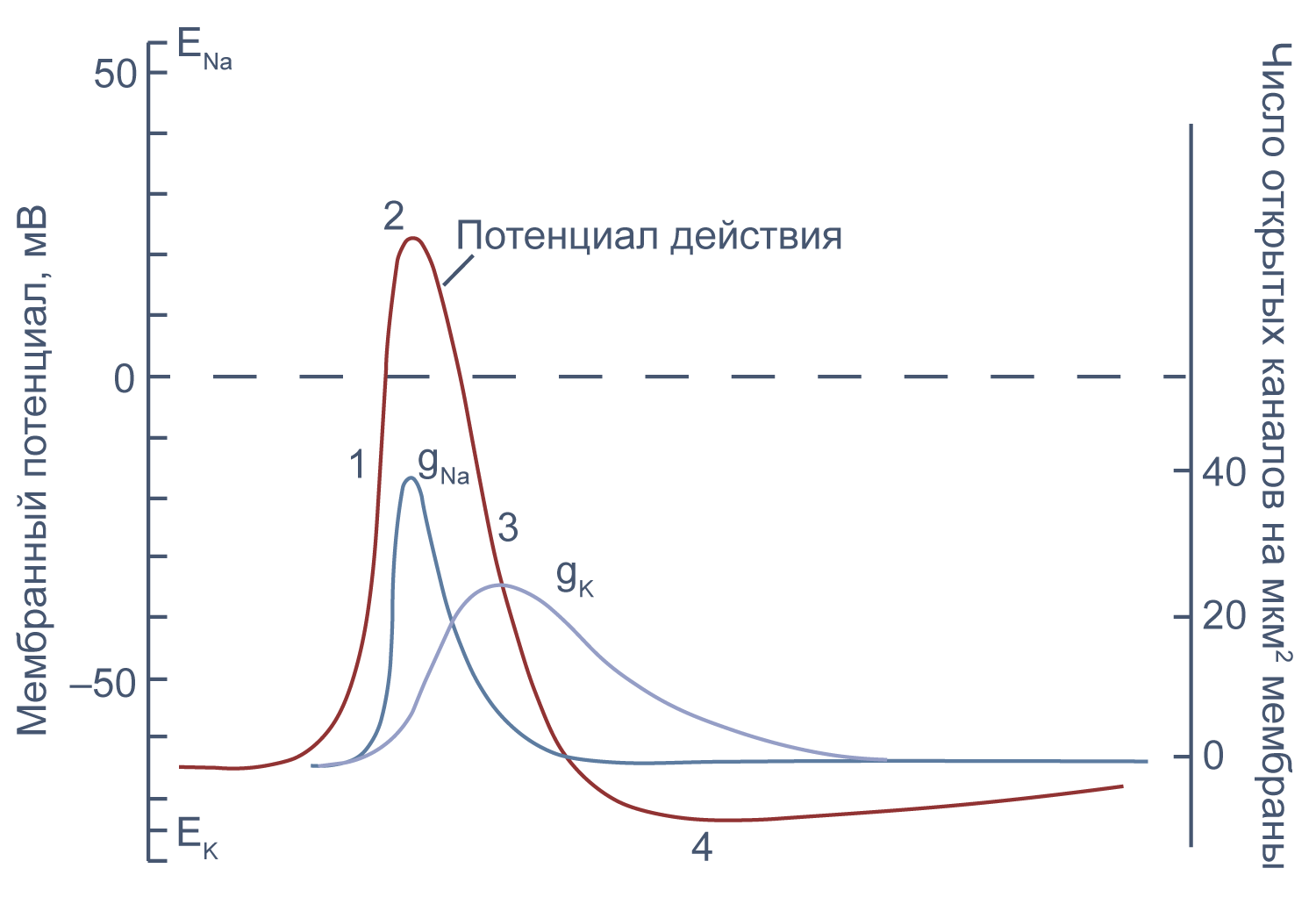
Временной ход потенциала действия
Потенциал действия в аксоне можно разделить на 1) фазу быстрой деполяризации до 2) положительных значений (овершута, от англ. overshoot), 3) фазу реполяризации, в которой потенциал возвращается к потенциалу покоя или даже до несколько более отрицательных значений — 4) следовая гиперполяризация.
Рисунок 10 | Потенциал действия и изменения проводимости мембраны для Na+ и K+ в гигантском аксоне кальмара. Из [22], с изменениями.
Изменяя ионный состав внутри- и внеклеточного раствора, можно изолировать ионные токи, которые опосредуют изменение мембранного потенциала при потенциале действия. Так, помещая аксон в раствор, в котором натрий заменен на холин, можно изолировать натриевый и калиевый компонент потенциала действия, то есть отдельно измерить калиевый ток[20]. Этого же можно достичь применением блокаторов потенциал-зависимых натриевых и калиевых каналов — тетродотоксина и тетраэтиламмония (TEA).
Чтобы понять взаимосвязь ионных токов и вызванных ими изменений потенциала, рассмотрим всю цепь событий при генерации потенциала действия. Сначала мембрана деполяризуется под действием внешнего стимула: поступления в клетку катионов через лиганд-управляемые каналы, закрытия калиевых каналов или электрической стимуляции в эксперименте. Если деполяризация достигает порогового значения для потенциалзависимых натриевых каналов (Nav), они открываются, натрий по градиенту своей концентрации входит в клетку, и мембрана деполяризуется еще сильнее. Дальнейшая деполяризация влечет за собой лавинообразное открытие все новых натриевых каналов, ток через которые приводит к еще большей деполяризации. Однако эта петля положительной обратной связи не работает бесконечно: открывшись на некоторое время, натриевые каналы инактивируются и не могут открыться вновь, пока мембранный потенциал не вернется к отрицательным значениям.
Механизм инактивации был предложен еще в математической модели Ходжкина и Хаксли[23] на основании кинетических характеристик тока. Они предположили, что в натриевом канале есть три активационные частицы m и одна инактивационная частица h. Когда стала известна аминокислотная последовательность канала, выяснилось, что канал на самом деле имеет четыре гомологичных активационных домена и один инактивационный, однако один из активационных доменов срабатывает значительно медленнее остальных трех, и его влияние на кинетические характеристики тока маскируется происходящей в то же время инактивацией канала (например, [24]).
В то же время деполяризация мембраны приводит к активации потенциал-зависимых калиевых каналов (Kv), которые открываются медленнее, чем натриевые, калий выходит из клетки, и потенциал возвращается к потенциалу покоя и может даже временно стать более отрицательным: пока натриевые каналы инактивированы, потенциал становится ближе к калиевому равновесному потенциалу, и это явление называется следовой гиперполяризацией.
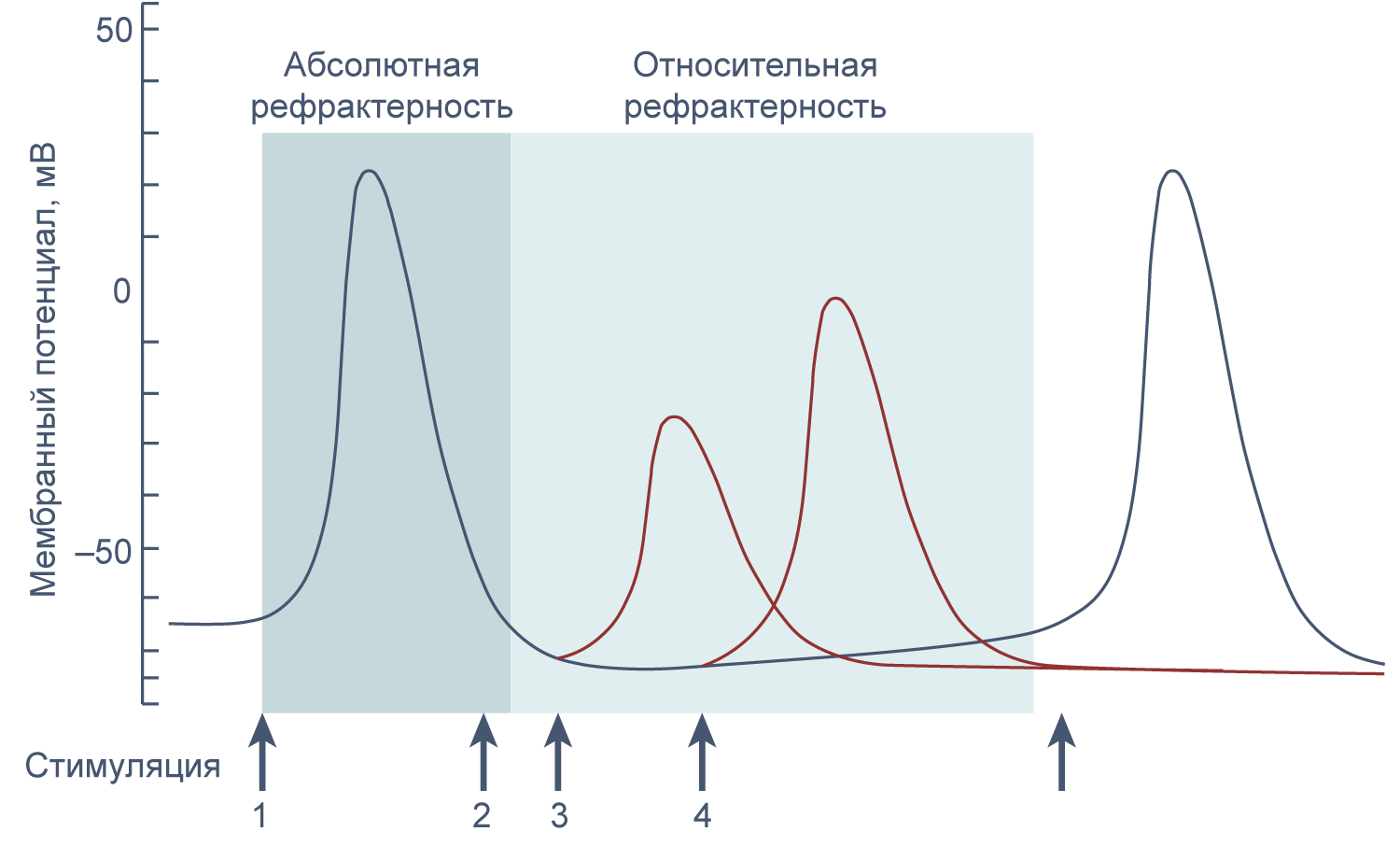
Генерация потенциала действия происходит по принципу «все или ничего». Если деполяризующий стимул не достиг порогового значения, потенциал действия не генерируется. Если же порог был достигнут, положительная обратная связь обеспечивает открытие всех доступных натриевых каналов, и потенциал действия достигает своей максимальной амплитуды.
Если новый стимул приходит во время или сразу после генерации потенциала действия, второй потенциал действия не возникает или обладает меньшей амплитудой, чем первый. Это явление называется рефрактерностью. Стимул, возникший в период абсолютной рефрактерности, не вызывает генерации потенциала действия, а пришедшийся на период относительной рефрактерности вызывает потенциал действия уменьшенной амплитуды, так как часть натриевых каналов все еще инактивирована.
Рисунок 11 | Абсолютная и относительная рефрактерность. Стимуляция в период абсолютной рефрактерности (2) не ведет к генерации потенциала действия, а стимуляция в период относительной рефрактерности (3 и 4) приводит к генерации потенциала действия сниженной амплитуды.
Стоит отметить, что внутриклеточная концентрация физиологически значимых ионов при генерации потенциала действия не меняется, и ионные токи задействуют пренебрежимо малую долю от общего числа Na+ и K+. Это можно проиллюстрировать следующим примером. Рассчитаем число ионов, которое должно пересечь мембрану для деполяризации на 100 мВ. Заряд на мембране равен произведению емкости мембраны и потенциала: Q = CmVm. Удельная емкость мембраны близка к 1 мкФ/см2, а сдвиг потенциала в нашем случае равен 0,1 В. Тогда количество разделенных зарядов равно Q = 10−6 Ф/см2 × 0,1 В = 10−7 Кл/см2. Величина заряда одного иона Na+ или K+ (элементарного заряда) равна 1,6 × 10−19 Кл, тогда количество переносимых через мембрану ионов равно 10−7 Кл/см2 / 1,6 × 10−19 Кл = 6,25 × 1011 ионов/см2, или 6250 ионов/мкм2. Для клетки диаметром 10 мкм площадь поверхности мембраны будет приблизительно равна 4πr2 = 314 мкм2 (в этом расчете для простоты мы считаем клетку гладкой сферой), а объем — 4πr3/3 = 524 мкм3. При внутриклеточной концентрации Na+ 10 мМ, а K+ 150 мМ содержание этих ионов в цитозоле будет равно 3,2 × 109 и 4,7 × 1010 соответственно. В течение одного потенциала действия приблизительно 314 мкм2 × 6,250 ионов/мкм2 ≈ 2 000 000 ионов Na+ входит в клетку в фазе деполяризации и примерно столько же ионов K+ выходит из клетки в фазе реполяризации, что составляет всего 0,06 % от общего числа ионов натрия в клетке. Токи такой величины обычно не изменяют макроскопические концентрации ионов в клетке, поскольку работа Na/K-АТФазы компенсирует эти незначительные изменения. Однако при определенных условиях концентрации Na+ и K+ все же могут измениться, например, при продолжительной стимуляции аксонов с малым диаметром[25].
Распространение возбуждения по аксону
Электрические свойства мембраны помогают понять изменения мембранного потенциала не только во времени, но и в пространстве. Пассивное, или электротоническое распространение возбуждения по мембране происходит без изменения проводимости потенциал-зависимых каналов. Для распространения потенциала действия важен как активный (изменение проводимости натриевых и калиевых каналов), так и пассивный механизмы, поскольку деполяризация, вызывающая открытие новых потенциал-зависимых натриевых каналов, должна достигнуть нового невозбужденного участка аксона, и происходит это благодаря электротоническому распространению возбуждения.
Рисунок 12 | Электротоническое распространение возбуждения. Пояснения в тексте [22].
Сдвиг потенциала в точке, отстоящий на x от места стимуляции, можно вычислить как Ex = E0e–x/λ, где E0 — это сдвиг потенциала в точке стимуляции, а λ — постоянная длины.
Постоянная длины возрастает с увеличением сопротивления мембраны (rm) и уменьшается с возрастанием сопротивления аксоплазмы (ri), которое в свою очередь зависит от концентрации подвижных зарядов в объеме аксона. Знание этих закономерностей позволяет понять зависимость скорости распространения возбуждения от радиуса (R) аксона. Сопротивление мембраны rm пропорционально 1/2πR, сопротивление аксоплазмы ri — 1/πR2, а емкость мембраны Cm пропорциональна R. По мере увеличения радиуса аксона и rm, и ri уменьшаются, но ri уменьшается сильнее. Постоянная длины увеличивается, следовательно, сдвиг потенциала может распространяться по более крупному аксону дальше. Кроме того, увеличение радиуса аксона ведет к увеличению емкости мембраны, однако этот эффект нивелируется тем, что емкость с увеличением радиуса растет линейно, а уменьшение ri пропорционально квадрату радиуса. Таким образом, проводимость аксоплазмы увеличивается быстрее (при снижении ri), чем растет емкость мембраны, и это позволяет току быстрее достигать невозбужденных участков мембраны более крупного аксона.
Зависимость скорости распространения потенциала действия по аксону от его диаметра объясняет необходимость в гигантских аксонах у кальмара. Однако у позвоночных гигантских аксонов нет, и достаточная скорость проведения нервных импульсов достигается с помощью миелинизации аксонов. Миелиновые оболочки образованы специальными глиальными клетками: олигодендроцитами в центральной нервной системе и клетками Шванна в периферической. Эти клетки оборачивают аксон, образуя вокруг него плотный чехол из десятков слоев плазматической мембраны, который работает как изолятор. Под миелиновой оболочкой очень мало или почти нет натриевых каналов. Они оказываются расположены на небольших участках мембраны аксона между двумя соседними шванновскими клетками или олигодендроцитами — в перехватах Ранвье. Миелиновая оболочка увеличивает скорость проведения потенциала действия благодаря повышению сопротивления мембраны rm. При этом снижаются потери тока через мембрану, и деполяризация может пассивно распространяться на бо́льшие расстояния. Кроме того, из-за снижения емкости мембраны Cm, меньшая доля тока тратится на перезарядку мембраны. Миелинизация делает передачу потенциала действия не только быстрее, но и эффективнее, поскольку натриевые каналы располагаются только в перехватах Ранвье, благодаря чему меньшее количество ионов натрия входит в клетку и меньше энергии требуется на работу Na/K АТФ-азы для поддержания концентрационного градиента.
Потенциалы действия в других возбудимых клетках
Минималистичный натриево-калиевый потенциал действия характерен только для аксонов нейронов. В других частях нейрона и в иных типах возбудимых клеток в генерации потенциала действия принимают участие разнообразные ионные каналы, в том числе калиевые каналы других семейств и кальциевые каналы плазматической мембраны и эндоплазматического ретикулума (ЭПР является внутриклеточным депо кальция; общая концентрация Ca2+ в нем достигает миллимолярных значений, а концентрация свободного кальция находится в микромолярном диапазоне[26]; эти значения на несколько порядков выше, чем 100 нМ свободного Ca2+ в цитозоле в состоянии покоя). Различия в экспрессии генов ионных каналов в различных типах возбудимых клеток порождают разнообразие потенциалов действия, различающихся ионными механизмами, длительностью (от 1,5 мс в аксонах до 500 мс в кардиомиоцитах желудочков), необходимостью внешнего стимула для генерации или наличием собственного ритма. Многие ионные каналы, не участвуя напрямую в генерации потенциала действия, влияют на возбудимость клеток и таким образом вносят вклад в разнообразие электрической активности клеток.
* Принятое в физиологической литературе употребление фраз «по» или «против градиента концентрации» расходится с физическим понятием градиента. В математике и физике градиент направлен в сторону наибольшей скорости возрастания функции или величины; так, если вещество движется в направлении этого вектора, то физиологи говорят о движении «против градиента концентрации», а если в противоположном направлении — то «по градиенту концентрации». Такое словоупотребление прочно закрепилось в литературе, но пусть оно не сбивает вас с толку, когда вы размышляете, откуда взялся минус перед градиентом концентрации в уравнении диффузионного потока (уравнении Фика): J = — D dC/dx, где J — диффузионный поток [моль∙см-2∙с-1], D — коэффициент диффузии [см2∙с-1], а dC/dx— градиент концентрации.
** Проводимость (g = 1/R) — это характеристика скорости движения любых зарядов через мембрану, а проницаемость (P) отражает, насколько легко частицы могут двигаться через мембрану независимо от того, движутся они или нет. Для ионов эти величины связаны. Например, в фазе быстрой деполяризации при потенциале действия возрастает как проводимость, так и проницаемость мембраны для ионов натрия. Однако зачастую, если проницаемость канала для какого-то иона высока из-за высокого сродства участков поры канала для этого иона, такие ионы будут двигаться через канал медленнее, и проводимость будет ниже, чем для других ионов, для которых канал менее проницаем.
*** Удельная емкость чистого липидного бислоя составляет около 0,8 мкФ/см2, разница между электроемкостью мембраны и липидного бислоя возникает из-за обилия встроенных в мембрану белков.
Библиография
- Hediger M.A. et al. The ABCs of membrane transporters in health and disease (SLC series): Introduction // Mol. Aspects Med. 2013. Vol. 34. P. 95–107.
- Hille B. Ion Channels of Excitable Membranes. Third edit. Sinauer Associates, Inc., 2001.
- Caterina M.J. et al. The capsaicin receptor: A heat-activated ion channel in the pain pathway // Nature. 1997. Vol. 389, № 6653. P. 816–824.
- Jordt S.-E., Tominaga M., Julius D. Acid potentiation of the capsaicin receptor determined by a key extracellular site // Proc. Natl. Acad. Sci. 2000. Vol. 97, № 14. P. 8134–8139.
- Smart D. et al. The endogenous lipid anandamide is a full agonist at the human vanilloid receptor (hVR1) // Br. J. Pharmacol. 2000. Vol. 129, № 2. P. 227–230.
- Nersesyan Y. et al. Oxytocin Modulates Nociception as an Agonist of Pain-Sensing TRPV1 // Cell Rep. 2017. Vol. 21, № 6. P. 1681–1691.
- Berkovic S.F. et al. Human epilepsies: interaction of genetic and acquired factors // Trends Neurosci. 2006. Vol. 29, № 7. P. 391–397.
- Welsh M.J., Smith A.E. Molecular mechanisms of CFTR chloride channel dysfunction in cystic fibrosis // Cell. 1993. Vol. 73, № 7. P. 1251–1254.
- Ruan Y., Liu N., Priori S.G. Sodium channel mutations and arrhythmias // Nat. Rev. Cardiol. 2009. Vol. 6, № 5. P. 337–348.
- Giudicessi J.R., Ackerman M.J. Potassium-channel mutations and cardiac arrhythmias — Diagnosis and therapy // Nat. Rev. Cardiol. Nature Publishing Group, 2012. Vol. 9, № 6. P. 319–332.
- Thomas R.C. Electrogenic sodium pump in nerve and muscle cells // Am. J. Physiol. 1972. Vol. 52, № 3. P. 563–594.
- Morth J.P. et al. Crystal structure of the sodium-potassium pump // Nature. 2007. Vol. 450, № 7172. P. 1043–1049.
- Lodish H. et al. Molecular Cell Biology (5th edition) // Biochemistry and Molecular Biology Education. 2003.
- Scheel O. et al. Voltage-dependent electrogenic chloride/proton exchange by endosomal CLC proteins // Nature. 2005. Vol. 436, № 7049. P. 424–427.
- Artigas P., Gadsby D.C. Ouabain affinity determining residues lie close to the Na/K pump ion pathway. // Proc. Natl. Acad. Sci. U. S. A. 2006. Vol. 103, № 33. P. 12613–12618.
- Li, C., Ramjeesingh, M., Wang, W., Garami, E., Hewryk, M., Lee, D., Rommens, J. M., Galley, K., Bear, C. E. ATPase Activity of the Cystic Fibrosis Transmembrane Conductance Regulator // Journal of Biological Chemistry. 1996. № 45 (271). P. 28463–28468.
- Martineau M. et al. VGLUT1 functions as a glutamate/proton exchanger with chloride channel activity in hippocampal glutamatergic synapses // Nat. Commun. Springer US, 2017. Vol. 8, № 1.
- Ling G., Gerard R.W. The normal membrane potential of frog sartorius fibers // J. Cell. Comp. Physiol. Wiley-Blackwell, 1949. Vol. 34, № 3. P. 383–396.
- Hodgkin A.L., Huxley A.F. Action potentials recorded from inside a nerve fibre // Nature. 1939. Vol. 144. P. 710–711.
- Cole K.S., Curtis H.J. Electric Impedance of the Squid Giant Axon During Activity // J. Gen. Physiol. 1939. Vol. 22, № 5. P. 649–670.
- Cole K.S. Mostly membranes // Annu. Rev. Physiol. 1979. Vol. 41, № 1. P. 1–24.
- Kandel E.R. et al. Principles of Neural Science. Fifth Edit. The McGraw-Hill Companies, Inc., 2013. 1709 p.
- Hodgkin A.L., Huxley A.F. A quantitative description of membrane current and its application to conduction and excitation in nerve // J. Physiol. 1952. Vol. 117. P. 500–544.
- Capes D.L. et al. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels // J. Gen. Physiol. 2013. Vol. 142, № 2. P. 101–112.
- http://www.physiologyweb.com/lecture_notes/neuronal_action_potential/neuronal_action_potential_na_and_k_concentrations_do_not_change_during_an_action_potential.html
- Bygrave F.L., Benedetti A. What is the concentration of calcium ions in the endoplasmic reticulum? // Cell Calcium. Churchill Livingstone, 1996. Vol. 19, № 6. P. 547–551.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Медицинская реабилитация
4. Мембранные механизмы возникновения и проведения электрических сигналов
4.1. Концентрационный и электрический градиенты
Для того, чтобы понять, как и почему возникает возбуждение в нервных или мышечных клетках, необходимо прежде всего, уяснить основные правила обмена веществами между клеткой и окружающей её средой, поскольку ионы и небольшие молекулы одновременно растворены в водной среде клетки и во внеклеточном пространстве, где их концентрация отличается от внутриклеточной. В среде биологов иногда говорят, что для исследования любой биологической проблемы Бог создал идеальный организм. Эксперименты, положенные в основу мембранной теории, были проведены в 40-х годах ХХ века на гигантских аксонах кальмара.
Диаметр этих аксонов достигает 1 мм, их можно увидеть даже невооружённым глазом, в них легко вводить электроды, чтобы исследовать возникновение электрических сигналов – потенциалов действия. Именно на таком объекте работали основоположники мембранной теории, британские физиологи Алан Ходжкин и Эндрю Хаксли (Hodgkin A., Huxley A.), лауреаты Нобелевской премии 1963 года. Цитоплазма гигантских аксонов кальмара отличается от окружающей внеклеточной жидкости по концентрации некоторых ионов (Таблица 4.1).
Равновесный потенциал – такое значение трансмембранной разности электрических зарядов, при котором ток ионов в клетку и из неё становится одинаковым, т.е. фактически ионы не перемещаются.
Как видно из таблицы, концентрация ионов калия внутри клетки намного больше, чем во внеклеточной жидкости, а концентрация ионов натрия и хлора, напротив, значительно больше во внеклеточной жидкости. Органические анионы представляют собой крупные молекулы, которые не проходят через клеточную мембрану.
Корректно или нет делать какие-либо выводы о мембранах клеток теплокровных животных, тем более человека, изучая нервные клетки кальмара? Сравним их гигантские аксоны, например, с мышечными клетками теплокровных (Таблица 4.2).
Результаты измерений концентраций ионов в разных клетках животных, относящихся к разным видам, дают, разумеется и разные значения этих концентраций, но общим для всех клеток, у всех видов животных является одно: концентрация ионов калия всегда больше в клетке, а концентрация ионов натрия и хлора – во внеклеточной жидкости.
Эта разница концентраций или концентрационный градиент является движущей силой для диффузии растворённых ионов в область меньшей концентрации или, в соответствии со вторым законом термодинамики, – к меньшему энергетическому уровню. Ещё раз взглянув на представленные в таблицах цифры, можно безошибочно предсказать, что катионы натрия должны диффундировать в клетку, а катионы калия – из неё.
Однако не всё так просто, поскольку надо учесть и проницаемость клеточной мембраны для различных ионов, а она изменяется в зависимости от состояния активности клетки. В покое у плазматической мембраны открыты лишь ионные каналы для калия, через которые не могут проходить другие ионы. Значит ли это, что через мембрану покоящейся клетки ионы калия могут выходить беспрепятственно?
Выходя из клетки, катионы калия уменьшают в ней количество положительных зарядов и одновременно увеличивают их количество на наружной поверхности мембраны. Остающиеся в клетке органические анионы начинают ограничивать дальнейший выход катионов калия, поскольку между анионами внутренней поверхности мембраны и катионами её наружной поверхности возникает электрическое поле и появляется электростатическое притяжение. Сама же клеточная мембрана оказывается поляризованной: на наружной её поверхности группируются положительные заряды, на внутренней – отрицательные.
Таким образом, если мембрана готова пропустить какие-либо ионы, то направление ионного тока будут определять два обстоятельства: концентрационный градиент и действие электрического поля, причём концентрационный градиент может направлять ионы в одном направлении, а электрическое поле – в другом. Когда эти две силы уравновешиваются, ток ионов практически прекращается, поскольку количество входящих в клетку ионов становится равным количеству выходящих. Это состояние называется равновесным потенциалом (Е), а его значение можно вычислить с помощью уравнения Нернста (Nernst W., 1888):
где R – газовая постоянная, Т – абсолютная температура (310 при температуре тела), z – валентность иона (для калия = 1), F – константа Фарадея, [K ]a – концентрация ионов калия вне клетки, [K]i – концентрация ионов калия в клетке.
Если подставить в уравнение значение констант и концентрацию ионов, то равновесный потенциал мембраны аксона кальмара для ионов калия окажется равным – 75 мВ (для мышечной мембраны теплокровных – -97 мВ). Это означает, что при такой трансмембранной разности потенциалов и при таких значениях внутри- и внеклеточной концентрации ионов калия их ток из клетки становится равным току в клетку. Если трансмембранная разность потенциалов сделается меньше, то ионы калия станут выходить из клетки до тех пор, пока не восстановится значение равновесного потенциала.
У находящихся в состоянии покоя клеток глии мембрана пропускает только ионы калия, поэтому реальная трансмембранная разность потенциалов у них совпадает с расчётной, т.е. со значением равновесного потенциала для калия – 75 мВ. Но у большинства нейронов дело обстоит иначе, поскольку их мембрана в покое пропускает не только ионы калия, но в небольшом количестве и ионы натрия и хлора. В связи с этим трансмембранная разность потенциалов оказывается несколько меньше, чем равновесный калиевый потенциал, но незначительно, так как проницаемость для ионов калия в покое намного выше, чем для ионов натрия и хлора.
Пользуясь уравнением Нернста нетрудно найти значение равновесных потенциалов для любых ионов (для натрия и хлора они приводятся в таблице 1). Равновесный потенциал для натрия равен + 55 мВ, а его концентрация во внеклеточной среде намного больше, чем в клетке; и то, и другое побуждает ионы натрия входить в клетку. Но в состоянии покоя клеточная мембрана не даёт им такой возможности: её проницаемость для ионов натрия крайне мала.
4.2. Активный транспорт
Диффузия ионов должна уменьшать концентрационный градиент, но концентрационное равновесие означало бы для клетки гибель. Не случайно она более 1/3 своих энергетических ресурсов тратит на поддержание градиентов, на сохранение ионной асимметрии. Перенос ионов через клеточную мембрану против концентрационных градиентов является активным, т.е. энергозатратным видом транспорта, его обеспечивает натрий-калиевый насос.
Это большой интегральный белок клеточной мембраны, который непрерывно выносит из клетки ионы натрия и одновременно закачивает в неё ионы калия. Этот белок обладает свойствами АТФ-азы, фермента, расщепляющего АТФ на внутренней поверхности мембраны, там же белок присоединяет три иона натрия. Освободившаяся при расщеплении молекулы АТФ энергия используется для фосфорилирования определённых участков белка-насоса, после которого меняется конформация белка и он выносит три иона натрия из клетки, но одновременно забирает снаружи и вносит в клетку два иона калия (Рис. 4.1).
Таким образом, за один цикл работы насоса выносятся из клетки три иона натрия, вносятся в неё два иона калия, а на эту работу тратится энергия одной молекулы АТФ. Именно так поддерживается высокая концентрация калия в клетке, а натрия – во внеклеточном пространстве. Если учесть, что и натрий, и калий являются катионами, т.е. несут положительные заряды, то суммарным итогом одного цикла работы насоса для распределения электрических зарядов является удаление одного положительного заряда из клетки. В результате такой деятельности мембрана становится чуть более отрицательной изнутри и поэтому натрий-калиевый насос можно считать электрогенным.
За 1 секунду насос способен вынести из клетки около 200 ионов натрия и одновременно перенести в клетку приблизительно 130 ионов калия, а на одном квадратном микрометре мембранной поверхности может разместиться 100- 200 таких насосов. Кроме натрия и калия насос переносит в клетку против концентрационных градиентов глюкозу и аминокислоты; этот, как бы попутный транспорт, получил название: симпорт. Производительность натрий-калиевого насоса зависит от концентрации в клетке ионов натрия: чем больше она, тем быстрее работает насос. Если же концентрация ионов натрия в клетке понизится, то и насос уменьшит свою деятельность.
Наряду с натрий-калиевым насосом в клеточной мембране существуют специальные насосы для ионов кальция. Они тоже используют энергию АТФ для выноса ионов кальция из клетки, в результате создаётся значительный концентрационный градиент кальция: вне клетки его значительно больше, чем в клетке. Это заставляет ионы кальция постоянно стремиться войти в клетку, но в состоянии покоя клеточная мембрана эти ионы почти не пропускает. Однако порой мембрана раскрывает каналы для этих ионов и тогда они играют очень важную роль в освобождении медиаторов или в активации некоторых ферментов.
Таким образом, активный транспорт создаёт концентрационные и электрические градиенты, которые играют выдающуюся роль во всей жизни клетки.
4.3. Пассивный транспорт – диффузия
Создаваемые работой насосов градиенты дают ионам возможность перемещаться через мембрану от большего энергетического уровня к меньшему путём диффузии, если, конечно, есть открытые ионные каналы. Такой канал – это крупномолекулярный интегральный белок, молекула которого проходит через двойной слой мембранных липидов. В этой молекуле есть заполненная водой пора, диаметр которой не превышает 1 нм. Через такое отверстие способны пройти только ионы калия (Рис. 4.2).
Радиус иона калия – 0,133 нм, у иона натрия он даже меньше – 0, 098 нм, тем не менее, через постоянно открытые каналы может проходить лишь калий. Дело в том, что истинные размеры иона определяются толщиной его гидратной оболочки, которой в водном растворе покрываются все ионы. Молекулы воды ведут себя как диполи: электроны их атомов кислорода сильнее, чем у атомов водорода, а значит кислород несёт слабый отрицательный заряд. Именно поэтому молекулы воды притягиваются положительными зарядами катионов калия, натрия и кальция. Но, поскольку у атомов водорода в молекуле воды есть слабый положительный заряд, существует притяжение водных молекул и к анионам хлора.
При меньшем ионном радиусе электрическое поле у иона натрия сильнее, чем у калия, а потому гидратная оболочка у него толще. Она и не позволяет ионам натрия проходить через каналы, оказывающиеся доступными для прохождения одного лишь калия. Вот почему в состоянии покоя клеточной мембраны через неё происходит ток преимущественно одной разновидности ионов – калия, постоянно уходящего из клетки по концентрационному градиенту.
4.4. Управляемые каналы
Только что описанные каналы, через которые проходят ионы калия, открыты всегда: и в состоянии покоя, и при возбуждении клетки – они мало зависят от внешних условий и поэтому являются каналами пассивного типа. В противоположность этому существуют управляемые ионные каналы, большинство из которых в состоянии покоя клетки закрыты, а для того, чтобы их открыть, необходимо каким-то образом на них подействовать. Следовательно, такие каналы являются управляемыми, а в зависимости от способа управления их подразделяют на три типа:
1) потенциалзависимые;
2) хемозависимые;
3) управляемые механически.
Устройство, с помощью которого открываются или закрываются каналы, часто называют воротным механизмом или даже воротами, хотя такое сравнение не вполне корректно. Современные представления об ионных каналах сложились в связи с двумя методическими подходами к их изучению. Во-первых, это метод локальной фиксации (англ. patch clamp), позволяющий наблюдать ток ионов через одиночный канал. Эту технику изобрели в конце 70-х годов Эрвин Неер и Берт Закман (Neher E., Sakmann B.), лауреаты Нобелевской премии 1991 года. Во-вторых, пониманию свойств каналов способствовало построение их моделей на основе расшифрованного генетического кода многих канальных белков и установленной в связи с этим аминокислотной последовательностью молекул.
Каждый канал образован несколькими белковыми субъединицами (Рис. 4.3), которые представляют собой длинные цепи аминокислот, скрученных в a-спираль. Форма a-спирали может меняться, например, в связи с изменением трансмембранной разности потенциалов (что исключительно важно для потенциалзависимых каналов).
Изменение формы a-спирали приводит к перемещению аминокислот, в том числе несущих электрический заряд. В результате заряды таких аминокислот, как лизин или аргинин, могут оказаться во внутренней стенке ионного канала и сделать её гидрофильной: тогда покрытые гидратной оболочкой ионы смогут проходить через канал. Возвращение альфа-спирали к прежней форме приводит к тому, что во внутренней стенке канала снова оказываются гидрофобные участки и поэтому ток ионов прекращается.
В образовании разных типов каналов участвуют от двух до семи субъединиц, белковая цепь каждой субъединицы несколько раз пересекает клеточную мембрану, причём каждая область пересечения выполняет определённую задачу: одни образуют стенки канала, другие служат датчиками изменений электрического поля, третьи, выступающие за наружную сторону мембраны, являются рецепторами, четвёртые объединяют канал с цитоскелетом.
Потенциалзависимые каналы открываются или закрываются в связи с определёнными изменениями мембранного потенциала. Например, натриевые каналы в состоянии покоя закрыты, но, если мембранный потенциал уменьшится до критического значения, они открываются. Если деполяризация продолжится до положительного значения мембранного потенциала (т.е. на внутренней части мембраны окажется больше положительных зарядов, чем на наружной), то каналы закроются.
Хемозависимые каналы открываются вследствие присоединения нейромедиатора к выступающей наружу гликопротеиновой рецепторной области канального белка – такой тип каналов используется в синапсах (Рис. 4.4). Механически управляемые каналы характерны для чувствительных окончаний нейронов, реагирующих на растяжение и давление. Эти каналы особым способом связаны с цитоскелетом, что и приводит их к открытию при деформации клетки.
Сам момент открытия канала – всего лишь мгновение, длящееся миллионные доли секунды. Но и в открытом состоянии каналы находятся недолго – лишь несколько миллисекунд, после чего стремительно закрываются. Однако пропускная способность открытого канала поразительна: ток ионов происходит со скоростью до 100 000 000 ионов/с, что можно сравнить только с деятельностью самых «быстрых» ферментов, как, например, карбоангидраза, катализирующая образование и дегидратацию углекислоты в эритроцитах крови.
Кроме открытого и закрытого конформационных состояний каналы могут стать инактивированными: это значит, что они закрыты, но не подчиняются, как обычно, действию механизмов управления и не открываются. Состояние инактивации наблюдается немедленно после закрытия каналов, продолжается несколько мс и контролируется особыми субъединицами или особыми регионами белковой молекулы. Во время инактивации каналов клетка перестаёт отвечать на возбуждающие её стимулы, что определяется термином рефрактерность, т.е. временная невозбудимость.
Ионные каналы имеются в мембране любой клетки организма, но в мышечных и особенно в нервных клетках их плотность намного больше, чем в клетках других тканей. В нейронах, кроме высокой плотности каналов, обнаружено и их большое разнообразие. Это не случайно, поскольку именно каналы определяют условия возникновения электрических сигналов, характер самих сигналов, скорость их проведения и т.п., что собственно и позволяет нейронам выполнять свою главную задачу: принимать, перерабатывать и передавать информацию.
4.5. Блокаторы ионных каналов
Существует довольно много веществ, способных обратимо или необратимо связываться с молекулами канальных белков и, тем самым, блокировать их, т.е. выводить из подчинения управляющим механизмам. Блокированные каналы чаще всего оказываются закрытыми, хотя в некоторых случаях фиксируется открытое положение канала.
Блокировать каналы способны многие из давно известных ядов животного или растительного происхождения. Так, например, во внутренностях некоторых сростночелюстных рыб (Tetrodontiformes) содержится тетродотоксин, блокирующий натриевые каналы. К этому отряду относится печально знаменитая рыба фугу, унёсшая жизни немалого количества гурманов, а также плавающая в водах залива Петра Великого собака-рыба, способная раздуваться и издавать при этом довольно громкие звуки. Тетродотоксин достаточно давно применяется в экспериментальной практике, связанной с исследованием мембранной проницаемости.
Натриевые каналы может блокировать и другой животный яд – батрахотоксин, который содержится в слизи некоторых южноамериканских лягушек, например, пятнистого древолаза. Этим ядом индейцы отравляли свои стрелы, хотя и не догадывались, что батрахотоксин блокирует натриевые каналы, а такая блокада не позволяет нервным клеткам возбуждаться.
Другие южноамериканские индейцы готовили отравленные стрелы с помощью другого яда, растительного – это древесный сок кураре, добываемый из некоторых видов лиан. Яд кураре избирательно блокирует хемозависимые каналы нервно-мышечных синапсов. Эти же синапсы необратимо блокирует змеиный яд альфа-бунгаротоксин, который выделяют при укусе бунгары, они же крайты – близкие родственники кобр.
Вещество искусственного происхождения – тетраэтиламмоний специфически блокирует калиевые каналы; его часто использовали в экспериментальной практике. А в медицине применяют многие лекарственные вещества, точкой приложения которых являются ионные каналы: с помощью таких веществ можно управлять определёнными ионными каналами и тем самым влиять на активность нейронов.
4.6. Мембранный потенциал покоя
В покое на наружной стороне плазматической мембраны располагается тонкий слой положительных зарядов, а на внутренней стороне – отрицательных. Электрический заряд наружной поверхности принято считать нулевым, поэтому трансмембранная разность потенциалов или мембранный потенциал покоя имеет отрицательное значение. В типичном для большинства нейронов случае потенциал покоя равен приблизительно -60 – -70 мВ.
Техника прямого измерения потенциала покоя была создана в конце 40-х годов ХХ века. Был изготовлен специальный измерительный электрод: тонкий стеклянный капилляр с оттянутым кончиком диаметром не более 1 мкм и заполненный проводящим электрический ток солевым раствором (3М КСl). который не изменяет внутренний заряд мембраны. В этот раствор с широкого конца капилляра вставляли металлический проводник, а тонким концом протыкали клеточную мембрану. Второй электрод представлял собой хлорированную серебряную пластинку и помещался во внешнюю среду; использовались усилитель слабых электрических сигналов и гальванометр (Рис. 4.5). Объектом исследования был гигантский аксон кальмара, именно на нём удалось получить данные, послужившие основой для мембранной теории (Hodgkin Huxley).
Как же возникает мембранный потенциал покоя? Прежде, чем ответить на этот вопрос, следует ещё раз напомнить, что работой натрий-калиевого насоса в клетке создаётся высокая концентрация ионов калия, а в клеточной мембране для этих ионов есть открытые каналы. Выходящие из клетки по концентрационному градиенту ионы калия увеличивают количество положительных зарядов на наружной поверхности мембраны. В клетке много крупномолекулярных органических анионов и потому изнутри мембрана оказывается заряженной отрицательно. Все остальные ионы могут проходить через покоящуюся мембрану в очень небольшом количестве, их каналы, в основном, закрыты. Следовательно, потенциал покоя обязан своим происхождением, главным образом, току ионов калия из клетки.
Это заключение достаточно просто проверить экспериментально. Если, например, искусственно повысить концентрацию ионов калия вокруг клетки, то их ток из клетки уменьшится или даже вовсе прекратится, поскольку уменьшится концентрационный градиент – движущая сила для этого тока. И тогда начнёт уменьшаться потенциал покоя, он может сделаться равным нулю, если концентрация калия по обе стороны мембраны окажется одинаковой. Есть ещё одна возможность доказать калиевую природу потенциала покоя. Если блокировать калиевые каналы тетраэтиламмонием, то ток ионов калия прекратится, а вслед за этим начнёт уменьшаться потенциал покоя.
Мембрана находящейся в покое клетки пропускает в небольшом количестве ионы натрия и хлора. Две силы гонят ионы натрия в клетку: высокая наружная концентрация и электроотрицательная внутренняя среда клетки. Даже небольшое количество вошедшего в клетку натрия приводит к деполяризации мембраны – уменьшению потенциала покоя. Ионам хлора попасть в клетку труднее, поскольку их отталкивает электроотрицательный слой зарядов на внутренней поверхности мембраны, а значение равновесного потенциала хлора -60 мВ мало отличается от нормальной величины потенциала покоя. Связь между избирательной проницаемостью мембраны для каждого из трёх видов ионов и их концентрациями описывает уравнение Гольдмана:
где Е m – значение мембранного потенциала, Р – проницаемость мембраны, зависящая от её толщины и подвижности в ней иона, a – концентрация иона снаружи, i – концентрация его изнутри, R, T и F имеют то же значение, что и в уравнении Нернста.
Из этого уравнения следует, что реальное значение потенциала покоя (Еm = – 65 мВ) является компромиссным между равновесными потенциалами калия (- 75 мВ), натрия (+ 55 мВ) и хлора (- 60 мВ). Нетрудно предсказать, что повышение проницаемости мембраны для натрия приведёт к деполяризации, а увеличение её проницаемости для хлора – к гиперполяризации.
Если принять за 1 проницаемость мембраны в покое для ионов калия, то проницаемость её для ионов натрия составит 0,04, а для хлора – 0,45. Но при возбуждении мембраны это соотношение изменяется и на вершине пика потенциала действия составляет 1(К) : 20 (Na) : 0,45 (Cl).
4.7. Потенциал действия
Уравнение Гольдмана позволяет вычислить значение мембранного потенциала покоя, если известна концентрация ионов внутри клетки и снаружи, а также проницаемость для этих ионов. Реальная величина мембранного потенциала покоя ближе всего к значению равновесного потенциала для ионов калия, которые проходят через постоянно открытые для них каналы. Ситуация решительно изменяется при раздражении клетки, когда повышается натриевая проницаемость и появляется деполяризующий рецепторный потенциал или постсинаптический потенциал.
Потенциал действия возникает лишь при определённой величине деполяризующего сдвига, например, с -65 мВ до -55 мВ. Если деполяризация будет меньше, то потенциал действия не возникнет: такие деполяризующие сдвиги называются подпороговыми. Приведённые здесь цифры относительны, в разных клетках они могут быть меньше или больше, но всегда наименьший деполяризующий сдвиг, который вызовет появление потенциала действия, определяется, как пороговый.
Возникновение рецепторного или постсинаптического потенциалов связано со сравнительно небольшим местным повышением натриевой проницаемости мембраны. Вход ионов натрия в клетку и обусловленная этим местная деполяризация приводят к возникновению локального электрического тока. Его распространению вдоль мембраны препятствует электрическое сопротивление самой мембраны, поэтому начавшаяся в каком-нибудь месте пассивная деполяризация не может распространяться далеко – пассивные электрические ответы всегда локальны.
Но, если сумма локальных деполяризующих сдвигов всё-таки сможет деполяризовать мембрану триггерной зоны нейрона до критического уровня, до порогового значения, то произойдёт активный и максимальный ответ клетки по правилу «всё или ничего». Деполяризация до критического значения ведёт к конформационным изменениям внутренней стенки натриевых каналов и перемещению полярных аминокислот. Вследствие этого открывается пора диаметром 0,3 – 0,5 нм через которую могут пройти катионы натрия (См. рис. 4.3). Ток анионов через этот канал невозможен, поскольку его устье содержит отрицательные заряды карбоксильных групп глутаминовой кислоты, которые отталкивают отрицательные заряды анионов.
Равновесный потенциал натрия +55 мВ, а каналы для него открываются при значении мембранного потенциала -55 мВ, поэтому ионы натрия поступают в клетку с высокой скоростью: до 107 ионов/с через одиночный канал. Плотность натриевых каналов варьирует от 1 до 50 на одном квадратном микрометре. В результате этого за 0,2 – 0, 5 мс значение мембранного потенциала из отрицательного (-55 мВ) становится положительным (около +30 мВ), хотя и не достигает значения равновесного натриевого потенциала.
Такая стремительная деполяризация является саморегенерирующей: чем больше входит натрия в клетку и чем больше сдвиг мембранного потенциала, тем больше открывается натриевых каналов и тогда ещё больше натрия входит в клетку:
По мере приближения величины мембранного потенциала к значению равновесного натриевого потенциала движущая сила для ионов натрия слабеет, но одновременно растёт движущая сила, заставляющая выходить из клетки ионы калия, каналы для которых постоянно открыты. Когда мембранный потенциал становится положительным, натриевые потенциалзависимые каналы закрываются, а ток калия из клетки резко увеличивается. В связи с этим происходит реполяризация, т.е. восстановление первоначального значения мембранного потенциала (иногда выходной ток калия приводит даже к кратковременной следовой гиперполяризации). Две фазы потенциала действия – деполяризация и реполяризация образуют пик или спайк потенциала действия (Рис. 4.6).
Само открытие натриевых каналов происходит необычайно быстро, в течение не более, чем 10 микросекунд (т.е. миллионных долей секунды), открытыми они остаются несколько миллисекунд, затем быстро закрываются, причём на некоторое время конформация канального белка становится такой, что его невозможно активировать, а значит и открыть каналы. Это состояние называется рефрактерностью, около 1 мс она абсолютна, а затем относительна: при абсолютной рефрактерности нельзя открыть каналы никаким действием, при относительной их нельзя активировать пороговой деполяризацией, но можно надпороговой.
Общая продолжительность рефрактерного состояния определяет максимальную частоту возбуждения нейрона. Например, если рефрактерный период продолжается 2 мс, то за 1с нейрон может возбуждаться максимум 500 раз (1 с = 1000 мс: 2мс = 500). Некоторые нейроны могут возбуждаться чаще, чем 500/с, другие – реже: в соответствии с этим первые можно назвать более лабильными, чем вторые. Проблему лабильности или функциональной подвижности клеток в конце XIX – начале ХХ века исследовал российский физиолог Н.Е.Введенский, он же ввёл в употребление понятие о мере лабильности, как о наибольшем числе электрических осцилляций, которое может воспроизвести за секунду нерв или мышца. Так, например, нерв, по данным Введенского, способен возбуждаться до 500/с, а мышца – лишь до 200/с, т.е. нерв является более лабильным объектом, чем мышца.
4.8. Механизм проведения потенциалов действия
Чем более сложные задачи решает мозг, тем большее количество нейронов ему необходимо. Однако вся масса нейронов должна поместиться в ограниченном черепом и позвоночным каналом пространстве, а потому нервные клетки должны быть небольшими, а их отростки – достаточно тонкими. Но, как известно, чем тоньше и длиннее проводник, тем большее сопротивление он окажет распространяющемуся по нему току. Действующее напряжение в нейроне (V) не может быть больше, чем амплитуда потенциала действия, т.е приблизительно 100-120 мВ, а ток (I), согласно закону Ома, прямо пропорционален напряжению и обратно пропорционален сопротивлению: I = V/R
Из этого следует, что потенциал действия обычным для проведения электричества способом не может распространяться далеко. Очень тонкая мембрана аксона, окруженная электропроводной средой, имеет очень высокую ёмкость, что тормозит распространение электрического сигнала. Если сказать проще: тонкий цитоплазматический отросток – это очень плохой проводник. Но, несмотря на это, потенциалы действия распространяются по аксону с высокой скоростью, достигающей 100 м/с. Как это происходит?
Когда в возбуждённом участке мембраны повышается натриевая проницаемость и возникает потенциал действия, начинается электротоническое распространение положительных зарядов к невозбуждённому участку – этот процесс представляет собой круговой ток (Рис. 4.7). Такой ток деполяризует ещё не возбуждавшийся соседний участок, а когда эта деполяризация достигнет порога – возникнет потенциал действия. Теперь уже этот участок становится источником кругового тока, действующего на следующую область мембраны, теперь уже в этой области возникнет потенциал действия, все параметры которого будут стандартными для данного типа нейрона.
Вслед за повышением натриевой проницаемости в процессе формирования потенциала действия усиливается ток калия из клетки. Вместе с калием из клетки уходят положительные заряды и восстанавливается прежнее значение мембранного потенциала. При любой длине аксона амплитуда потенциалов действия повсюду оказывается неизменной, поскольку в каждом отдельном участке аксона они формируется фактически заново. В физиологическом смысле это важно потому, что постоянство сигнала означает передачу информации по аксону без искажений.
В миелинизированных аксонах круговой ток распространяется к соседнему перехвату, где и возникает потенциал действия. Плотность натриевых каналов в перехватах Ранвье гораздо выше, чем в обычной немиелинизированной мембране и пришедший сюда электротонически круговой ток легко деполяризует перехват до порогового значения. Появившийся вследствие этого потенциал действия служит источником кругового тока для следующего перехвата.
Проведение возбуждения в нерве или мышце можно зарегистрировать с помощью внеклеточных электродов, приложенных к двум различным точкам их поверхности и соединённым с регистрирующей аппаратурой. При распространении потенциала действия мембрана поочерёдно деполяризуется сначала под ближним к источнику возбуждения электродом, а затем – под дальним. И в том, и в другом случае между электродами регистрируется разность потенциалов, поскольку один из них будет находиться на деполяризованном, а значит электроотрицательном снаружи мембраны участке, а второй – в интактной электроположительной точке, где возбуждение ещё не началось, либо уже закончилось.
Регистрация проходящих по мембране потенциалов действия с помощью двух электродов называется биполярной. При таком способе регистрируются две фазы потенциала действия: положительная и отрицательная. Если расположенный под одним из электродов участок сделать невозбудимым (для этого можно подействовать на него каким-либо анестезирующим веществом, например, новокаином), то останется только одна фаза потенциала действия. Такое отведение называется униполярным (или монополярным).
При некоторых аутоиммунных и вирусных заболеваниях миелиновая оболочка разрушается, что приводит к многочисленным неврологическим нарушениям, вплоть до полной утраты некоторых функций; при этом может нарушаться и эмоциональная деятельность, и интеллект. Примером демиелинизирующих заболеваний может служить рассеянный склероз.
Резюме
Возникновение электрических сигналов связано со свойствами клеточной мембраны. Мембранные насосы создают концентрационные градиенты ионов. Открытые в покое ионные каналы для калия позволяют ему выходить из клетки и, тем самым, создавать мембранный потенциал покоя, близкий к равновесному потенциалу для калия. В случае его уменьшения до порогового значения открываются потенциалзависимые каналы для натрия и происходит саморегенерирующая деполяризация, значение мембранного потенциала становится положительным, Это вызывает закрытие натриевых каналов, которые на время инактивируются. Выходящий ток ионов калия восстанавливает прежнее значение мембранного потенциала. Возникновение потенциала действия вызывает появление кругового электрического тока, который деполяризует соседний участок мембраны до порогового значения. В связи с этим потенциал действия распространяется по аксону без уменьшения амплитуды.
Вопросы для самоконтроля
46. Концентрация каких ионов в клетке значительно больше, чем во внеклеточной жидкости?
А. Натрия; Б. Калия; В. Кальция; Г. Хлора; Д. Магния.
47. Какие ионные каналы при физиологическом покое клетки открыты?
А. Для всех катионов; Б. Для анионов; В. Для натрия; Г. Для калия; В. Для кальция.
48. Какова величина равновесного потенциала мембраны гигантского аксона кальмара для ионов калия?
А. +55 мВ; Б. +25-30 мВ; В. = 0; Г. -60 мВ; Д. -75 мВ.
49. Почему натрий-калиевый насос считается электрогенным?
А. Он расходует энергию АТФ; Б. Он создаёт концентрационный градиент калия; В. Он выносит из клетки натрий; Г. За один цикл он удаляет из клетки положительный заряд; Д. Он обеспечивает симпорт глюкозы и аминокислот.
50. Вхождению в клетку каких ионов препятствует электрическое поле между внутренней и наружной поверхностями мембраны?
А. Калия; Б. Натрия; В. Хлора; Г. Кальция; Д. Всех катионов.
51. Через каналы какого типа диффундируют ионы калия, когда клетка находится в состоянии физиологического покоя?
А. Потенциалзависимые; Б. Хемозависимые; В. Потенциалзависимые и хемозависимые; Г. Управляемые механически; Д. Пассивные.
52. Что из перечисленного ниже характерно для состояния рефрактерности?
А. Активированное состояние потенциалзависимых каналов; Б. Инактивированное состояние потенциалзависимых каналов; В. Открытое состояние потенциалзависимых каналов; Г. Закрытое состояние потенциалзависимых каналов; Д. Увеличение пропускной способности потенциалзависимых каналов.
53. Какое из перечисленных ниже веществ является блокатором ионных каналов для калия?
А. Тетраэтиламмоний; Б. Тетродотоксин; В. Батрахотоксин; Г. Кураре; Д. a-Бунгаротоксин.
54. Каким должен быть наименьший деполяризующий сдвиг, если мембранный потенциал равен -69 мВ, а критический уровень деполяризации – -56 мВ?
А. 6 мВ; Б. 9 мВ; В. 11 мВ; Г. 13 мВ; Д. 15 мВ.
55. Если рефрактерный период нейрона продолжается 3 мс, то с какой максимальной частотой он может возбуждаться?
А. 555 Гц; Б. 444 Гц; В. 333 Гц; Г. 222 Гц; Д. 111 Гц.
56. Для какого перемещения ионов через клеточную мембрану, находящейся в покое клетки, необходима энергия?
А. Кальция в клетку; Б. Натрия в клетку; В. Хлора в клетку; Г. Калия из клетки; Д. Кальция из клетки.
57. Какое перемещение ионов происходит только путём диффузии?
А. Натрия из клетки; Б. Калия из клетки; В. Кальция из клетки; Г. Калия в клетку; Д. Глюкозы в клетку.
58. Что заставляет закрыться открывающиеся при возбуждении потенциалзависимые каналы для натрия?
А. Процесс реполяризации; Б. Восстановление исходного значения мембранного потенциала; В. Установление положительного значения мембранного потенциала; Г. Достижение критического уровня деполяризации; Д. Возникновение гиперполяризации.
59. К каким последствиям должно привести повышение мембранной проницаемости для хлора при реальном значении мембранного потенциала -55 мВ?
А. Уменьшение мембранного потенциала; Б. Гиперполяризация; В. Деполяризация; Г. Значение мембранного потенциала не изменится; Д. Возникнет потенциал действия.
60. Каждый потенциал действия образуют две, последовательно сменяющие друг друга фазы – это:
А. Гиперполяризация-деполяризация; Б. Деполяризация-реполяризация; В. Гиперполяризация-реполяризация; Г. Реполяризация- деполяризация; Д. Реполяризация – восстановление первоначального значения мембранного потенциала.
The squid giant axon, which is part of a circuit used for rapid propulsion in the escape response, is as large as 1mm in diameter, conducts at 25ms−1 (at 25°C), and is formed by the fusion of axons of many neurons.
From: Encyclopedia of Neuroscience, 2009
Membrane Potential and Action Potential
David A. McCormick, in From Molecules to Networks (Third Edition), 2014
The membrane of the squid giant axon, at rest, is most permeable to K+ ions, less so to Cl−, and least permeable to Na+. (Chloride appears to contribute considerably less to the determination of the resting potential of mammalian neurons.) These results indicate that the resting membrane potential is determined by the resting permeability of the membrane to K+, Na+, and Cl−. In theory, this resting membrane potential may be anywhere between EK (e.g., −76 mV) and ENa (+55 mV). For the three ions at 20 °C, the equation is
Vm=58.2log{(1·20+0.04·440+0.45·40)/(1·400+0.04·50+0.45·560)}=−62mV.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123971791000129
Chloride Transporters in Presynaptic Inhibition, Pain and Neurogenic Inflammation
Francisco Javier Alvarez-Leefmans, in Physiology and Pathology of Chloride Transporters and Channels in the Nervous System, 2010
IV. NA+-K+-Cl− Cotransporter Expression in Peripheral Axons and Schwann Cells
The pioneering studies of Russell in squid giant axons demonstrated the expression of an NKCC mechanism in these invertebrate unmyelinated fibers (Russell, 2000). The unique stoichiometry of the cephalopode isoform 2Na+:1 K+:3Cl− suggests differences with respect to vertebrate isoforms which have a stoichiometry of 1Na+:1 K+:2Cl− (see Chapter 5 in this volume). Unfortunately, the squid protein has not been cloned and thus it is not possible to have clues on what makes it different at the molecular level from the vertebrate isoforms. Cloning of the squid NKCC protein would be important to further understanding the evolution of the cation-coupled-chloride cotransport proteins family in the animal kingdom. Moreover, determining the amino acid sequence of squid NKCC would shed light on the molecular determinants of different stoichiometries. The function of NKCC in squid axons appears to be related to cell volume regulation. Russell proposed that “NKCC is an essential component in a feedback mechanism designed to maintain cell volume at some constant set-point”. The evidence presented in the previous section (Figs 22.8 and 22.9) in mammalian DRG neurons is fully consistent with this view.
Work originated in our laboratory provided the first description of NKCC in vertebrate myelinated axons and their associated Schwann cells (Alvarez-Leefmans et al., 2001). We used a combined approach including confocal immunofluorescence, three-dimensional reconstructions and electron microscopy. To label NKCC we used T4 monoclonal antibody (Lytle et al., 1995), and to label Schwann cells we used an antibody against the S-100 protein (Pelc et al., 1986). NKCC immunoreactivity was found prominently at the nodes of Ranvier (Fig. 22.11A–C). Immunoreactivity was particularly intense at the nodal and paranodal regions immediately adjacent to the nodal gap (Fig. 22.11A and C). This particular area corresponds to the so-called myelin sheath attachment segment, according to the nomenclature of Berthold and Rydmark (Berthold and Rydmark, 1983). NKCC immunoreactivity was also systematically observed in the outermost membrane region of the paranodal Schwann cell (arrowheads in Fig. 22.11A). In longitudinal sections of nerve fibers, the NKCC immunoreactivity at the nodal–paranodal area appeared as two bands in the nodal gap, perpendicular to the longitudinal axis of the fiber (arrow in Fig. 22.11A). Upon 40° rotation of three-dimensional confocal reconstructions, the immunoreactivity at the nodal–paranodal region revealed that the bands were actually donut-shaped structures surrounding the axon (Fig. 22.11B, arrow pointing to the node of Ranvier). These donut-shaped regions correspond to the well-known collars of Schwann cell cytoplasm which are known to be packed with Schwann cell microvilli (Fig. 22.11D), reminiscent of the brush border membranes of kidney absorptive epithelial cells (Berthold and Rydmark, 1983).
Figure 22.11. NKCC expression at the nodes of Ranvier in cat myelinated sensory fibers. A. Two-dimensional view of a bundle of myelinated axons. The image was reconstructed from 15 optical sections taken at steps of 1 μm on the z-axis. Intense NKCC immunoreactivity is observed in the paranodal region of the nodes of Ranvier, in the incisures of Schmidt-Lanterman (S-L) and in the outer Schwann cell layer (arrowheads). Immunoreactivity was also found in axons (Ax). B. 40° rotation, showing three-dimensional views of immunoreactive regions. In the 40° rotation, the immunoreactivity in the paranodal region appears as a donut-shaped structure surrounding the axon at the node of Ranvier. These donut-shaped structures correspond to the corona of Schwann cell microvilli observed in electron micrographs (D). Immunoreactive Schmidt-Lanterman incisures appear as funnel-shaped structures. C. Double immunolabeling of NKCC (FITC, green) and S-100 immunolabeling of the Schwann cell (colocalization appears in orange). D. Electron micrograph of a cross-section through a nodal axon segment showing a corona of Schwann cell microvilli. Scale bars in B and C are 20 μm. Scale bar in B applies to A. Scale bar in D = 0.5 μm.
Figures A–C are modified from Alvarez-Leefmans et al. (2001) and reproduced with permission. Figure D was modified from Berthold and Rydmark (1983).
Double labeling experiments with S-100 and T4 confirmed that the NKCC immunoreactivity seen at the nodal–paranodal interface was indeed located at the Schwann cell (Fig. 22.11C). Immunoreactivity was clearly observed in the nodal region, in the area corresponding to the collar-shaped structure surrounding the axon, which is formed by Schwann cell cytoplasmic pockets and microvilli. In fibers cut longitudinally as the one shown in Fig. 22.11C, S-100 immunolabeling revealed that the collar seen in the 3D reconstructions (Fig. 22.11B) appeared as a spiny bracelet structure (Fig. 22.11C, Paranode) similar to that described in classical studies (Landon and Hall, 1976; Nageotte, 1922). Double-labeling studies also confirmed that the myelin sheath was immunonegative but the axon was NKCC immunoreactive (Fig. 22.11A). Electron microscopy revealed that the latter immunoreactivity was located in the axoplasm and in the axolemma (Fig. 22.12B). As the axon passes from the end of the paranodal bulb through the collars formed by the Schwann cell, its diameter is abruptly reduced to about one-third of its internodal value (Fig. 22.11C, green). NKCC immunoreactivity in axons appeared with a punctate pattern and was located both in the axoplasm and in the axolemma region.
Figure 22.12. Ultrastructural distribution of NKCC immunoreactivity in rat myelinated axons. A. Ultrastructural features of the node of Ranvier in a DRG axon. At the node, the axon is loosely covered by microvilli-like cytoplasmic protrusions of the Schwann cell. In the paranodal region, pockets of Schwann cell cytoplasm that arise from the opening of the major dense line surround the axon. Material from Epon-Araldite embedding. B. Myelinated axon in which NKCC-immunoreactive sites appear labeled with 10 nm colloidal gold particles. Intense immunoreactivity is found along the axonal plasma membrane (arrowheads), and to a lesser extent in the Schwann cell and in the axoplasm. Membrane-bound organelles like mitochondria (m) are also surrounded by NKCC immunoreactivity. Unicryl embedding, non-osmicated tissue, T4 mAb 1:1000. C. NKCC immunoreactivity in the node of Ranvier is strongly associated with the paranodal regions (arrows), particularly on the membrane of the Schwann cell paranodal pockets. In the axon, immunoreactivity is found along the axonal plasma membrane, including the nodal axolemma (arrowheads), and throughout the axoplasm. Axoplasmic immunoreactivity appears somewhat concentrated in the nodal region. Unicryl embedding, osmicated tissue, T4 mAb 1:1000. Scale bars 0.5 mm (A, B), 1 mm (C).
Reproduced with permission from Alvarez-Leefmans et al. (2001).
Treating the tissue with the reducing agent β-mercapto-ethanol unmasked NKCC immunoreactivity in the incisures of Schmidt-Lanterman (S-L in Fig. 22.11B–C). The latter are inclusions of Schwann cytoplasm within the myelin which pursue a spiral course across the sheath, forming cylindrico-conical segments at the internodes, and so connecting the external and internal layers of Schwann cell cytoplasm (Ghabriel and Allt, 1981; Landon and Hall, 1976), as illustrated in the unrolled Schwann cell in Fig. 22.13A. In 3D rotations, the funnel shape of the NKCC-immunoreactive incisures of Schmidt-Lanterman could be more clearly appreciated (Fig. 22.11B). The longitudinally sectioned Schmidt-Lanterman incisures can also be appreciated in the S-100 and T4 double immunolabeling (Fig. 22.11C).
Figure 22.13. Diagrams showing NKCC location in various elements of a myelinated sensory fiber and the possible functional significance of NKCC in axons and Schwann cells. A. Unrolling of the Schwann cell sheath from an axon. The white areas indicate the presence of Schwann cell cytoplasm. The areas with black points indicate compact myelin. The unrolled sheath shows the transverse and longitudinal Schmidt-Lanterman incisures. Note the nucleus of the Schwann cell in the outer cytoplasmic belt, the microvilli and the terminal cytoplasmic spiral. NKCC immunoreactivity is indicated in red for the Schwann cell and in green for the axon. B. When rolled back around the axon, the terminal cytoplasmic spiral runs around the paranodal attachment segment many times, creating Schwann cell pockets or paranodal loops that, together with microvilli, overhang the paranodal and nodal axon, respectively. When transversally cut, this nodal–paranodal bracelet forms collars surrounding the axon, like the ones shown in Fig. 22.11B and D. C. Functional significance of NKCC in axons and Schwann cells. We propose that NKCC located in the Schwann cell may be involved in periaxonal K+ homeostasis. External K+ ion accumulation occurs in the paranodal areas of the Schwann cell, in particular during repetitive firing. During each action potential, Na+ enters the axon through voltage-gated channels located in the nodal area, and K+ exits the axon via voltage-gated channels located in the nodal–paranodal interface. The preferential location of NKCC in the paranodal areas of the Schwann cell suggests that it could be involved in the uptake of K+ released from the axon and then in siphoning it to areas far away from the periaxonal space, thereby preventing periaxonal K+ accumulation and controlling axonal excitability. Uptake of K+ by the Schwann cell can also occur through inward rectifier K+ channels (IR). The release of K+ taken up by the Schwann cell may occur through delayed rectifier channels (DR) located in the outer membrane, opposite to the periaxonal space. “Tight junctions” (TJ) restrict access to the extracellular spaces within the myelin, and “transverse junctions” (TB) maintain a narrow periaxonal space in the paranodal region. NKCC in axons may be involved in cell volume control and intracellular Cl− regulation and, in conjunction with the Na+/K+ pump, in the reuptake of K+ released during nerve activity.
A and B are reproduced with permission from Alvarez-Leefmans et al. (2001).
The distribution of immunoreactivity in rat myelinated axons was studied ultrastructurally and was found to be very similar to that observed using confocal microscopy in cat myelinated axons (Fig. 22.12). Membrane immunostaining was detected in Schwann cell paranodal pockets and microvilli, and along the axonal membrane at the nodal and paranodal regions (Fig. 22.12B–C). NKCC was found in both the axoplasm and in the membrane region of axons, as well as in three well-defined regions of the Schwann cell: the external surface along the internodal segment (paranode), the nodal–paranodal region (myelin sheath attachment segment) and the incisures of Schmidt-Lanterman. These findings are summarized in Fig. 22.13A and B. The location of NKCC in these structures suggests that it may be playing a role in periaxonal K+ homeostasis. Frankenhaeuser and Hodgkin first suggested that K+ released by axons during activity could be transiently accumulated in the periaxonal space between Schwann cells and axons (Frankenhaeuser and Hodgkin, 1956). Since extracellular K+ has a profound influence on excitability, efficient K+ clearance is critical for nerve function.
It has been suggested that periaxonal K+ is partly regulated by the Schwann cells. Two mechanisms have been proposed: inwardly rectifying K+ channels (Chiu, 1991, 1995) and the Na+/K+ pump (Ransom et al., 2000), both of which are present in the plasma membrane of Schwann cells (Fig. 22.13C). We proposed that NKCC exhibits the kinetic features required for an efficient extracellular K+ buffer, as discussed also in Chapter 5. The immunolocalization of NKCC suggests that NKCC may be another major mechanism involved in periaxonal K+ buffering in peripheral myelinated axons (Fig. 22.13C).
Modeling activity-dependent K+ accumulation in various compartments of mammalian myelinated fibers, Chiu showed that the largest extracellular K+ accumulation is expected to occur at the adjacent 2–4 μm length of periaxonal space at the nodal–paranodal interface (Chiu, 1991), the region in which NKCC is highly concentrated (Figs 22.11B–D and 22.14). Indeed, this is the region where Schwann cell microvilli prominently express NKCC. These microvilli represent a dramatic increase in the ratio of surface area to volume seen in typical absorptive epithelia (Fig. 22.11D). The total membrane area of the microvilli is about ten to 15 times that of the nodal area (Berthold and Rydmark, 1983). Activity-dependent paranodal K+ accumulation of the magnitude predicted by the model (Fig. 22.14E) may cause sufficient depolarization to compromise repetitive conduction of impulses. In the paranodal region, diffusion alone is not sufficient to avoid K+ accumulation, as is the case for the nodal region. The features of the paranodal Schwann cell are well designed to act as a powerful periaxonal K+ buffering system. Experiments to test this hypothesis, using electrophysiological methods, are much needed.
Figure 22.14. Computer simulation of K+ accumulation in the nodal and paranodal periaxonal compartments of a myelinated fiber during non-propagating action potentials, assuming that the only K+ clearance mechanism is diffusion. A. Equivalent circuit used in the simulation. Values used in the model are described in Chiu (1991). B. and C. Ionic currents during a single non-propogating action potential in the nodal region (A) and in the paranodal region (B). D. and E. Activity-dependent accumulation of K+ in the nodel gap (D) and in the periaxonal space between the paranodal axon and the paranodal myelin (E). Note the different scales for [K+]o between D and E. If there were no K+ clearance mechanisms other than difussion, the periaxonal K+ accumulation would be two orders of magnitude higher in the paranode (10 mM), depolarizing the node and compromising action potential conduction.
(Modified from Chiu, 1995; reproduced with permission from Oxford University Press.)
Finally, the presence of NKCC in the axonal membrane deserves further comment. As already mentioned, at the time in which our work was published (2001), NKCC had only been reported in unmyelinated squid axons, as already mentioned (Russell, 2000). The presence of NKCC in mammalian peripheral axons and terminals (see below) suggests that the protein is transported from the cell bodies to distal regions of sensory neurons. Further, the fact that GABA depolarizes sensory axons, including myelinated or unmyelinated (see above, section II.A), suggests that the NKCC protein is also functional as an active Cl− uptake system, maintaining an outward Cl− gradient over the entire length of axon. NKCC in peripheral sensory axons may be involved in reuptake of K+ following nerve activity, as well as in cell volume control. The functional meaning of depolarizing GABAA extrajunctional receptors in sensory axons is still unknown. GABA in the periphery might play a role in the control of excitability and action potential propagation (Verdier et al., 2003). Interestingly, expression of NKCC1 in vagal sensory endings innervating the airways has been demonstrated (Mazzone and McGovern, 2006). Depolarzing Cl− currents determine nerve ending activation underlying cough reflexes. In central neurons, GABA mediates a depolarizing response at the axon initial segments of cortical pyramidal cells (Szabadics et al., 2006). As in peripheral axons, the outward Cl− gradient is caused by NKCC1 (Khirug et al., 2008). The functional meaning of these interactions in cortical neurons is intriguing, and remains to be elucidated.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123743732000224
Methods and Models in Neurophysics
C. Pouzat, in Les Houches, 2005
3.2.1. An experimental illustration from projection neurons in the locust antennal lobe
It is well known and understood since the squid giant axon study by Hodgkin and Huxley that once a neuron (or a piece of it like its axon) has fired an action potential, we must wait “a while” before the next action potential can be fired. This delay is dubbed the refractory period and is mainly due to inactivation of sodium channels and to strong activation of potassium channels at the end of the spike, meaning that we must wait for the potassium channels to de – activate and for sodium channel to de – inactivate. Phenomenologically it means that we should observe on the inter – spike interval (ISI) histogram from a single neuron a period without spikes (i.e., the ISI histogram should start at zero and stay at zero for a finite time). In addition we can often find on ISI histograms some other features like a single mode2
a “fast” rise and a “slower” decay as illustrated on Fig 4. The knowledge of the ISI histogram can in principle be used to improve spike – sorting because it will induce correlations between the labeling of successive spikes. Indeed, if in one way or another we can be sure of the labeling of a given spike to a given neuron, we can be sure as well that the probability to have an other spike from the same neuron within say the next 10 ms is zero, that this probability is high between 30 and 50 ms and high as well between 60 and 100 (you just need to integrate the ISI histogram to see that).
Fig. 4.. An example of ISI pdf estimates for 8 projection neurons simultaneously recorded in the locust antennal lobe (Pouzat, Mazor and Laurent, unpublished).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0924809905800216
Computational Neuroscience
Bertil Hille, … Bjoern Falkenburger, in Progress in Molecular Biology and Translational Science, 2014
3.1 General considerations
In their classical study of ion channels of the squid giant axon, Hodgkin and Huxley1 looked at a distal event (ionic current) and presumed internal, “hidden” gating states to best fit their data. They did not assume that their four “gating particles” had a molecular substrate, but when, decades later, ion channels were found to indeed contain four voltage sensors, their work appeared almost prophetic. We believe that two factors were instrumental for their successful predictions. One is their aim to simulate not a single-current trace, but currents over wide ranges of voltages, pulse durations, and ion concentrations. The second is that currents of giant axons are readily measured with high accuracy and good signal-to-noise ratio. This allows accurate fitting of activation and deactivation kinetics at many voltages.
Similarly, in our modeling of the G-protein-coupled cascade, we used measurements of kinetics over a wide range of agonist concentrations to probe the system we study. However, this system is different. We did not have to assume “hidden” states because much is known about the intermediate molecules of G-protein-coupled signaling. Our aim was not to “best fit the data,” but to incorporate known intermediate states that represent actual measurable molecular steps of the signaling cascade. We wanted to see how all the known steps worked together to produce the macroscopic channel modulation.
Another difference from the situation of Hodgkin and Huxley is that responses of small cells are more variable than those of giant axons. Hence, individual recordings are less reproducible and dose–response curves more “noisy.” Further, many of the optical measurements we use have lower signal-to-noise ratio than whole-cell current. Taken together, these factors make it more difficult to tweak intermediate steps by fitting the exact shape of a downstream curve.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123978974000085
Controversies In Diabetic Neuropathy
S.M. Emery, R.T. Dobrowsky, in International Review of Neurobiology, 2016
3.1 Import, Export, and Neuronal Support
Hsp70 export was unknowingly first characterized in heat-treated giant squid axon when protein levels of a heat shock-like transferrin protein increased in the axoplasm (Tytell et al., 1986). This transferrin protein was specifically identified as Hsp70 when heat-treated rat embryonic cell cultures (presumably fibroblasts) were shown to release Hsp70 into the media, independent of an increase in cell death (Hightower & Guidon, 1989). Glial eHsp70 secretion has also been confirmed in models of heat-treated glioblastoma cells (Guzhova et al., 2001).
The export mechanisms behind eHsp70 secretion are still not well understood since Hsp70 lacks a secretory signal sequence and inhibiting the secretory pathway has no effect on the release of eHsp70 (Hightower & Guidon, 1989). Some evidence has pointed toward an innate ability of the protein to traverse the cell membrane (Multhoff, 2007), lipid raft-mediated lysosomal release (Hunter-Lavin et al., 2004), and secretory-like granule excretion (Evdonin et al., 2006). However, the largest collection of evidence points to exosome-dependent trafficking; heat-shocked peripheral blood mononuclear cells increased eHsp70 levels and produced Hsp70-loaded exosomes (Lancaster & Febbraio, 2005). Though further study is needed to fully understand this Hsp70 export mechanism, exosomal eHsp70 release has been demonstrated in other models including colon and pancreatic cancer cell lines (Gastpar et al., 2005) as well as breast and leukemic cancer cells (Bausero, Gastpar, Multhoff, & Asea, 2005).
Once excreted eHsp70 can be absorbed and utilized by neighboring cells, typically for the purpose of cell support (Guzhova et al., 2001). The neuroblastoma cell line LAN-5 showed lower levels of cytotoxicity from both heat shock and staurosporine treatment after internalizing exogenously administered Hsp70 (Guzhova et al., 2001). These cytoprotective effects can likewise translate to nonneoplastic neuronal models. Injection of recombinant human Hsp70 into G93A mutant Cu/Zn superoxide dismutase (SOD1) mice helped preserve motor neurons resulting in a delayed onset of amyotrophic lateral sclerosis (ALS) symptoms (Gifondorwa et al., 2007). In vitro and ex vivo experiments using a trophic factor-deprived environment and sciatic nerve axotomy, respectively, confirm eHsp70 decreased motor neuron death (Robinson et al., 2005; Tidwell, Houenou, & Tytell, 2004). Exogenously administered Hsp70 also preserved viability of dorsal root ganglia (DRG) sensory neurons after sciatic nerve axotomy (Tidwell et al., 2004). Though the exact mechanism for cellular protection is not known, eHsp70 may act as iHsp70 upon internalization (Turturici, Sconzo, & Geraci, 2011).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0074774216300216
Batrachotoxin☆
M. Cataldi, in Reference Module in Biomedical Sciences, 2016
Pharmacological Effects
Neuromuscular: Effect on nerve conduction: Studies performed on squid giant axons revealed that BTX induces membrane depolarization and causes a progressive decrease in the amplitude of action potentials elicited by the electrical stimulation of the fiber (Albuquerque et al., 1971a,b; Albuquerque et al., 1973; Narahashi et al., 1971a,b).
BTX blocks axonal transport and induces axonal necrosis in a Na+ dependent manner (Boegman and Riopelle, 1980; Boegman et al., 1980; Deshpande et al., 1981; Hudson et al., 1984; Moore et al., 1981; Worth and Ochs, 1982). A subarachnoid injection of BTX into the spinal cord causes paraplegia in rats paraplegic due myelopathic damage (Boegman and Albuquerque, 1980; Garcia et al., 1978).
Effects on neurotransmitter release: In vivo studies indicate that BTX induces a massive release of 5-HT from the caudate nucleus (Hery et al., 1979) and from the raphe nuclei in cat (Hery et al., 1982), and VIP release from brain slices (Besson et al., 1982). It has been suggested that BTX causes massive neuronal activation based on the fact that it increases cAMP synthesis (Shimizu et al., 1970a,b) and phosphoinositide turnover (Benuck et al., 1989) in brain slices. BTX increases the affinity for carbachol and acetylcholine of muscarinic acetylcholine receptors in brainstem and ventricle, but not in the cerebral cortex. Because this effect disappeared in the presence of tetrodotoxin it was suggested that muscarinic receptors directly interact with NaV channels (Cohen-Armon et al., 1985). Kayaalp et al. (1970) demonstrated that BTX causes a prolonged blockade of sympathetic ganglionic transmission by blocking impulse conduction in the preganglionic sympathetic nerve fiber.
Effects on neuromuscular transmission: BTX makes muscle fibers unexcitable while promoting the appearance of muscle contractures. In the presence of the toxin there is an irreversible block of indirectly and directly elicited muscle twitch (Warnick et al., 1971). The earliest electrophysiological effect is a significant increase in the frequency of miniature end-plate potentials caused by an increase in presynaptic neurotransmitter release that results from an increase in Na+ influx into presynaptic terminals (Jansson et al., 1974). The increase in presynaptic Na+ concentration causes a progressive depolarization in nerve terminals leading to a progressive decrease in action potential amplitude. When action potential amplitude decreases to a half of the starting values, evoked transmitter release is abolished as is the muscle response to the electrical stimulation of nerve afferents (Jansson et al., 1974).
Effects on muscle: BTX and its analogues cause early and late muscle contractures. The early contractures appear during the first minutes after toxin administration and depend on the direct effect of the toxin on muscle membranes rather than to an effect on Ach release (Warnick et al., 1971). Late muscle contractures appear 20 min or more after toxin administration and are probably dependent on Ca2 + release from intracellular stores (Albuquerque et al., 1971b; Warnick et al., 1971).
BTX induces degenerative changes in muscle ultrastructure including swelling and destruction of terminal cisternae and of the longitudinal part of the sarcoplasmic reticulum (Albuquerque et al., 1971b). Ultrastructural changes are observed in the motor endplate as well, including swelling of nerve terminals and deformation and darkening of synaptic vescicles.
Cardiovascular effects: BTX causes atrioventricular block and a wide array of ventricular arrhythmias eventually leading to ventricular fibrillation and death. Microelectrode recordings in Purkinje fibers revealed an increase in the duration of the action potential and the appearance of afterpotentials early after BTX exposure, well before the membrane becomes persistently depolarized. Cardiac cells become unexcitable when the plasma membrane potential settles at values around − 20 mV (Hogan and Albuquerque, 1971).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128012383993796
The voltage-gated channels of Na+ action potentials
Constance Hammond, in Cellular and Molecular Neurophysiology (Fourth Edition), 2015
Abstract
The ionic basis for nerve excitation was first elucidated in the squid giant axon by Hodgkin and Huxley (1952) using the voltage clamp technique. They made the key observation that two separate voltage-dependent currents underlie the action potential: an early transient inward Na+ current which depolarizes the membrane, and a delayed outward K+ current largely responsible for repolarization. This led to a series of experiments that resulted in a quantitative description of impulse generation and propagation in the squid axon. Nearly 30 years later, Sakmann and Neher, using the patch clamp technique, recorded the activity of the voltage-gated Na+ and K+ channels responsible for action potential initiation and propagation. Taking history backwards, action potentials will be explained from the single channel level to the membrane level.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123970329000042
Na+-Ca2+ Exchange Currents
John H.B. Bridge, … Michela Ottolia, in Cell Physiology Source Book (Fourth Edition), 2012
VIIC Phosphorylation
It has been known for some time that exchange activity in squid giant axons could be regulated by ATP. The main effect of ATP is to increase the affinity of the exchanger for its substrates Na+ and Ca2+. Moreover, recent evidence suggests the involvement of a Ca2+-dependent protein kinase. It appears that, at least in the squid, Na+-Ca2+ exchange that is stimulated by ATP requires intracellular Ca2+ and can be mimicked by hydrolyzable ATP analogs (DiPolo and Beauge, 1987a,b).
It has been difficult to demonstrate regulatory effects of ATP in cardiac tissues. The whole-cell isolated patch technique does not lend itself to studies of this nature because it is extremely difficult, if not impossible, to control intracellular ATP concentrations. However, recent evidence suggests that the molecule may be phosphorylated and regulated by two mechanisms. One which remains controversial is that phophorylation can take place by β-adrenergic/PKA activation. There appears to be stronger evidence that PKC mediated signaling can regulate NCX phosphorylation. We refer the interested reader to the review by Zhang and Hancox (Zhang and Hancox, 2009).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123877383000147
Dynamical Properties of Excitable Membranes
Douglas A. Baxter, John H. Byrne, in From Molecules to Networks (Third Edition), 2014
Hodgkin and Huxley conducted their voltage-clamp experiments on the squid giant axon at the Marine Biological Laboratory in Plymouth, England. Although the Plymouth laboratory was badly damaged during the great air raids of 1941, it was partially rebuilt by the time Hodgkin and Huxley arrived in July of 1949. With the help of Bernard Katz and their improved voltage-clamp apparatus, it took them only a month to obtain all of the voltage-clamp records that were used in the five papers published in 1952 (Hodgkin et al., 1952; Hodgkin and Huxley, 1952a−d). Upon returning to the University of Cambridge, they spent the next two years analyzing the data and preparing the manuscripts. By March 1951, they had settled on a set of the equations and parameters that adequately described the time course, magnitude and voltage dependency of the membrane currents that were observed during voltage-clamp steps. It was by no means a foregone conclusion, however, that these same equations would describe the behavior of the membrane under its normal operating conditions. Thus, the final stage of their analysis was to calculate the response of their mathematical representation of the nerve to the equivalent of an electrical stimulus. If the calculations produced an action potential that agreed favorably with experimental data, this would help validate their model.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123971791000142
Principles
Toshio Narahashi, in Handbook of Pesticide Toxicology (Second Edition), 2001
Amplification of Pyrethroid Toxicity from Sodium Channels to Animals
An early study by Lund and Narahashi (1982) using squid giant axons suggested that only a very small fraction of the sodium channel population needed to be modified by pyrethroids to cause repetitive discharges. This was based on the calculation of the percentage of sodium channels needed to increase the depolarizing after-potential to the level of threshold membrane potential for generation of repetitive action potentials. However, a few assumptions had to be made for calculation, as not all data were available at that time. Later, Tatebayashi and Narahashi (1994) developed a method to calculate the percentage of sodium channel modification caused by pyrethroid based on patch clamp data using rat DRG neurons. Since the peak sodium current (INa) during a depolarizing pulse was not affected by pyrethroid, it represented the activity of normal or unmodified sodium channels. The tail current (Itail) upon termination of a depolarizing pulse appeared only after application of pyrethroid, and therefore it represented the activity of modified sodium channels. The percentage of modification (M) can be calculated by the following equation:
(1)M=[{Itail/(Eh−ENa)}/{INa/(Et−ENa)}]×100
where Itail is the tail current amplitude obtained by extrapolation of the slowly decaying phase of the tail current to the moment of membrane repolarization assuming a single exponential decay, Eh is the potential to which the membrane was repolarized, ENa is the equilibrium potential for sodium ions obtained as the reversal potential for sodium current, and Et is the potential of step depolarization. The percentages of sodium channels modified by tetramethrin were very small: for example, for TTX-S sodium channels, 0.24%, 3.53%, and 12.03% by 0.1,1, and 10 μM tetramethrin, respectively; for TTX-R sodium channels, 1.31%, 15.35%, 57.82%, and 81.20% by 0.01, 0.1, 1, and 10 μM tetramethrin, respectively. Thus, TTX-R sodium channels are approximately 30 times more sensitive to tetramethrin than TTX-S sodium channels.
A question arises as to the degree of pyrethroid modification needed to cause repetitive nerve activity. Using the same method of calculation and also comparing these calculated data with the threshold concentration for tetramethrin needed to induce repetitive discharges in rat cerebellar Purkinje neurons, an astonishingly small percentage was obtained, that is, 0.62%, as illustrated in Fig. 12.4 (Song and Narahashi, 1996). This provides one of the bases for high potency of pyrethroid action. It is also important to note that the significance of this “toxicity amplification” is not limited to pyrethroids. When a drug slightly suppresses the slow depolarization (e.g., caused by activation of T-type calcium channels or in epileptic seizure), repetitive discharges generated by the slow depolarization will stop, and for this action only a concentration of the drug (e.g., antiepileptic drug) much lower than the IC50 for suppressing the depolarization (or calcium channels) will be needed, perhaps IC10 or even IC1. Thus, “pharmacological amplification” will become important for interpreting the drug action in vivo. The traditional concept of relating in vitro IC50 to a patient’s serum concentration of the drug may not necessarily be valid when the effect is exerted via the threshold phenomenon.
Figure 12.4. Concentration-dependent effect of tetramethrin on TTX-S sodium currents of rat cerebellar Purkinje neurons. (a) Currents were evoked by a 5-msec step depolarization to 0 mV from a holding potential of −110 mV under control conditions and in the presence of tetramethrin (0.3 μM, 3 μM, and 10 μM). TTX (0.5 μM) completely blocked both the peak current and the tetramethrin-induced tail current. (b) The concentration-response relationship for induction of tail current. Each point indicates the mean ± S.E.M. (n = 6). Data were fitted by the Hill equation. The percentages of channels modified by tetramethrin are 0.62 ± 0.15%, 2.19 ± 0.36%, 5.75 ± 0.87%, 13.58 ± 1.35%, 22.77 ± 2.26%, and 24.73 ± 2.11% at concentrations of 0.1, 0.3, 1, 3, 10, and 30 μM, respectively (n = 6). (c) Repetitive after-discharges caused by 100 nM tetramethrin, the threshold concentration. Action potentials were evoked by applying a current pulse (2 msec, 200 pA). Em refers to the membrane potential. From Song and Narahashi (1996).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012426260750015X