Статья на конкурс «Био/Мол/Текст»: Как вы думаете, от какого из чувств люди скорее готовы отказаться? Увы, чаще всего говорят: «обоняние». Но это непопулярное чувство намного важнее и загадочнее, чем мы считаем. И в то же время оно очень уязвимо: все мы ждем, что можно будет перестать волноваться о внезапной потере обоняния. Что же таинственного прячут молекулярные и клеточные механизмы обоняния? И почему именно его теряют полностью или частично? Об этом и многих других неожиданных поворотах исследований обоняния читайте в статье.
Конкурс «Био/Мол/Текст»-2020/2021

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В мае 2019 года из университета Канберры, опасаясь возможной утечки газа, эвакуируют полтысячи человек; в июле 2019 года самолёт, направлявшийся из Филадельфии в Лондон, совершает экстренную посадку в Бостоне; в июне 2020 года шесть сотрудников почтового отделения отправлены в больницу, — десятки похожих историй появляются в прессе с завидной регулярностью. Что же их объединяет? Провокатор этих происшествий — запахи и наша способность их воспринимать. Мы, как читатели, сочтём эти ситуации курьёзом. Но пострадавшие от отправленного кем-то дуриана или невыносимого запаха в салоне вряд ли захотят повторять такой опыт. Но не стоит завидовать тем, кто, находясь в месте непосредственных событий, остаётся только зрителем, не понимая, в чем причина для паники. За это право приходится дорого платить — обоняние довольно легко потерять, а вот вернуть иногда невозможно.
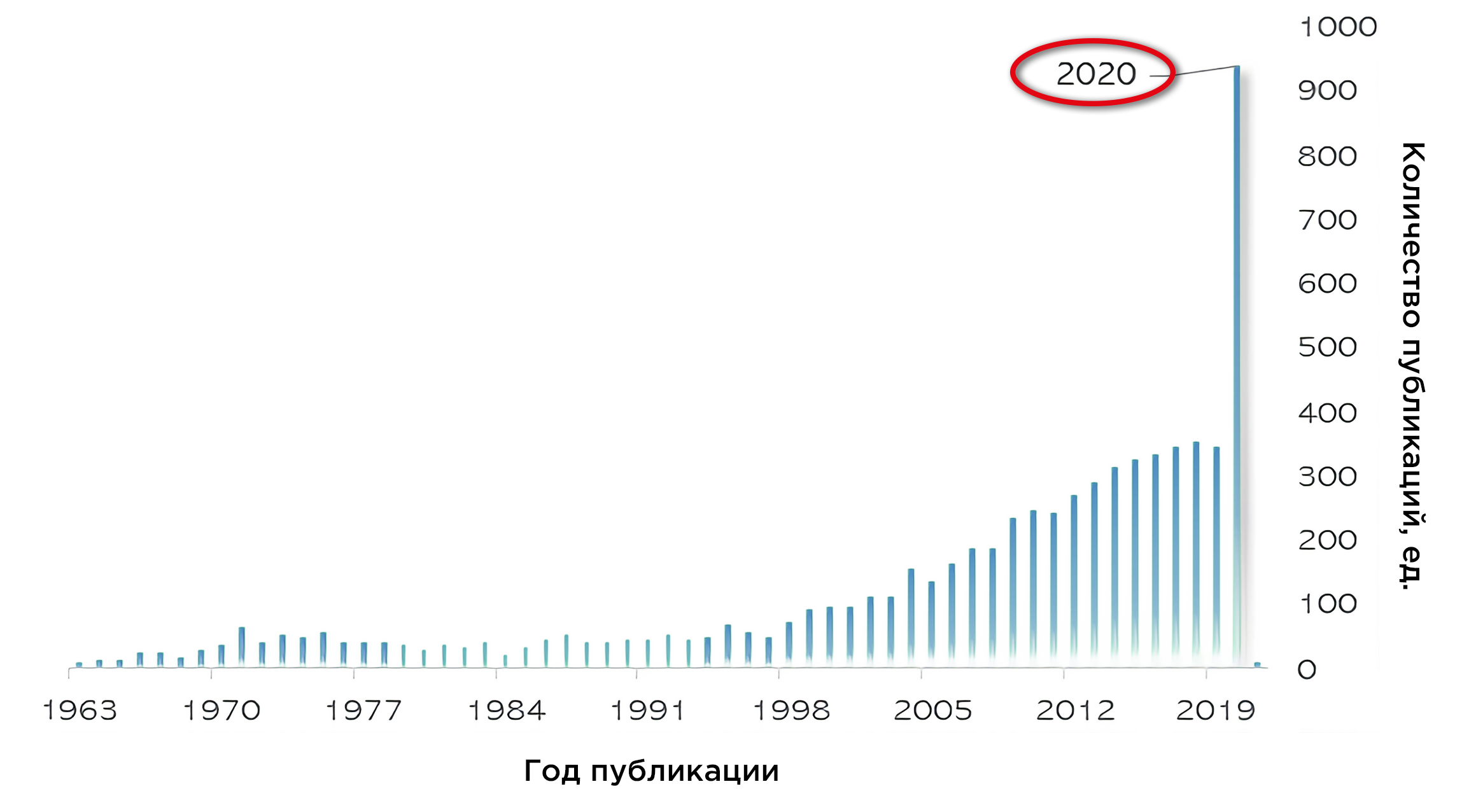
«Добро пожаловать в мир без вкуса и запаха», — лирично сообщают знакомые в соцсетях. Наверное, самый выделяющийся симптом этой пандемии. Мы стали внимательнее к аромату утреннего кофе и небеспричинно начинаем беспокоиться, если все блюда обеда будут одинаково никакими по вкусу. Потеря обоняния, известная как аносмия, привлекла в 2020 году беспрецедентное научное и общественное внимание (рис. 1).
Рисунок 1. Количество публикаций в PubMed по запросу «аносмия». (По данным на 10 декабря 2020 года).
Устранять последствия пандемии мы будем долго, но среди безрадостных цифр найдутся и положительные влияния на здоровье людей — помимо привычки регулярно мыть руки. Например, аносмия и гипосмия (снижение обоняния) — больше не малоизвестные термины. И есть надежда, что исследования последнего года откроют дорогу к созданию новых методов терапии. Знаем об обонянии мы теперь точно немного больше.
По разным докоронавирусным данным эта патология затрагивает от 5% до 20% процентов людей. Предпосылки аносмии разнообразны — это респираторные инфекции, травмы головы, токсические действия лекарств, аллергии и многое другое. В самых крайних случаях — например, при недоразвитии обонятельных долей мозга или генетических дефектах — люди так и узнают мир: практически без вкуса и запаха. Болезнь Паркинсона, Альцгеймера, рассеянный склероз — только некоторые заболевания масштаба эпидемий, о наступлении которых за много лет может сообщить потеря или резкое снижение обоняния [2]. Диагноз «идиопатическая аносмия» получит около четверти людей, так и не узнав, почему они лишились нюха. «Обонятельные» чрезвычайные ситуации тоже бывают — истории шеф-поваров, оставшихся после аварий без работы, можно легко найти в интернете.
Будь то результат пренебрежения или других заблуждений, но обоняние, тип хеморецепции, — самое древнее и самое неразгаданное чувство. На школьных медосмотрах не проверяют наш нюх, в кино пока не пришли ароматы, а говорить о запахах нам часто становится неловко. Как следствие, и в нарушениях мы пока не разбираемся до конца. В феврале благотворительные и научные организации отмечают День осведомлённости об аносмии. Они справедливо считают, что нарушения обонятельной системы заслуживают более серьезного внимания. Как же возникает аносмия? На этот вопрос мы и попытаемся ответить.
Обозначим маршрут
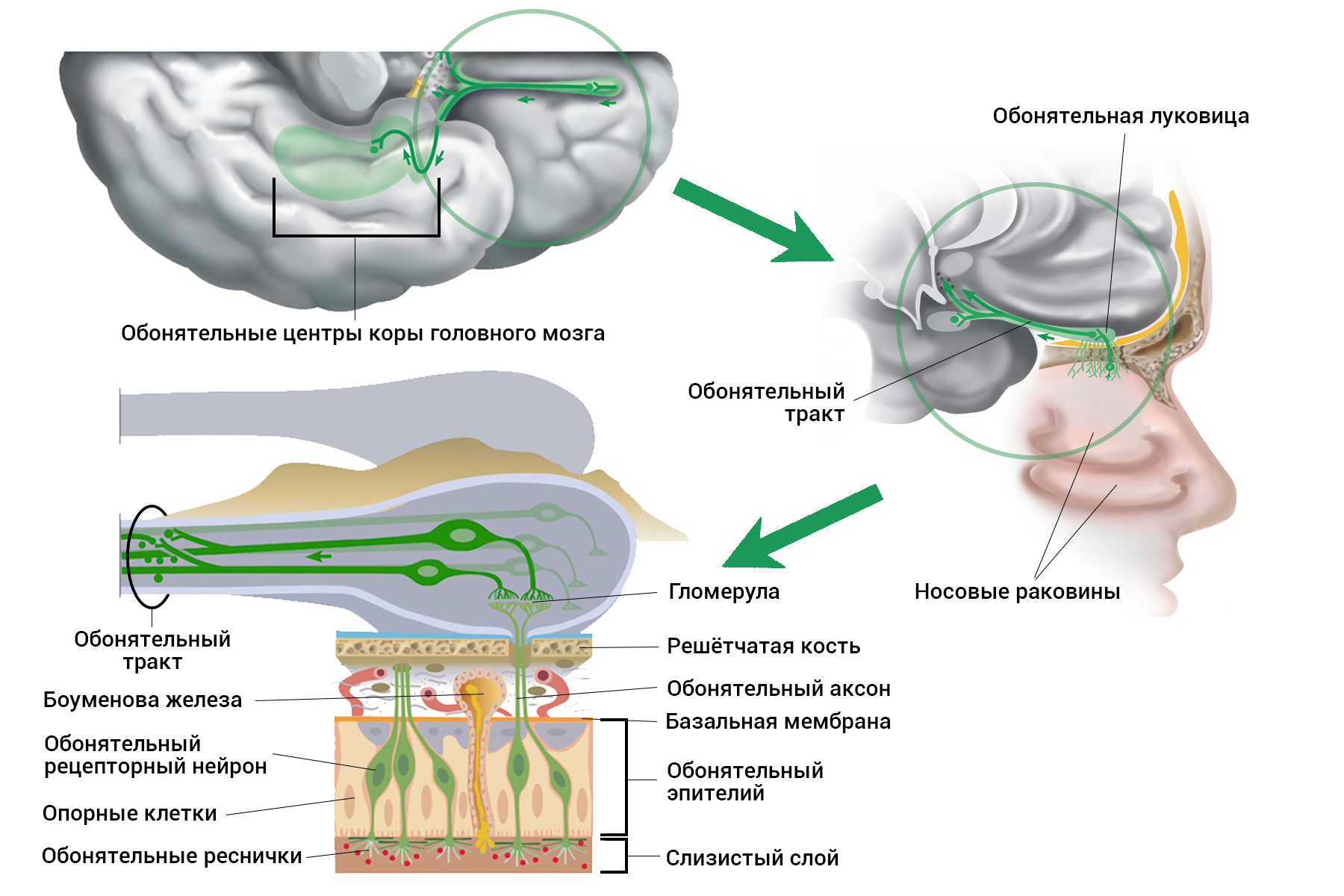
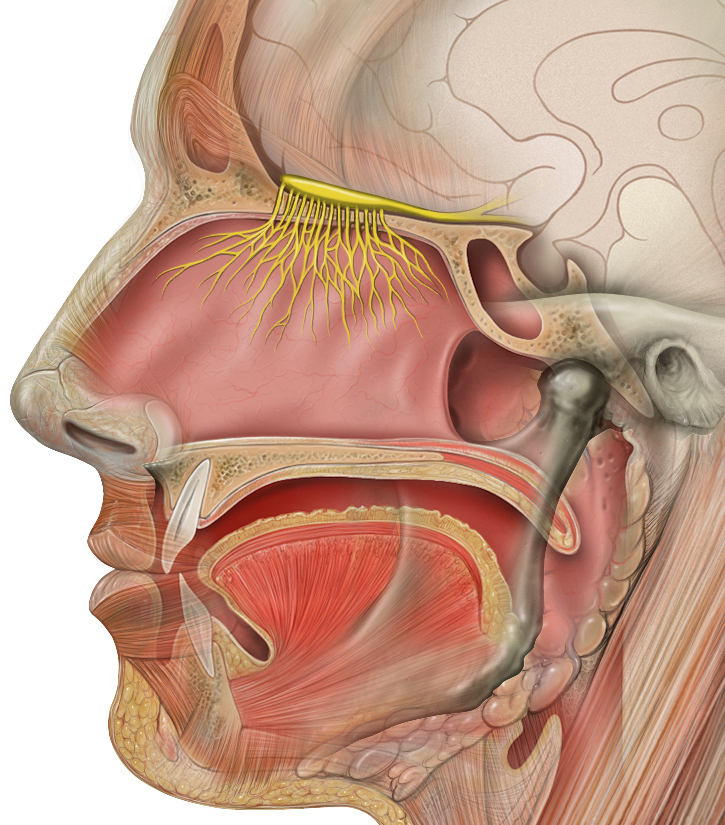
Чтобы понять природу нарушений, мы проследим, как формируется обонятельное измерение. А точнее, обозначим клеточные и молекулярные основы превращения одоранта в нервный сигнал. Для знакомства с обонятельным анализатором (в терминах И.П. Павлова) разберём его на три части (рис 2). Обонятельные нейроны в составе эпителия (это продолжение мозга у нас в носу) улавливают молекулы одорантов (летучих веществ) и отвечают на них сигналом — потенциалом действия. Сигнал уходит по аксонам в обонятельную луковицу, где они переключаются на митральные или пучковые клетки в гломерулах. А дальше по проводам обонятельного тракта информация о запахах отправляется в центральную часть мозга — пириформную кору, миндалину, обонятельный бугорок, энторинальную кору. Уже оттуда сигналы расходятся дальше — в гипоталамус, таламус, гиппокамп, орбитофронтальную кору и др.
Основное внимание мы сосредоточим на периферии анализатора — обонятельных нейронах. По этой причине, к сожалению, за пределами рассказа останутся объяснения многих таинственных аспектов: расшифровка, узнавание и классификация запахов, их связь с эмоциями и воспоминаниями, физиология (например, как похудеть, если отказаться от запахов). Однако попутно представится возможность узнать о некоторых интригующих секретах обоняния, многообещающих клинических испытаниях, Нобелевских лауреатах и новой нейромедиаторной системе, ещё не успевшей попасть во многие учебники.
Рисунок 2. Строение обонятельной системы. Показаны основные структуры: окончания аксонов митральных и пучковых клеток в головном мозге — центральные проекции обонятельного тракта (обонятельные центры); обонятельная луковица с гломерулами, обонятельный тракт, строение обонятельного эпителия.
адаптировано из [61]
Глава I. С чего всё действительно начинается?
Начинается всё до рецептора
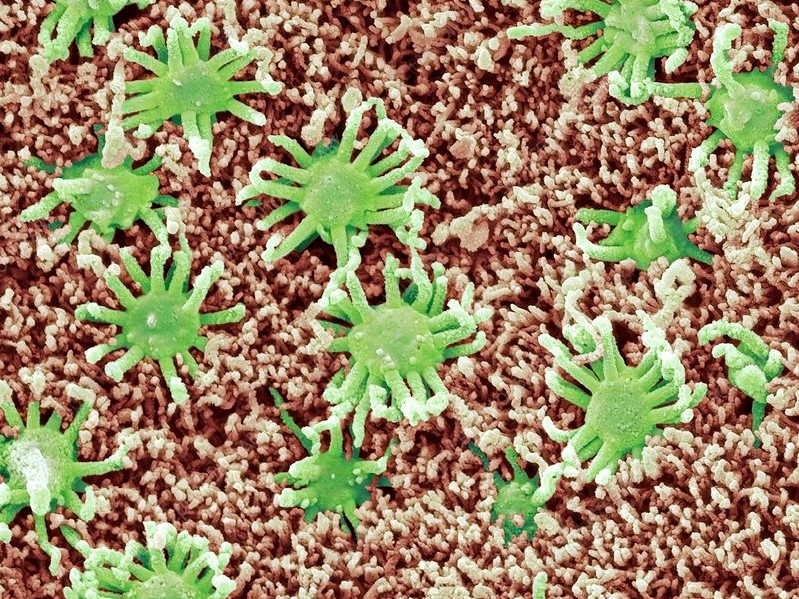
Итак, на периферии анализатора работают обонятельные биполярные нейроны. Это они известны уникальной для нервной системы способностью к обновлению. Укрывает их слой назального мукуса, в который с поверхности эпителия выглядывают реснички нейронов, которые делают их похожими на актиний (рис. 5). На ресничках расположены комплексы обонятельных рецепторов — самого многочисленного семейства среди рецепторов, связанных с G-белком (им посвящена одна из рубрик «Биомолекулы»). Когда молекула одоранта преодолеет слой мукуса, произойдёт ведущее событие трансдукции — она свяжется с рецептором. Однако обоняние может прерваться, даже не успев начаться.
Трансдукция — преобразование внешнего воздействия в код нервных сигналов.
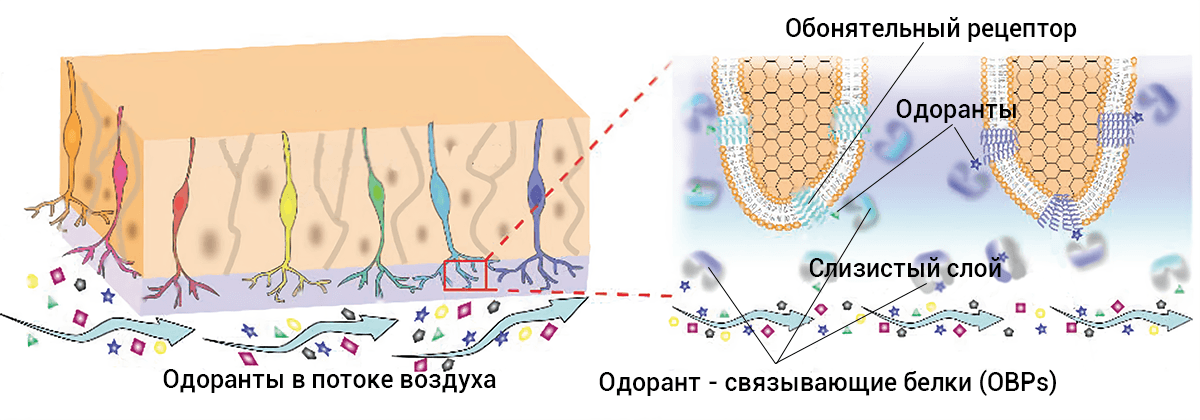
Дело в том, что слизь в носовой полости совершенно не заслуживает негативных коннотаций. Помимо очевидной защитной функции, она обеспечивает удержание, транспорт и удаление молекул одоранта. При воспалении усиленная продукция слизи становится физически непреодолимым барьером для молекул. Что же входит в состав слизи кроме воды и ответственных за вязкость мукогликопротеинов? Это иммуноглобулины, цитокины, лизоцим и лактоферрин, кальций-связывающие белки псориазин и кальпротектин, различные пептидазы, калликреин, глутатион-S-трансфераза, карбоксилэстераза, дегидрогеназы, цитохром P450, пероксиредоксины, пероксидазы, Plunc — белок небно-легочно-назального эпителиального клона, ионы металлов, и главным образом одорант-связывающие белки [3] — список неполный, но внушительный. Более 400 молекул с различными свойствами, включая антимикробные и обезвреживающие ксенобиотики, защищают уязвимый сенсорный эпителий от внешнего воздействия.
Особого внимания заслуживают одорант-связывающие белки, далее OBPs (от англ. odorant binding proteins). Они принадлежат семейству транспортных липокалинов и помогают гидрофобным молекулам добираться до рецепторов. Вдобавок они помогают рецепторам расставаться с одорантами [4]. У человека пока известен единственный вид ОВРs, кодируемый геном OBP2A. И если не повезло с генетическим полиморфизмом, то молекулам не стоит ожидать комфортной дороги к рецептору: один из аллельных вариантов отличается низкой чувствительностью транспортного белка. Как следствие, развивается гипосмия [5].
Рисунок 3. Одорант-связывающие белки в мукусе захватывают одоранты для их транспортировки к рецепторам на ресничках обонятельных нейронов.
адаптировано из [4]
С большим энтузиазмом к ОВРs относятся биоинженеры. Чем они ещё могли привлечь учёных? В мукусе ОВРs успешно функционируют в коктейле протеолитиков, а также они устойчивы к температурам и органическом растворителям. Остаётся научиться настраивать специфичность ОВРs или использовать уже имеющуюся — и в руках оказываются неплохие составляющие для создания искусственных сенсорных систем.
Часть ферментов из списка активна по отношению к самим одорантам [6]! Можно ли быть уверенным, что для рецептора, лишённого своего мукусного окружения, в эксперименте найдут правильный лиганд? Это ещё предстоит уточнить. Про связь состава слизи и возрастного ухудшения обоняния пока тоже непонятно. Не исключено, что в долгосрочной перспективе для дифференциальной диагностики синуситов и ринитов к цитологическим исследования мукуса, риноцитограммам, добавят и протеомный анализ [7], [8].
Помощь со стороны
Также в мукусе комфортно живут бактерии со своими разнообразными ферментами и метаболитами (часть из которых будут одорантами). Кто особенно интересуется микробной флорой носа? К сожалению, таких мало. Но если хочется привлечь к исследованию безмикробных мышей, то это стоит учитывать [9]. Обоняние у животных занимает не последнее место, и действительно, поведение мышей с бактериально осиротевшим обонятельным эпителием может отличаться. А влияют ли сами бактерии на остроту нашего нюха? Пока знание об этом в зачаточном состоянии. Подозревают, что есть бактерии, потеря которых будет критической [10]. Но всё же основной принцип скорее «больше — не значит лучше». Причём как количественно — усиленное заселение бактериями блокирует доступ для молекул, — так и качественно. Шведские учёные обнаружили, что у людей, чей балл TDI был меньше нормы, в мукусе носа есть характерные для кишечника и полости рта виды фекалибактерий, энтеробактерий, порфиромонад [11].
К слову об оценках. Для объективного исследования обоняния вычисляют TDI-индекс (общий индекс обоняния). Он рассчитывается по данным тестов, оценивающих: threshold — порог восприятия (например, бутанола-1), discrimination — показатель дискриминации запахов (в тройке просят найти отличающийся от двух запах), identification — показатель идентификации запахов.
Исследователи предполагают, что, в отличие от кишечника, увеличенная продукция бутирата этими видами оказывается в носу не к месту. Порфиромонаду, кстати, можно было заметить на страницах ноябрьского Nature [12]. В специальном материале вновь обсуждали статус инфекционной гипотезы Альцгеймера. У этого вопроса тернистый путь длиной в десятилетия, и, чтобы разрешить все сомнения, знаний пока недостаточно. Однако, кажется, уместно размышлять, что обонятельный эпителий как минимум упрощает микробам доступ в ЦНС.
А вот об участии бактерий в том, как мы пахнем, известно однозначно. В неприятном для большинства запахе пота можно обвинять, например, колонии коринебактерий и стафилококков. Они превращают аминокислоты в характерно пахнущие изовалериановую кислоту и серосодержащие вещества. В исследовательском отделе швейцарской фирмы Живодан активно исследуют, как мы приобретаем свойственный нам запах и как воспринимаем чужие. Оказалось, что основной вклад в подмышечный аромат вносят продукты специального фермента коринебактерий — Nα—ацил-глутамин-аминоацилазы и производимых ею карболовых кислот. Ещё исследователи смогли установить, как распространённый в Восточной Азии полиморфизм гена ABCC11 (кодирует АТФ-связанные кассетный транспортер) связан с почти полной потерей привычных для нас компонентов запаха [13]. Многие читатели наверняка знакомы с историей, заманчиво намекающей нам его важность. В 1995 году впервые сообщили о связи HLA-генотипа (от англ. Human Leukocyte Antigens — человеческий лейкоцитарный антиген) и индивидуальной привлекательности запаха. Речь шла о соединениях, не являющихся феромонами. Естественный вопрос — что же могло пахнуть? Вы могли слышать, что HLA принимает участие в диалоге бактерий и иммунной системы, а значит способен влиять на состав микробиома и производимые запахи. Следовательно, оценка чужого запаха как приятного или нет может зависеть от бактериальных метаболитов? Но не стоит поддаваться соблазну — подобное объяснение приводит в тупик. Исследования ассоциированного с HLA запахового паттерна пока не дают результатов, а к известному эксперименту с футболками тоже есть вопросы , [14]. Но думаю, никто не будет спорить, что неприятный запах тела приводит к социальному изгнанию. Ещё, как показала Джой Милн, они могут предупреждать о болезни Паркинсона.
В 1995 году профессор Клаус Ведекинд собрал почти 50 мужчин, которые согласились на два дня отказаться от любой парфюмированной химии и не менять футболку. Примерно столько же женщин согласились оценить, насколько привлекательным им кажется запах этих футболок. Он обнаружил, что чем больше генотип HLA у женщины отличался от мужчины, носившего футболку, тем положительнее была оценка его запаха. Этот эксперимент запомнился как «опыт с пахнущими майками».
Диагностика болезней по запаху — вполне перспективное занятие. Джой Милн потеряла мужа из-за болезни Паркинсона. Она заметила изменения — странный запах — ещё за несколько лет до постановки диагноза. Познакомившись с другими больными, она поняла, что так пахнет эта болезнь. В прошлом году сообщили, что наконец удалось выяснить, какие пахучие молекулы ответственны за этот аромат. Полагаться только на людей с «супер-нюхом» нельзя, поэтому для диагностики активно разрабатывают электронные устройства. Кстати, «Биомолекула» уже писала о них [15].
Другими словами, запахи важны для нашей повседневной жизни. Пусть даже вам неинтересны детали химического общения людей. Но, может, вы всегда мечтали к просмотру любимого кулинарного шоу добавить еще и запахи. Не стоит ошибочно полагать что исследования мукуса недостойны научного изыскания. Мукус — это не просто 95% воды, это — биологически активная система. Ферментативные превращения веществ в мукусе и участие микробного сообщества — возможный источник несоответствия между нашим восприятием и ответами рецепторов в чашке Петри. Если мы хотим достойно воспроизводить воспринимаемые запахи, то нужно иметь в виду перирецепторные события (так называют события, предшествующие активации рецептора) [16].
Второстепенных ролей не существует
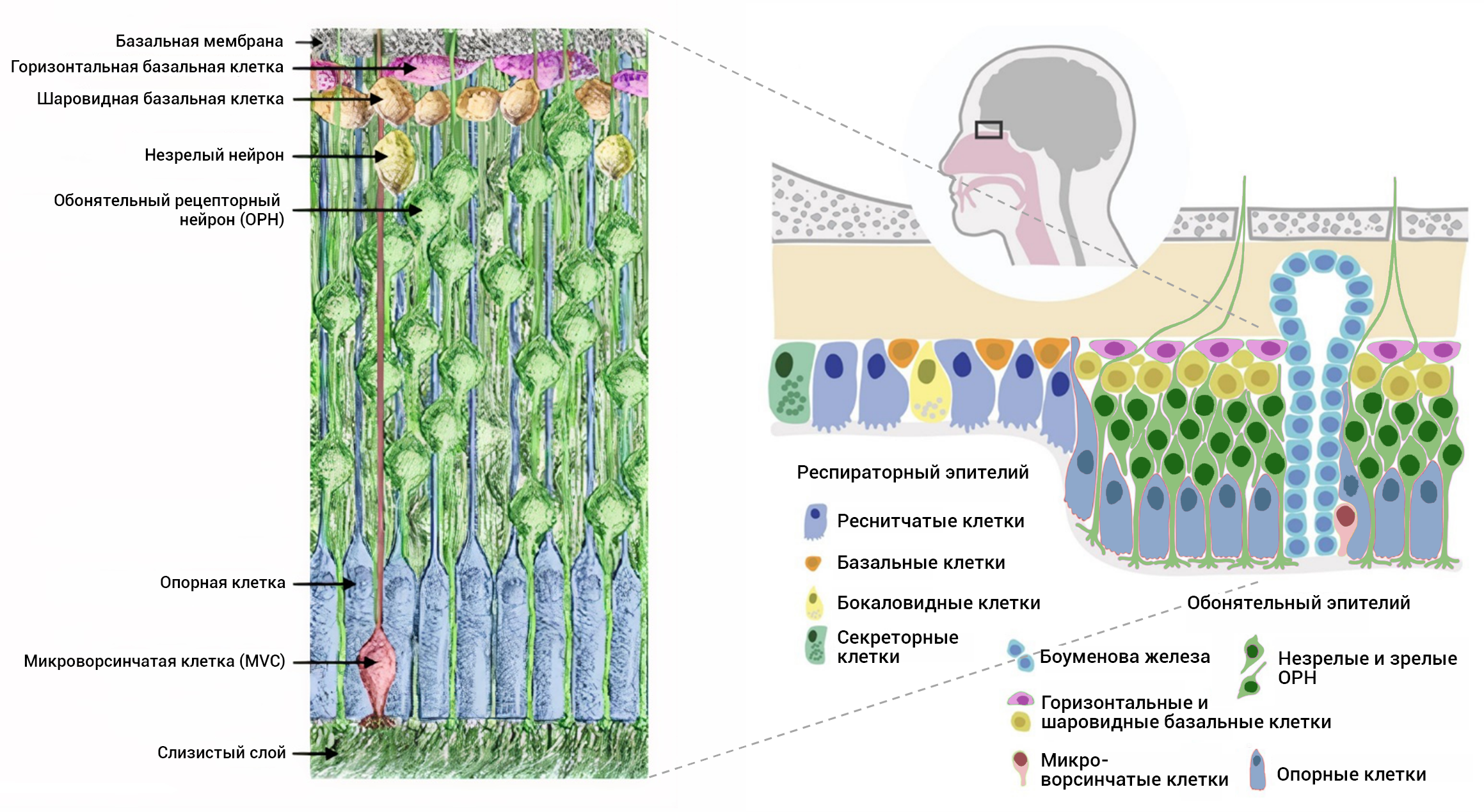
Под слоем мукуса мы найдём обонятельный эпителий (рис. 4). В его составе традиционно выделяли три группы клеток — собственно обонятельные нейроны, окружающие их опорные клетки и базальные стволовые клетки. И в дополнение — железы Боумена. Впрочем, об обонятельных нейронах и их ресничках (цилиях) речь пойдет чуть позже.
Рисунок 4. Схематическое строение многослойного обонятельного эпителия.
адаптировано из [19], [21]
Трава под ресничками нейрона (рис. 4) — это микроворсинки клеток с одноимённым названием — микроворсинчатые клетки (англ. microvillar cells, MVS), а также опорные клетки (англ. sustentacular cells). Опорные клетки производят компоненты мукуса, окисляющие ксенобиотики, а также механически поддерживают и разделяют нейроны. Истинные взаимоотношения клеток эпителия намного сложнее, чем принято считать. Например, зачем микроворсинчатым клеткам экспрессировать канал TRPM5, больше известный как рецептор горького вкуса? Оказывается, это тоже инструмент защиты эпителия, он связывает подозрительные метаболиты. На это клетка отвечает выделением ацетилхолина, который, в свою очередь, стимулирует опорные клетки (это проявление паракринной регуляции): сигнального кальция в опорных клетках становится больше, и клетки активнее производят защитные ферменты [17]. Увы, разнообразие мембранных белков не-нейрональных клеток эпителия иногда оборачивается проблемами. Например, обнаружили, что проникновение нового коронавируса происходит через связывание с сериновой протеазой-2 TMPRSS2 (от англ. Transmembrane protease, serine 2) и ангиотензинпревращающим ферментом 2 ACE2 (от англ. Angiotensin-converting enzyme 2) на микроворсинчатых и опорных клетках. Эти «рецепторы» также есть и на глубоко лежащих базальных клетках, и в тканях мозга. Возможно, при их повреждении и наблюдаются случаи длительной аносмии и других менее типичных симптомов [18], [19]. Различные белковые комплексы могут сходным образом открывать двери и для входа других патогенных организмов.
Есть и другие угрозы для целостности эпителия: контакт с агрессивными химическими реагентами и лекарствами может привести к гибели опорных клеток. За ней последует апоптоз обонятельных нейронов и аносмия. Потенциально на это способны многие вещества, например, известный кожный аллерген — сульфат никеля, применяемый в промышленности и, вполне возможно, до сих пор встречающийся в косметических изделиях.
Иногда отлаженная работа клеток эпителия оказывается под атакой системных заболеваний. Например, до 70% процентов больных муковисцидозом в некоторой степени утрачивают обоняние. Муковисцидоз — это тяжелое заболевание, вызванное мутациями гена хлорного канала CFTR (от англ. Cystic Fibrosis Transmembrane conductance Regulator). Такой канал есть на подтипе микроворсинчатых клеток, производящих нейропептид Y, который, к слову, провоцирует усиленную пролиферацию стволовых клеток, а сам канал CFTR координирует гомеостаз обонятельного эпителия [20]. Так, потеря канала приводит к истощению слоя мукуса, поскольку вода и натрий стремительно направляются внутрь клеток. В сочетании с увеличеной продукцией нейропептида Y и активацией иммунного ответа обонятельный эпителий функционирует хуже [21] — отсюда и ухудшение обоняния. Все связующие звенья этого процесса ещё предстоит узнать. Но, возможно, по следам этих экспериментов получится создать клеточные модели заболевания.
Сами обонятельные нейроны сменяют друг друга каждые 30–40 дней. Меняются и поддерживающие клетки. Их последователи развиваются в основном из шаровидных базальных клеток. Считается, что горизонтальные стволовые клетки — это экстренный резерв при повреждении эпителия. В грубом приближении истощение ресурсов стволовых клеток — причина наступления аносмии с возрастом (пресбиосмия).
ГЛАВА II. Удивительные обонятельные нейроны
Много миллионов антенн
На 2,5 квадратных сантиметра обонятельного эпителия (рис. 5) приходится с десяток миллионов нейронов. Каждый зрелый нейрон обслуживают 15–30 ресничек, служащих для принятия, усиления и передачи химического сигнала. Они пробиваются из обонятельной булавы нейрона — окончания единственного дендрита нейрона. Благодаря этим ресничкам нейроны, спрятанные в эпителии, увеличивают площадь контакта с внешней средой, не подвергая себя лишнему воздействию. На мембранах ресничек находятся не только рецепторы, но и все детали классического сигнального каскада. Если правильность их установки или сборка цилий нарушается, то страдает обонятельная функция. Все компоненты для сборки и содержания приходят из цитоплазмы, поскольку в цилиях нет своих митохондрий и белоксинтезирующего аппарата.
Рисунок 5. Выстилка носа (обонятельный эпителий). Изображение получено методом сканирующей электронной микроскопии. Помимо ресничек и булавы обонятельных нейронов (выделены зелёным цветом) видны мироворсинки опорных и микроворсинчатых клеток (выделены коричневым цветом).
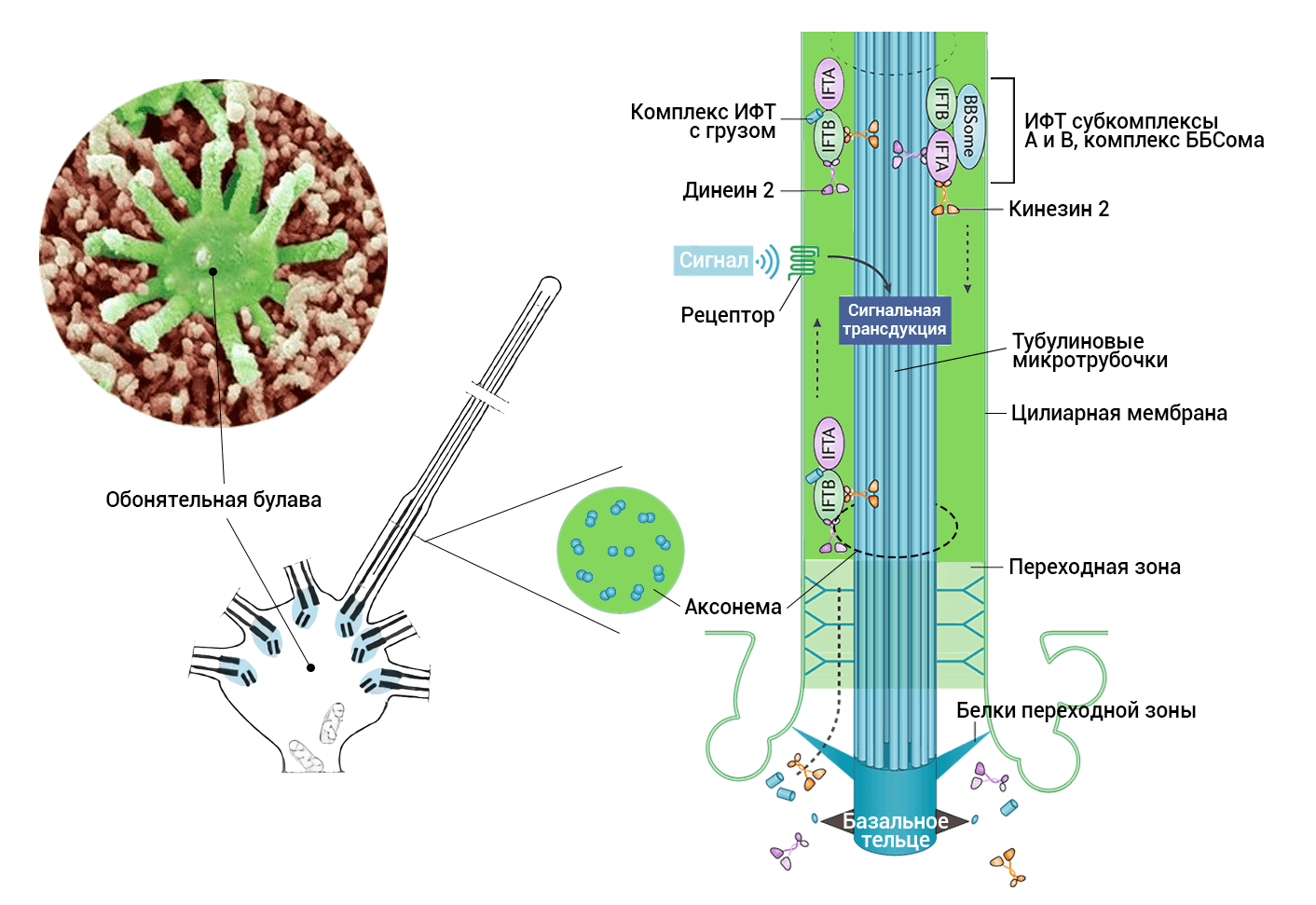
Цитоплазму и цилии связывает система интрафлаггелярного транспорта (ИФТ) (от лат. intra — внутри и flagellum — бич, жгут). В заметке Кейта Козмински, который, будучи аспирантом 30 лет назад изучал ИФТ, можно узнать о хитросплетениях исследований и их возрождении [22]. Другая основательная статья о роли этой системы была опубликована в 2002 году [23]. Основные участники системы — ИФТ-субкомплексы А и В (рис. 6), моторные белки и октамерный комплекс белков ББСома (англ. BBSome) (рис. 6). Если какие-то детали выпадают, то развиваются цилиопатии. Это гетерогенная группа патологических состояний, среди которых присутствует и потеря обоняния. К сожалению, из-за повсеместности цилий (они есть на поверхности очень многих клеток в организме) одновременно нарушается работа сразу нескольких органов (почки, печень, различные протоки и т.п.) [24].
Комплекс ББСомы назван так по синдрому Барде-Бидля (англ. Bardet-Biedl syndrome). Среди вторичных симптомов этого заболевания есть и аносмия. Правда, она развивается по-разному — в зависимости от поврежденных генов. Последствия одного из выявленных генетических вариантов — дезорганизация микротрубочек в цилиях [25], [26].
Рисунок 6. Строение неподвижных ресничек (цилий) обонятельных нейронов. Основная структура цилий — это 9 дуплетов микротрубочек и две в центре. На схеме показано расположение ещё одного необходимого элемента — базального тельца в основании цилий, а также переходной зоны, в которой и обнаруживается белок CEP290. На рисунке обозначены участники системы интрафллаггелярного транспорта — это ИФТ-частицы, состоящие из ББСомы; моторные белки (кинезины и динеины, в зависимости от направления движения), ИФТ-субкомплексы А и В. ИФТ-частицы переносят компоненты микротрубочек, цилиарной мембраны и мембранных белков.
адаптировано из [26]
Природа цилиопатий в целом пока плохо изучена, но зато некоторые из них уже можно остановить. Сейчас открываются большие перспективы для лечения моногенных цилиопатий (заболеваний, вызванных мутацией в единственном гене). В нескольких исследованиях показали принципиальную возможность вернуть реснички к рабочему состоянию, доставив обонятельным нейронам корректную версию гена для синтеза ИФТ-88 (один из белков в составе ИФТ-частиц). Интраназальная эктопическая аденовирусная терапия не только помогла улавливать запахи на уровне периферии, но и восстановила аксонные связи в вышележащих отделах анализатора [27], то есть вернула возможность по-настоящему ощущать запах.
Есть и другой пример возможного подхода к лечению. Известно, что на входе в реснички работает центросомальный белок CEP290 (англ. Centrosomal Protein 290, который назван так по своей массе). При некоторых мутациях этот страж ворот становится резко избирательным, не позволяя G-белку занять своё место в сигнальном каскаде. Результат этого вполне ожидаемый — аносмия [28]. Для многих заболеваний проверка обоняния — доступный диагностический признак, как в случае амавроза Лебера — врожденного повреждения сетчатки. Один из 11 типов этого заболевания связан с мутацией CEP290, конкретно — десятый тип. А в марте 2020 года в Nature сообщили о старте «Brilliance» — клинического испытания технологии CRISPR/Cas9. Однократное субретинальное применение препарата должно помочь при лечении амавроза лебера 10 (LCA10) [29]. Наверное, если получится вернуть зрение, то и на возвращение обоняния тоже можно рассчитывать.
У подавляющего большинства с цилиями, к счастью, все в порядке. Что же дальше? Молекула, преодолев слой мукуса и приблизившись к цилиям, окажется в ловушке рецептора, и запустится сигнальный каскад.
Уловить и усилить
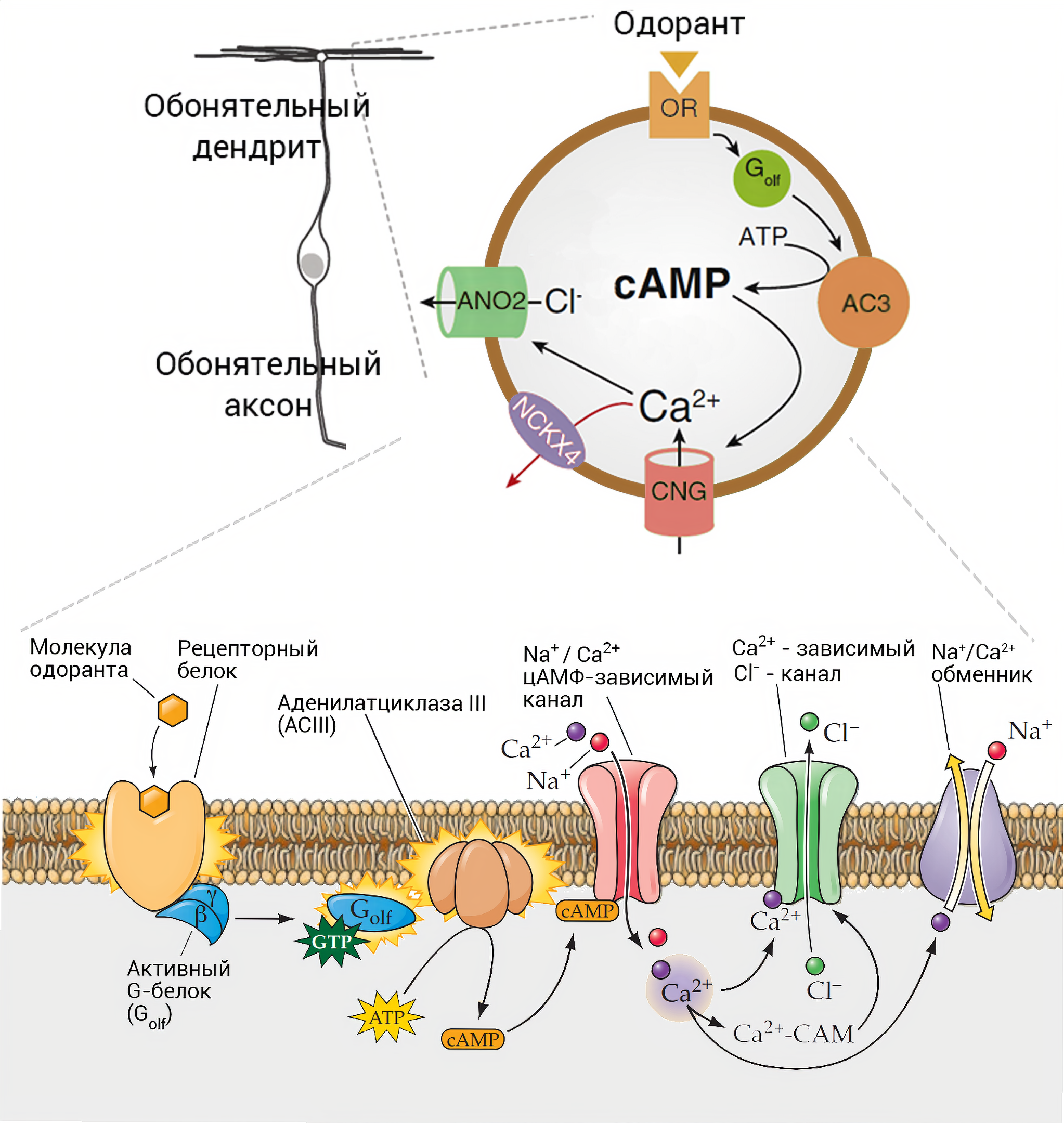
Связывание одоранта с рецептором запускает классический сигнальный каскад циклического аденозиномонофосфата (цАМФ) (рис.7) За активацией рецептора следует активация упомянутого G-белка, специфичного для обоняния — Golf; потом включается аденилатциклаза АЦIII, уровень цАМФ повышается, открываются ионные каналы, потенциал на мембране меняется, и по длинному аксону уходит потенциал действия (рис. 7). Потеря любого ключевого игрока сигнального каскада закономерно приводит к аносмии, но настолько радикальные мутации наблюдают скорее в лабораторных условиях, чем в клинике.
Рисунок 7. Схема обонятельной трансдукции. Связывание молекулы одоранта с рецептором запускает процесс взаимодействия с G-белком, что активирует аденилатциклазу III. Образуется цАМФ, который открывает цАМФ-зависимые каналы. В клетку поступают Ca2+ и Na+. Ca2+ cвязывается с хлорным каналом, через который Cl− выходит из клетки.
адаптировано из [62] и [63]
Каскад вторичного посредника цАМФ — это распространенная в организме схема усиления сигнала. Впрочем, и здесь не без странностей. Внешний мир и обонятельный эпителий разделяют около 15 микрометров мукуса. А на его ионный состав влияет множество факторов, начиная с погоды за окном. Поэтому полагаться на привычный (например, как в зрении) входящий натриевый ток было бы опрометчиво. Альтернатива? Выпускать запасённый хлор Cl−, который активно поступает через белковые транспортеры в резервуар — сому и дендрит нейрона. Получается, кальций, попавший внутрь через неселективный катионный канал CNG (cyclic nucleotide-gated), открывает канал семейства аноктаминов (Anoctamin 2) для выхода хлора. 90% деполяризации нейрона — это выходящий хлорный ток [30]! Исследуя природу рассеянного склероза в одном из крупнейших центров в Швеции, SciLifeLab обнаружили, что у аноктамина-2 и антигена вируса Эпштейна-Барра есть похожие аминокислотные последовательности. Это называется молекулярной мимикрией, которая приводит к перекрёстной реактивности между антителами к каналу и вирусу. Пока предстоит выяснить, как провоцируемая вирусом иммунная реакции вписывается в этиопатогенез рассеянного склероза. Но известно, что канал представлен и в других частях мозга, а обсуждаемых антител в бляшках было подозрительно много. Можно предположить, что потеря обоняния и атака каналов в других областях могут выступать как более ранние диагностические проявления [31]. Вообще, о событиях трансдукции в обонянии известно давно. К 1990-ым годам провели ключевые эксперименты, определяющие роль обонятельного белка Golf и вторичных посредников [32]. Эти исследования и предвосхитили Нобелевскую премию 2004 года: благодаря страстной решительности учёных работа по поиску генов обонятельных рецепторов увенчалась успехом. Как вспоминают, это было поворотным событием в изучении обоняния.
Участвуют сотни
Говорят, чувство юмора — явление расплывчатое. Оно зависит как от наших собственных вкусов и привычек, так и от окружения. Конечно, нашему восприятию запахов не приписывают национальные ярлыки, но с обонянием похожая ситуация. Наши сенсорные клетки умело настраиваются на определённые ароматы: например, учатся быстрее сообщать, что в плите стоит вкусный пирог, или напротив, стараются не замечать некоторые запахи (скажете ли вы сейчас, чем пахнет ваш дом?), а мы сами в течение жизни учимся интерпретировать запахи как приятные или неприятные. Причины этого — в пластичности и субъективности обоняния, которое более других чувств связано с повседневными предпочтениями. Во-первых, запахи вокруг начинают влиять на наше восприятие ещё до рождения [33], [34]. Во-вторых, рецепторов (очень полиморфных) к одорантам почти четыре сотни, что не сравнить с известными со школы тремя видами колбочек. В 1991 году эта цифра, которая, например, для слона в пять раз больше, взволновала научное сообщество. А разговор о первичных запахах на какое-то время свели на нет.
Благодаря кропотливой работе американских учёных Линды Бак и Ричарда Аксель были определены гены, кодирующие одорант-связывающие рецепторы. Их коллега, Стюарт Фиерштайн вспоминает, что открытие генов — это результат упорства Бак, которая поставила на кон многое. Она присоединилась к лаборатории Акселя с однозначной целью — найти эти гены, которые к тому моменту безрезультатно искали несколько групп учёных. Три года работы без публикаций оказались оправданным риском. В недавно изданной книге Smellosophy (от сочетания слов smell — запах и philosophy — философия) можно найти и воспоминания самой Бак о проделанной работе, а также мысли других пионеров в области обоняния и запахов обоняния. Автор книги — историк науки Энн-Софи Барвич, которая собрала материалы о методологических и экспериментальных проблемах в исследованиях обоняния и рассказала историю их развития, начиная с античных времен. В эпиграфе — цитата Линды Бартошук: «Обоняние — это единственное чувство, для которого мы можем создать новый стимул, которого никогда не было на земле, и мы можем его воспринимать» .
«Smell — it’s the only sense for which we can create new stimulus that’s never been on the face of the earth and we can perceive it».
Кому-то это высказывание покажется спорным, но у него есть даже количественные аргументы. Недавно, коллектив из Монелловском Центре по изучению химических чувств и Brain Team из исследовательского подразделения Google сообщили (пока на стадии препринта [35]), что более 30 миллиардов молекул в мире могут быть запахами, а знаем и изучаем мы около 0,000002%! А значит, создавать новые ароматы можно ещё долго.
Пока, правда, непонятно, сколько существует способов сложить из миллиардов одорантов запахи таким образом, чтобы мы их восприняли. В 2014 году в прессе активно обсуждали, что это «больше триллиона» [36]. Однако есть основания подозревать, что это число несколько завышено [37].
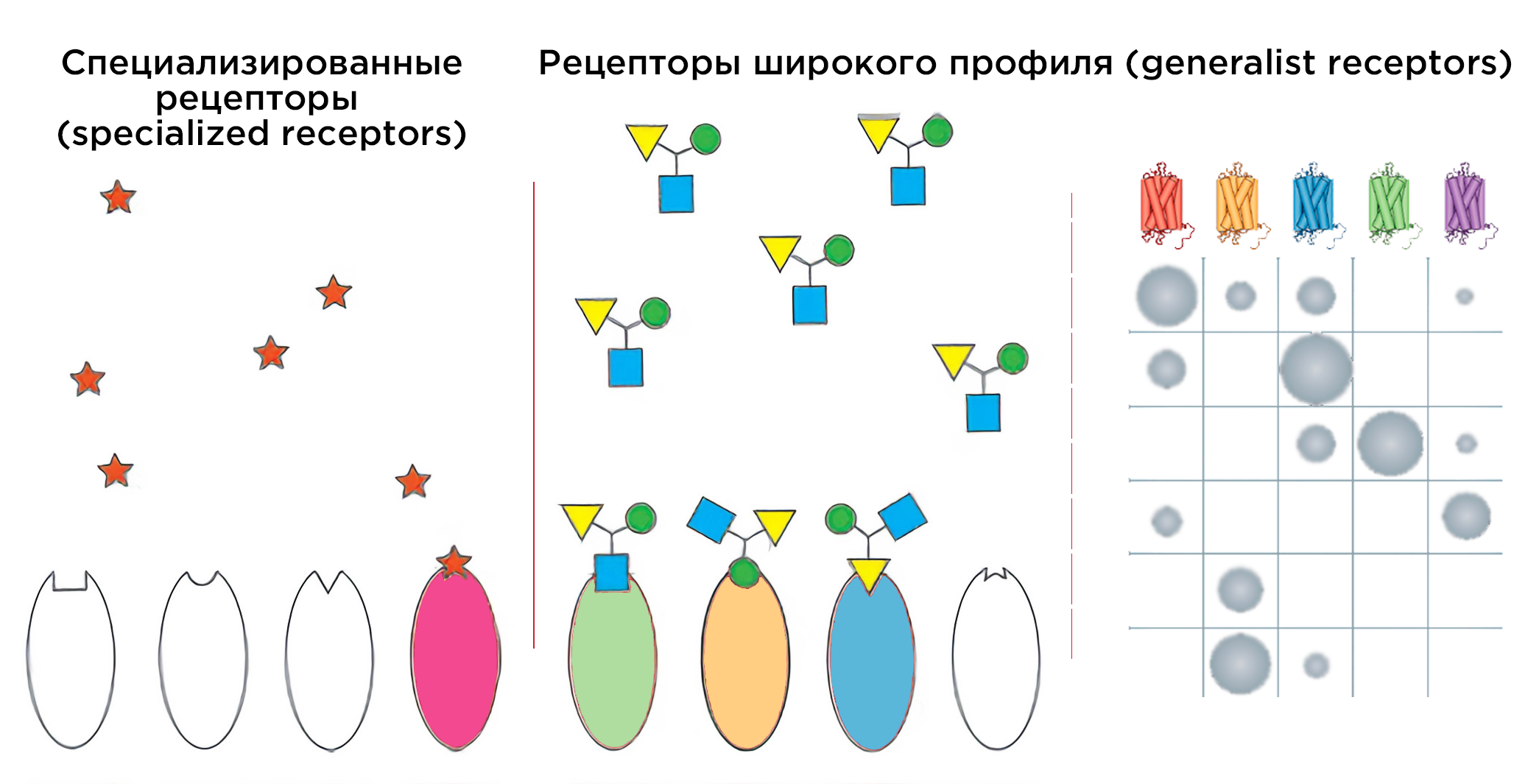
Рисунок 8. Одоранты могут активировать два типа рецепторов. Сигнальные вещества связываются со специализированными рецепторами (specialized receptors). Например, рецептор AgOr1 у малярийных комаров связывает компонент пота человека, 4-метилфенол [64]. В то же время, у другого типа рецепторов (generalist receptors) широкий репертуар связываемых одорантов. Благодаря им и работает комбинаторный принцип обоняния. На схеме справа по горизонтали — гипотетические ответы разных рецепторов на предъявляемые одоранты. Размер круга отражает силу ответа (рецепторные потенциал).
За определением генов последовал и принцип работы рецепторов — комбинаторный. Воспринимаем мы всё-таки гораздо больше, чем 400 запахов. Согласно комбинаторному принципу (рис. 8), молекула активирует несколько рецепторов, а большинство рецепторов реагируют на обширный репертуар одорантов («рецепторов широкого профиля»). Нашли и «рецепторы-специализаторы» для жизненно важных запахов, которые не следуют этому принципу (рис. 8). Но существование таких узконаправленных рецепторов у человека — предмет научного спора.
Ещё в 1967 году Джон Эймур , предрекая рецепторную природу, писал в Nature об избирательных аносмиях (selective/specific anosmia)— невосприимчивости к отдельным одорантам как о возможности разгадать обоняние. По аналогии с дальтонизмом рассчитывали установить первичные запахи и расшифровать обонятельный код [38].
Джон Эймур — один из лидеров науки об обонянии прошлого века. Среди его заслуг — создание стереохимической теории обоняния.
Оказывается, почти все мы аносмики к тем или иным веществам [39]. Однако обнаружить дефекты отдельных рецепторов сложно из-за их широкой настройки и многокомпонентности запахов. Более того, если считается, что сольная активация одного типа рецепторов не определяет запах, то как восприятие зависит от индивидуального набора генов? Выручило разнообразие резких и неприятных запахов вокруг, к которым некоторые оказывались подозрительно терпимы. Основы психофизической оценки масштабы избирательных аносмий заложили давно, а сейчас у нас есть и адекватные методы, чтобы соотнести особенности восприятия с генетической изменчивостью [40].
Самый известный пример — восприимчивость к стероиду андростенону. О том, как она зависит от генотипа рецептора OR7D4, уже писали [41]. От 20 до 30 процентов людей не находят его запах отталкивающими, а для других он будет иметь характерный запах пота. Полезно знать, что если вам явно неприятен запах андростенона, то возможно, и трюфели не вызовут у вас восторга. Считается, что присутствие этого стероида в составе делает из чувствительных к нему свиней умелых охотников. Другой случай: если ваше предложение пообедать блюдом вьетнамской кухни воспринимали с заметным отвращением, то возможно, вам повезло столкнуться с ещё одним частым аллельным вариантом. В составе ставших популярными супов фо есть кинза и кориандр. Это зелень и семена одного растения — Coriandrum sativum. Альдегиды — ключевые компоненты аромата кориандра — детектируются рецепторами по-разному. Полимофизм около гена рецептора OR6A2 связывают с наследственной составляющей неприязни к характерному для этих веществ мыльному запаху и вкусу , [42].
Вкус по большей мере определяется тем, что уловит обонятельный эпителий во время приема пищи. Это известно как обратное, или ретроназальное обоняние.
Удивительно, что часто нарушение функций рецептора меняет качественную оценку запаха, а не порог восприятия. Это, в свою очередь, помогло пересмотреть идею о том, что в обонятельном рецепторе есть нейроны, сообщающие о концентрации вещества. Просто в зависимости от концентрации активируются разные рецепторы. Но это также создает новые вопросы: как же формируется наше эмоциональное отношение к запахам? Между тем, практических последствий у таких исследований больше, чем кажется на первый взгляд. Например, одно из направлений Моннелевского центра — суметь замаскировать противный вкус жизненно важных лекарств. В частности, это исключительно важно при лечении детей. Также неприятный запах из-за метаболитов лекарств полноценно заслуживает упоминания в списке побочных эффектов. Индустрия химической и пищевой промышленности ещё больше ценит понимание коллективных антипатий и ищет способы их скрыть. Предположим, мы удовлетворили праздное любопытство и узнали, что личная неприязнь к меню соседа за столом или к самому соседу происходят из-за генетической изменчивости. Зачем же искать то, что может активировать или блокировать рецепторы? Причин много: например, есть обонятельные рецепторы, которые непосредственно участвуют в нейропередаче!
За рамками «обонятельных»
До этого речь шла только об обонятельных рецепторах из группы OR (odorant, or olfactory receptor). Однако, у человека точно есть ещё один тип рецепторов, которые были открыты в начале века в качестве участников нейромедиаторной системы следовых аминов (trace amines). Эти рецепторы, ассоциированные со следовыми аминами TAARs (trace amine-associated receptors) в носу связывают следующие соединения: триметиламин, путресцин, кадаверин. «Запах тухлой рыбы», «запах гниющего мяса», «самый мерзко пахнущий цветок» (речь идёт о раффлезии), — если бы не они, мы бы не знали таких ощущений. Хотя некоторые могут знать их по-другому. В ноябре сообщили, что в результате полногеномного поиска ассоциаций (Genome-Wide Association Studies) с участием более 9000 тысяч человек нашли вариант гена TAAR5, при котором триметиламин воспринимается как нейтральный или даже «картофельный» аромат. Искали в Исландии, где хаукарль — вяленое ферментированное мясо акулы с высоким содержанием аммиака и триметиламина — признают национальным деликатесом. Так намного легче поверить, что и другие достояния северной кухни, известные содержанием триметиламина — сюрстремминг и лютефиск — не у всех в черном списке [43]. Триметиламин у других видов — сигнальное вещество. Собственно, и наше отвращение — это наглядная иллюстрация тесной связи эмоций и химических стимулов. На таких примерах удобно изучать кодирование «отталкивающих» сигналов. Многие в курсе, что нейронные процессы в основном изучают на грызунах. Но вот интересный феномен — крысы, как и мы, ненавидят триметиламин, а мышей он привлекает!
Как и обещали, рассказываем, что же с там нейромедиаторной системой! В организме образуются и собственные лиганды к TAARs, следовые амины. Только их очень мало, отсюда и название, поэтому до обнаружения рецепторов дискуссии об их роли были не очень продуктивными. За последние двадцать лет TAARs обнаружили в структурах лимбической системы (она оркеструет эмоциональные реакции), базальных ганглиях, ретикулярной формации и других зонах. Сейчас ясно, что рецепторы вовлечены в работу дофаминовой, серотониновой систем, а также в процессы нейрогенеза. Это не только фундаментальные знания, но и реальный шаг к созданию новых лекарственных средств. Рецепторы следовых аминов активно исследуют в Институте трансляционной биомедицины СПбГУ под руководством Рауля Гайнетдинова. Одна из последних работ учёных лишний раз демонстрирует глубокую и недооценённую связь обоняния и физиологии. Оказалось, в основе положительного (антидепрессивного) действия антагонистов TAAR5 лежат непростые отношения обоняния и центральных структур, в которых присутствует этот рецептор [44]! Помимо возможного вклада в нейрохимию и фармакологию, эта работа неожиданным образом раскрывает и потенциал ароматерапии. Среди известных блокаторов рецептора TAAR5 числится Тимберол — синтетическое вещество с хвойным запахом, активно используемое в парфюмерии. В начале века почти одновременно с TAARs (их обнаружили в 2001 году), узнали и о существовании канонических обонятельных рецепторов в других тканях. Решают они, правда, более конкретные задачи. Вот в 2003 году в Science пишут о первом случае эктопической (от греч. еktos — вне и topos — место) экспрессии обонятельных рецепторов, т. е. за пределами свойственного им эпителия носа. Оказалось, что на мембране сперматозоидов есть рецептор hOR17-4 (OR1D2), участвующий в хемотаксисе при оплодотворении. А один из его агонистов — пахнущий ландышем бурженаль (bourgeonal) [45]. Новость растиражировали в медиапространстве с ожидаемым заголовками, не нуждающимися в цитировании. Сейчас известно, что бурженаль — единственный одорант, который мужчины детектируют при меньших концентрациях, чем женщины. (Про природу различий остроты нюха можно прочесть в PubMed [46]). Пусть пока это просто занимательный факт, но есть вероятность, что ему найдётся применение и в клинике — ухудшение нюха по отношению к бурженалю наблюдают в некоторых случаях идиопатического бесплодия [47].
Вообще, «обонятельных» рецепторов за пределами носа довольно много [48]. Это неудивительно, ведь по сути обоняние — это вид хеморецепции. Удобно использовать компоненты этой системы там, где требуется решить задачу распознавания малых молекул. Функциональный характер у рецепторов пока нашли не во всех тканях (а это тимус, поджелудочная железа, кожа, мышцы, сердце, печень, мозг). Но также, как и в случае с TAARs, за открытием агонистов и антагонистов следует создание новых эффективных средств. Например, рецептор OR2AT4 в кератиноцитах и волосяных фолликулах реагирует на терпеноид сандалового дерева, потенциально становясь новым средством для ускорения заживления шрамов и активации роста волос [49]. Но на этом хочется остановиться — о разнообразии рецепторов и их функций можно говорить долго. Возвращаемся к основной функции — обонятельной. Напрашивается закономерной вопрос: как именно нейроны выбирают себе рецепторы? Точнее, один тип рецептора из нескольких сотен.
Один нейрон – один рецептор
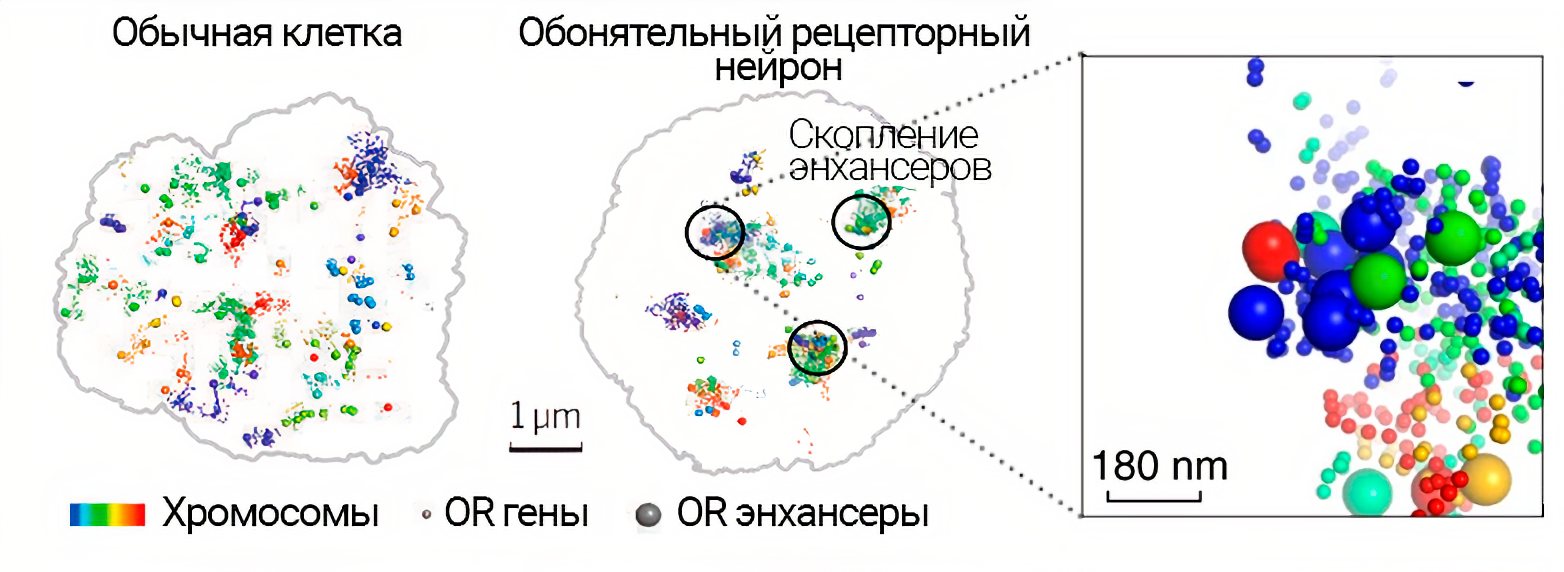
Вслед за поворотной работой 1991 года, оба будущих Нобелевских лауреата продолжили (и продолжают сейчас) исследовать нюх. Стало понятно, что если бы на мембране нейрона сидели множество разных типов рецепторов, то нейронный ответ на смесь запахов превратился бы в какофонию. Интуитивный принцип «один нейрон — один рецептор» был вскоре доказан сотрудником лаборатории Акселя. Вот только гены обонятельных рецепторов встречаются на каждой, кроме 20 и Y хромосомах [50]! Получается, что для выбора одного аллеля одного гена рецептора привлекается большое число удалённых участков генома. То, как эти контакты организуются в клетке, изучает 3D-эпигеномика, но сложные межхромосомные взаимодействия пока понимают не до конца [51]. Несколько лет назад появились данные об участии в эпигенетической регуляции «… греческих островов: Липcи, Сфактерия, Крит, Родос…». Такое оригинальное название дали ключевым обонятельным энхансерам (регуляторные модули, активирющие транскрипцию генов). Про участие других регуляторных элементов недавно писали в Nature [52], [53]. В 2019 году главный приз ежегодной премии для молодых учёных, учреждённой Science и SciLifeLab, вручили за усовершенствование метода изучения организации хроматина: Hi-C, один из методов определения конформации хроматина, применили к индивидуальным диплоидным клеткам [54]. С помощью этого нового метода Dip-C (diploid chromosome conformation capture) визуализировали, как активные обонятельные гены взаимно подавляют транскрипцию остальных (рис. 9), [55].
Рисунок 9. Межхромосомная агрегация генов обонятельных рецепторов OR (odorant receptors) и их энхансеров, построенная по данным метода Dip-C. Хромосомы обозначены разными цветами. Отдельно вынесена увеличенная визуализация наиболее плотного скопления генов OR и энхансеров: разные цвета обозначают принадлежность разным хромосомам; малые сферы представляют гены, а сферы с большим диаметром — энхансеры.
адаптировано из [66]
Свой рецептор (собранный из двух наборов хромосом) нейрон выбирает во время созревания. Это своеобразный «код принадлежности» нейрона. И он использует его дважды: рецепторы экспрессируются не только на цилиях, распознавая молекулы одорантов, но и на аксоне!
ГЛАВА III. Куда ведут нейроны?
Неразборчивая картография
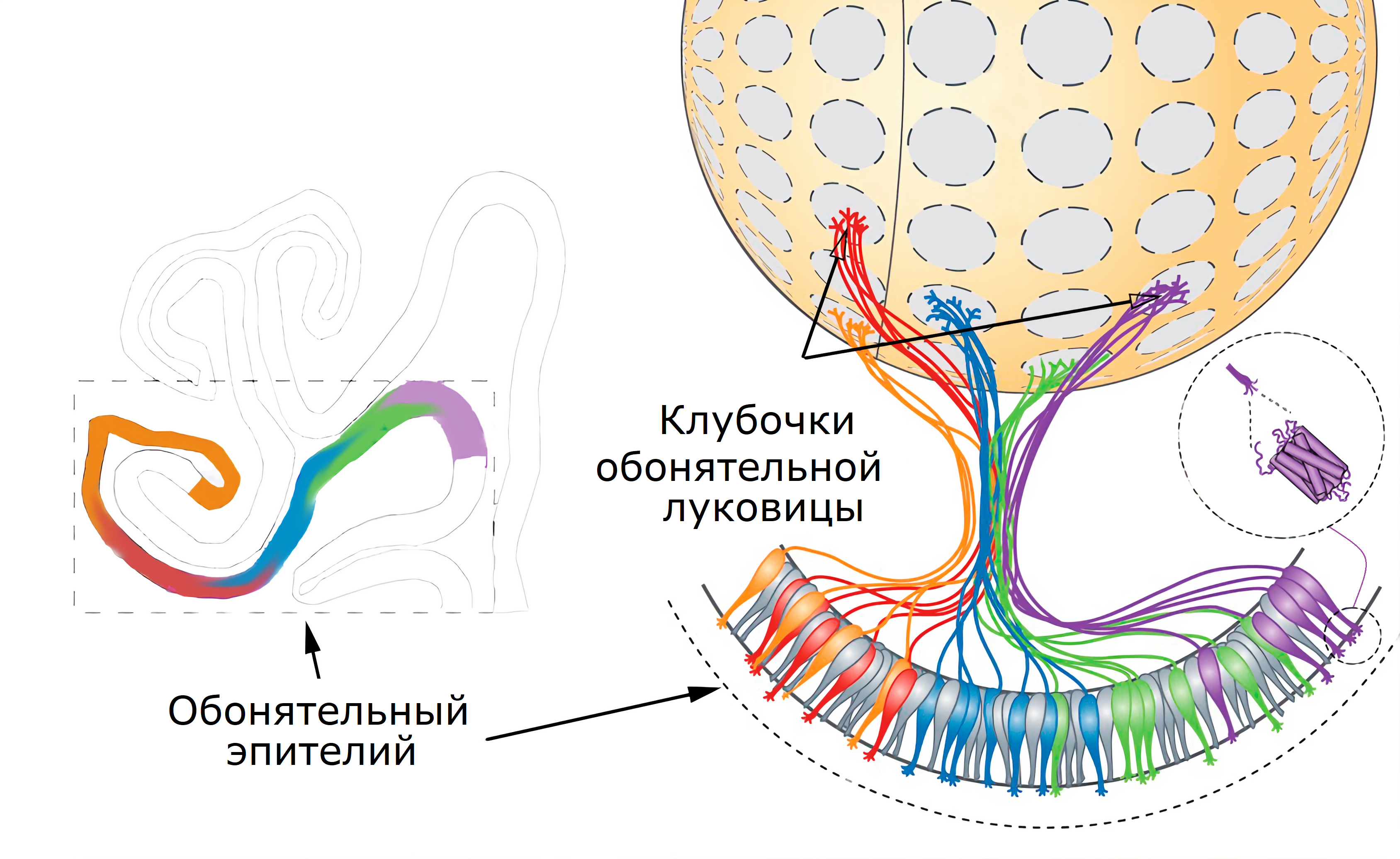
Аксоны нейронов с одинаковыми обонятельными рецепторами встречаются в обонятельном клубочке, или гломеруле. Гломерулы — это составные единицы обонятельной луковицы (рис 10). На смесь запахов (которые мы называем одним словом: кофе, какао и т.д) реагируют определённые комбинации гломерул. Такие перекрывающиеся схемы активации называют «картами запахов», или «отпечатком запаха» (англ. «odor maps», или «odor images»).
Рисунок 10. Схематическое изображение аксонов нескольких нейронов с одинаковыми обонятельными рецепторами, собранных в одном клубочке (гломеруле) обонятельной луковицы. Окраска обонятельного эпителия в носовых пазухах (рис. 11) отражает перекрывающиеся зоны экспрессии — рецепторы случайно занимают положение в пределах этих зон (т.е. они всё-таки следуют некоторым правилам топографической организации).
адаптировано из [66] и [67]
Нейроны с разными типами рецепторов в эпителии перемешаны, а ещё они постоянно обновляются. Как же тогда аксоны находят своих будущих соседей? Поиск своего клубочка задействует механизмы аксонального наведения (англ. axon guidance), в котором белки обонятельных рецепторов на аксонах и есть главные ориентиры. Изящное решение, но процесс этот довольно сложный. Много разных молекул участвует в формировании мозаики обонятельной луковицы: протокадегрины, цАМФ, белок ОМР — маркер обонятельных нейронов — и прочие компоненты. Эксперименты на мышах показывают, что потеря некоторых из них может нарушить правильную сортировку аксонов по клубочкам. Все детали ещё предстоит выяснить, но вклад вносят не только молекулярные взаимодействия. По дороге к клубочкам длинные аксоны нейронов пересекают продырявленную пластинку решётчатой кости (рис 11). Они проходят через неё в составе пучков, окружённых обволакивающими глиальными клетками (это и есть обонятельный нерв). К сожалению, «перерезка» аксонов костью при травмах головы грозит серьезными последствиями — аносмией или значительной гипосмией. Причина в том, что новые созревающие нейроны больше не могут добраться до гломерул обонятельной луковицы: им необходим «каркас» из существующих нейронов, который и разрушается при механических повреждениях.
Поиск своих позиций нейронами в процессе эмбриогенеза осуществляется ещё более запутанным путём, поэтому не станем описывать весь процесс в деталях. Но рассказывая об аносмии, нельзя не упомянуть одноименный гликопротеин — аносмин-1 (ген ANOS1). Раньше этот ген называли KAL1 — по синдрому Кальмана. Это заболевание, при котором нарушается половое созревание и развивается аносмия. Какая между ними связь? Нейроны, которые будут секретировать гонадотропин-рилизинг-гормон в гипоталамусе, добираются туда из обонятельной плакоды (производное эктодермы, из которой образуется обонятельный эпителий носа). Недавно удалось выяснить, что аносмин-1 — критический участник ангиогенеза в обонятельной луковице. Но ANOS1 — это один из 25 страдающих при синдроме Кальмана генов [52].
В клубочке сигнал с аксонов передаётся на дендриты митральных и пучковых клеток. Они потом отправят информацию о запахе на пирамидные клетки обонятельной коры. Схема работы обонятельной луковицы значительно усложняется из-за тормозных влияний клеток (перигломерулярных, клеток-зерен) и возвратных проекций (рис. 11).
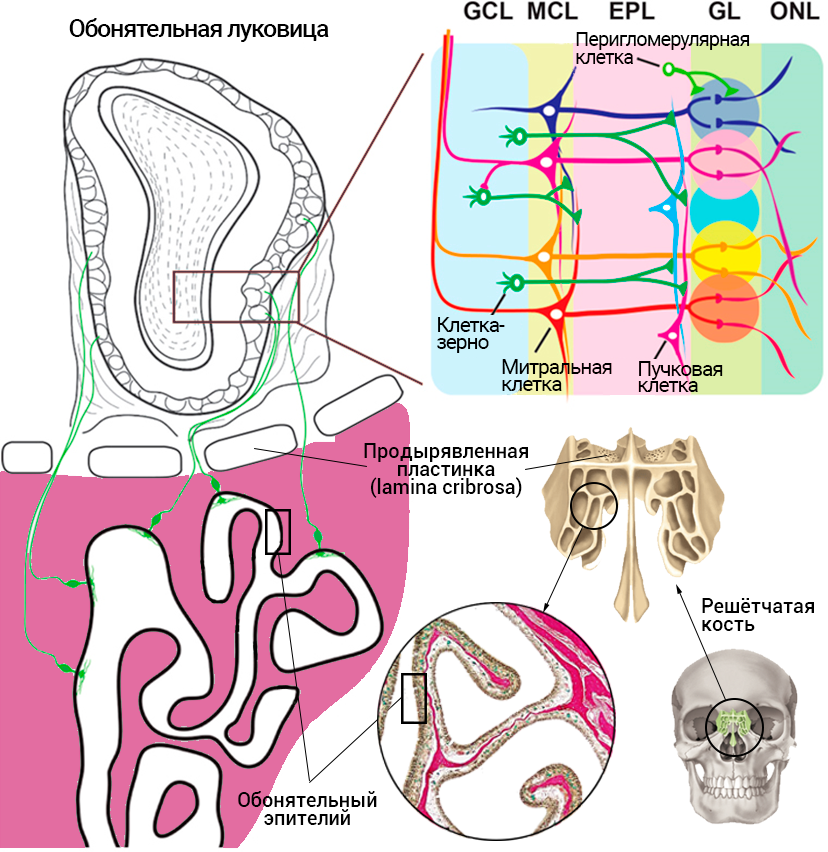
Рисунок 11. Относительное расположение решетчатой кости, обонятельного эпителия на гребнеобразных выростах решетчатой кости, носовые ходы/пазухи с выстилкой обонятельного эпителия (окраска по Ван-Гизону). Также на иллюстрации изображены аксоны обонятельных нейронов, поднимающиеся через продырявленную пластинку к обонятельной луковице. Сверху справа — схема нейронных связей в обонятельной луковице. На ней отмечены митральные и пучковые клетки — их дендриты идут из гломерул, а также изображены перигломерулярные и клетки-зерна, которые образуют синапсы с митральными и пучковыми клетками.
адаптировано из [68] и с сайта MedMule
Кажется, что если строение луковицы принципиально не нарушено, то обонятельный сигнал хоть как-то пойдет по системе дальше? Но не в том случае, если необходимый возбуждающий глутамат не выделяется из аксонных терминалей обонятельных нейронов.
Анальгетик с побочным эффектом
В 2006 году в Nature публикуют статью, которая вызвала ажиотаж среди крупнейших игроков фарминдустрии [56]. Предыстория у исследования была не менее захватывающей — её героем стал уличный артист из Пакистана, который мог ходить по горящим углям. Выяснили, что в его семье распространена мутация в гене SCN9A, кодирующем натриевый канал Nav1.7, которая нарушает проведение ноцицептивных (болевых) сигналов. А позже оказалось, что вместе с потерей болевых ощущений (полной!) приходит и аносмия: этот канал необходим для выделения медиатора в синапсе обонятельных нейронов. Удивительно, что парой лет раньше узнали о мутации этого гена с усилением функции (gain-of-function) и противоположным эффектом — болевой сверхчувствительностью и предполагаемой гиперосмией!
ГЛАВА IV. Заключительная
К чему ведут запахи?
Неудивительно, что мифы о простоте и примитивности обонятельного анализатора ещё с прошлого века не выдерживали критики. Организация обонятельных нейронных сетей интересовала и нобелевского лауреата Эдгара Д. Эдриана. А Уилфрид Ралл и Гордон Шеперед, стоящие у истоков вычислительной нейробиологии, проводили свои пионерские работы на обонятельной луковице [57].
Обонятельная информация из луковицы проходит через различные перипетии, попадая в лимбическую систему, миндалину, орбитофронтальную кору. Пути усложняются ещё больше, если запахи проходят «ретроназально», т. е. обратным путём, как это происходит с напитками и едой. Хочется надеяться, что в будущем кто-то возьмет на себя смелость рассказать о том, что известно о нейронных сетях обоняния за последние полвека. Интересно ведь узнать, как кофе приобретает свой аромат и почему прустовские мадленки появляются в каждом втором тексте о запахах и вкусах? Про многие необычные обонятельные нарушения известно намного меньше, а это — фантосмия (обонятельные галлюцинации), какосмия (навязчивое ощущение неприятных запахов), паросмия (нарушение интерпретации запахов) и другие расстройства. (Кстати, вы правы, если подозревали, что слово «аносмия» связано с носом только по сути. В его основе греческий корень «osme» — запах и приставка «an»). Почему понять работу обоняния так непросто? Много чисто технических причин. Во-первых, когда только обнаружили гены, казалось, что скоро будет доступен весь список пар рецептор—лиганд. Оказалось, что рецепторы очень неохотно занимают место на мембранах в несвойственных им клетках (большинство нуждается в специальных белковых проводниках [58]. Во-вторых, по сравнению со зрительными экспериментами, контролировать подачу запахов куда сложнее. Вдобавок к этому, адаптация к запахам наступает очень быстро. Это явление привыкания, которое нам известно на бытовом уровне, и оно сильно ограничивает время экспериментов. И ещё одно: грантовые организации долгое время с недоверием смотрели на исследования обоняния, пренебрегая их значением. К сожалению, это гармонирует и со взглядами широкой публики. В одном из опросов 2011 года половина молодых людей ответила, что охотнее готовы расстаться с обонянием, чем с техникой (подробнее читайте в статье The Truth About Youth на странице 6). Полиморфные гены, постоянная перестройка сетей под новые запахи — всё ведет к одному результату: мы исключительно субъективно воспринимаем ароматы (представьте тысячи вариантов сине-черно-бело-золотого платья). Так ведь даже интереснее! Стоит понимать, что некоторые споры про вкус и запах разрешить в бытовых условиях не получится. И не нужно забывать, что среди нас живут те, кто не только оказывается лишен ежедневных аромаудовольствий, но и могут оказаться перед лицом серьезных заболеваний.
Стоит признать, многие важные вопросы остались за кадром. Почему работает васаби-будильник, заслуживший Игнобелевскую премию 2011 года? «Запахи» узнаёт не только обонятельный нерв, но также и тройничный! Аллилизотиоцианат васаби (это вещество есть и в горчице) связывается с ваниллоидными рецепторами соматосенсорных нейронов в обонятельной полости [58]. Благодаря тройничной иннервации мы определяем раздражающие, а также тёплые и холодные запахи. А про неосознаваемое влияние одорантов мы знаем ещё меньше.
На заре оцифровки
Монеллевский центр (США), который упоминался несколько раз, — один из ведущих центров по изучению химических чувств. Они стараются помогать аносмикам и развивают как фундаментальные, так и практические направления. А вот исследовательская группа института Вейцмана (Израиль) делает всё возможное, чтобы мы не только были с обонянием на «ты», но и научились управлять запахами. Например, в 2012 году они смогли создать «белый запах» — несколько неповторяющихся комбинаций из более 30 компонентов испытуемые определяли как одинаковый неидентифицируемый запах. Предлагали применять его для маскировки неприятных ароматов. Кажется, это пригодилось бы не только авиакомпаниям, периодически возвращающимся самолеты на проветривание. Ещё они научились «измерять запахи». Статья, недавно опубликованная в Nature, намекает на стремительное приближение пахнущих сообщений и фотографий (можно прочитать краткую выжимку из статьи от авторов). Из-за стволовых клеток обонятельную систему любят разбирать на запасные части [59]. Ещё её эксплуатируют как модельный объект. Но, к счастью, есть и желающие помочь людям, лишившимся обоняния или никогда не знавших о запахах. А для всех тех, кто не верит в роль запахов, Рэндалл Рид, один из ведущих нейробиологи обоняния, напоминает: пить кофе с крышкой на стакане почти как вино через соломинку — затея сомнительная, ведь упускаются ценные ароматы. Если загадки обоняния вас несколько заинтересовали, то можно обратиться к недавно переведённой книге профессора Паоло Пелоси, одного из последователей Джона Эймура: «Обоняние. Увлекательное погружение в науку о запахах» [60]. Среди детективных историй от первого лица и живых научно-насыщенных описаний механизмов обоняния разных видов есть вопросы, которые достойны особого внимания: поводы вернуться к обонянию представятся ещё не раз.
За помощь в подготовке иллюстраций автор выражает благодарность Глебу С. Русину.
- Jessica Freiherr, Amy R. Gordon, Eva C. Alden, Andrea L. Ponting, Monica F. Hernandez, et. al.. (2012). The 40-item Monell Extended Sniffin’ Sticks Identification Test (MONEX-40). Journal of Neuroscience Methods. 205, 10-16;
- N. Aguilar Martínez, G. Aguado Carrillo, P.E. Saucedo Alvarado, C.A. Mendoza García, A.L. Velasco Monroy, F. Velasco Campos. (2018). Clinical importance of olfactory function in neurodegenerative diseases. Revista Médica del Hospital General de México. 81, 268-275;
- Loïc Briand, Corinne Eloit, Claude Nespoulous, Valérie Bézirard, Jean-Claude Huet, et. al.. (2002). Evidence of an Odorant-Binding Protein in the Human Olfactory Mucus: Location, Structural Characterization, and Odorant-Binding Properties†. Biochemistry. 41, 7241-7252;
- Guangfa Wang, Yushu Li, Zhenzhen Cai, Xincun Dou. (2020). A Colorimetric Artificial Olfactory System for Airborne Improvised Explosive Identification. Adv. Mater.. 32, 1907043;
- Giorgia Sollai, Melania Melis, Salvatore Magri, Paolo Usai, Thomas Hummel, et. al.. (2019). Association between the rs2590498 polymorphism of Odorant Binding Protein (OBPIIa) gene and olfactory performance in healthy subjects. Behavioural Brain Research. 372, 112030;
- Masashi Asakawa, Yosuke Fukutani, Aulaphan Savangsuksa, Keiich Noguchi, Hiroaki Matsunami, Masafumi Yohda. (2017). Modification of the response of olfactory receptors to acetophenone by CYP1a2. Sci Rep. 7;
- Jean-Marie Heydel, Alexandra Coelho, Nicolas Thiebaud, Arièle Legendre, Anne-Marie Le Bon, et. al.. (2013). Odorant-Binding Proteins and Xenobiotic Metabolizing Enzymes: Implications in Olfactory Perireceptor Events. Anat. Rec.. 296, 1333-1345;
- 12 методов в картинках: протеомика;
- Adrien François, Denise Grebert, Moez Rhimi, Mahendra Mariadassou, Laurent Naudon, et. al.. (2016). Olfactory epithelium changes in germfree mice. Sci Rep. 6;
- Kristi Biswas, Brett Wagner Mackenzie, Charlotte Ballauf, Julia Draf, Richard G. Douglas, Thomas Hummel. (2020). Loss of bacterial diversity in the sinuses is associated with lower smell discrimination scores. Sci Rep. 10;
- Kaisa Koskinen, Johanna L. Reichert, Stefan Hoier, Jochen Schachenreiter, Stefanie Duller, et. al.. (2018). The nasal microbiome mirrors and potentially shapes olfactory function. Sci Rep. 8;
- Alison Abbott. (2020). Are infections seeding some cases of Alzheimer’s disease?. Nature. 587, 22-25;
- Andreas Natsch, Roger Emter. (2020). The specific biochemistry of human axilla odour formation viewed in an evolutionary context. Phil. Trans. R. Soc. B. 375, 20190269;
- Jan Havlíček, Jamie Winternitz, S. Craig Roberts. (2020). Major histocompatibility complex-associated odour preferences and human mate choice: near and far horizons. Phil. Trans. R. Soc. B. 375, 20190260;
- Нос и язык, которым нужны батарейки;
- P. Pelosi. (2001). The role of perireceptor events in vertebrate olfaction. CMLS, Cell. Mol. Life Sci.. 58, 503-509;
- Federica Genovese, Marco Tizzano. (2018). Microvillous cells in the olfactory epithelium express elements of the solitary chemosensory cell transduction signaling cascade. PLoS ONE. 13, e0202754;
- David H. Brann, Tatsuya Tsukahara, Caleb Weinreb, Marcela Lipovsek, Koen Van den Berge, et. al.. (2020). Non-neuronal expression of SARS-CoV-2 entry genes in the olfactory system suggests mechanisms underlying COVID-19-associated anosmia. Sci.Adv.. 6, eabc5801;
- Leon Fodoulian, Joël Tuberosa, Daniel Rossier, Madlaina Boillat, Chenda Kan, et. al.. (2020). SARS-CoV-2 Receptors and Entry Genes Are Expressed in the Human Olfactory Neuroepithelium and Brain. iScience. 23, 101839;
- Sandra Pfister, Tamara Weber, Wolfgang Härtig, Cornelia Schwerdel, Rebecca Elsaesser, et. al.. (2015). Novel role of cystic fibrosis transmembrane conductance regulator in maintaining adult mouse olfactory neuronal homeostasis. J. Comp. Neurol.. 523, 406-430;
- Pfister S. Orchestrates Multiple Signaling Cascades in Microvillar Cells to Regulate Olfactory Epithelial Homeostasis. Zürich, 2014;
- Keith G. Kozminski. (2012). Intraflagellar transport—the “new motility” 20 years later. MBoC. 23, 751-753;
- Joel L. Rosenbaum, George B. Witman. (2002). Intraflagellar transport. Nat Rev Mol Cell Biol. 3, 813-825;
- Jeremy F. Reiter, Michel R. Leroux. (2017). Genes and molecular pathways underpinning ciliopathies. Nat Rev Mol Cell Biol. 18, 533-547;
- Heather M Kulaga, Carmen C Leitch, Erica R Eichers, Jose L Badano, Alysa Lesemann, et. al.. (2004). Loss of BBS proteins causes anosmia in humans and defects in olfactory cilia structure and function in the mouse. Nat Genet. 36, 994-998;
- Nathalie Falk, Marlene Lösl, Nadja Schröder, Andreas Gießl. (2015). Specialized Cilia in Mammalian Sensory Systems. Cells. 4, 500-519;
- Warren W. Green, Cedric R. Uytingco, Kirill Ukhanov, Zachary Kolb, Jordan Moretta, et. al.. (2018). Peripheral Gene Therapeutic Rescue of an Olfactory Ciliopathy Restores Sensory Input, Axonal Pathfinding, and Odor-Guided Behavior. J. Neurosci.. 38, 7462-7475;
- D. P. McEwen, R. K. Koenekoop, H. Khanna, P. M. Jenkins, I. Lopez, et. al.. (2007). Hypomorphic CEP290/NPHP6 mutations result in anosmia caused by the selective loss of G proteins in cilia of olfactory sensory neurons. Proceedings of the National Academy of Sciences. 104, 15917-15922;
- Heidi Ledford. (2020). CRISPR treatment inserted directly into the body for first time. Nature. 579, 185-185;
- Johannes Reisert, Jürgen Reingruber. (2019). Ca2+-activated Cl− current ensures robust and reliable signal amplification in vertebrate olfactory receptor neurons. Proc Natl Acad Sci USA. 116, 1053-1058;
- Katarina Tengvall, Jesse Huang, Cecilia Hellström, Patrick Kammer, Martin Biström, et. al.. (2019). Molecular mimicry between Anoctamin 2 and Epstein-Barr virus nuclear antigen 1 associates with multiple sclerosis risk. Proc Natl Acad Sci USA. 116, 16955-16960;
- D. Jones, R. Reed. (1989). Golf: an olfactory neuron specific-G protein involved in odorant signal transduction. Science. 244, 790-795;
- B. Schaal. (2000). Human Foetuses Learn Odours from their Pregnant Mother’s Diet. Chemical Senses. 25, 729-737;
- Ximena Ibarra-Soria, Thiago S Nakahara, Jingtao Lilue, Yue Jiang, Casey Trimmer, et. al.. (2017). Variation in olfactory neuron repertoires is genetically controlled and environmentally modulated. eLife. 6;
- Emily J. Mayhew, Charles J. Arayata, Richard C. Gerkin, Brian K. Lee, Jonathan M. Magill, et. al. Drawing the Borders of Olfactory Space — Cold Spring Harbor Laboratory;
- C. Bushdid, M. O. Magnasco, L. B. Vosshall, A. Keller. (2014). Humans Can Discriminate More than 1 Trillion Olfactory Stimuli. Science. 343, 1370-1372;
- Richard C Gerkin, Jason B Castro. (2015). The number of olfactory stimuli that humans can discriminate is still unknown. eLife. 4;
- J. E. AMOORE. (1967). Specific Anosmia: a Clue to the Olfactory Code. Nature. 214, 1095-1098;
- I. Croy, S. Olgun, L. Mueller, A. Schmidt, M. Muench, et. al.. (2016). Spezifische Anosmie als Prinzip olfaktorischer Wahrnehmung. HNO. 64, 292-295;
- John E. Amoore, Delpha Venstrom, Alfred R. Davis. (1968). Measurement of Specific Anosmia. Percept Mot Skills. 26, 143-164;
- Загадка мужественного запаха;
- Nicholas Eriksson, Shirley Wu, Chuong B Do, Amy K Kiefer, Joyce Y Tung, et. al.. (2012). A genetic variant near olfactory receptor genes influences cilantro preference. Flavour. 1;
- Rosa S. Gisladottir, Erna V. Ivarsdottir, Agnar Helgason, Lina Jonsson, Nanna K. Hannesdottir, et. al.. (2020). Sequence Variants in TAAR5 and Other Loci Affect Human Odor Perception and Naming. Current Biology. 30, 4643-4653.e3;
- Stefano Espinoza, Ilya Sukhanov, Evgeniya V. Efimova, Alena Kozlova, Kristina A. Antonova, et. al.. (2020). Trace Amine-Associated Receptor 5 Provides Olfactory Input Into Limbic Brain Areas and Modulates Emotional Behaviors and Serotonin Transmission. Front. Mol. Neurosci.. 13;
- M. Spehr. (2003). Identification of a Testicular Odorant Receptor Mediating Human Sperm Chemotaxis. Science. 299, 2054-2058;
- Lisa Stowers, Darren W Logan. (2010). Sexual dimorphism in olfactory signaling. Current Opinion in Neurobiology. 20, 770-775;
- C. Sinding, E. Kemper, P. Spornraft-Ragaller, T. Hummel. (2013). Decreased Perception of Bourgeonal May Be Linked to Male Idiopathic Infertility. Chemical Senses. 38, 439-445;
- Désirée Maßberg, Hanns Hatt. (2018). Human Olfactory Receptors: Novel Cellular Functions Outside of the Nose. Physiological Reviews. 98, 1739-1763;
- Sung-Joon Lee, Inge Depoortere, Hanns Hatt. (2019). Therapeutic potential of ectopic olfactory and taste receptors. Nat Rev Drug Discov. 18, 116-138;
- Tsviya Olender, Doron Lancet, Daniel W Nebert. (2008). Update on the olfactory receptor (OR) gene superfamily. Human Genomics. 3, 87;
- Suhn K. Rhie, Shannon Schreiner, Heather Witt, Chris Armoskus, Fides D. Lay, et. al.. (2018). Using 3D epigenomic maps of primary olfactory neuronal cells from living individuals to understand gene regulation. Sci. Adv.. 4, eaav8550;
- Shoko Matsushima, Akio Shimizu, Manami Kondo, Hirotsugu Asano, Nobuhiro Ueno, et. al.. (2020). Anosmin-1 activates vascular endothelial growth factor receptor and its related signaling pathway for olfactory bulb angiogenesis. Sci Rep. 10;
- Kevin Monahan, Adan Horta, Stavros Lomvardas. (2019). LHX2- and LDB1-mediated trans interactions regulate olfactory receptor choice. Nature. 565, 448-453;
- Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра;
- Longzhi Tan. (2019). Three-dimensional genome structure of a single cell. Science. 366, 964-965;
- Katie Kingwell. (2019). Nav1.7 withholds its pain potential. Nat Rev Drug Discov;
- James J. Cox, Frank Reimann, Adeline K. Nicholas, Gemma Thornton, Emma Roberts, et. al.. (2006). An SCN9A channelopathy causes congenital inability to experience pain. Nature. 444, 894-898;
- Gordon M. Shepherd. (2018). Wilfrid Rall. Neuroinform. 16, 151-152;
- Geoffrey Raisman, Ying Li. (2007). Repair of neural pathways by olfactory ensheathing cells. Nat Rev Neurosci. 8, 312-319;
- Пелоси П. Обоняние. Увлекательное погружение в науку о запахах. КоЛибри, 2020. — 304 c.;
- Wilson-Pauwels L., Stewart P., Akesson E.J., Spacey S.D. Cranial Nerves: Function and Dysfunction. People’s Medical Publishing House, 2010. 3rd Edition;
- Christopher H. Ferguson, Haiqing Zhao. (2016). Cyclic AMP Signaling in the Main Olfactory Epithelium. Chemosensory Transduction. 123-140;
- Purves D., Augustine G.J., Fitzpatrick D., Hall W., LaMantia A.-S. Neuroscience. Sunderland, Massachusetts. : Sinauer Associates, Inc., 2012. 5th Edition;
- Elissa A. Hallem, A. Nicole Fox, Laurence J. Zwiebel, John R. Carlson. (2004). Mosquito receptor for human-sweat odorant. Nature. 427, 212-213;
- Shannon DeMaria, John Ngai. (2010). The cell biology of smell. Journal of Cell Biology. 191, 443-452;
- Longzhi Tan, Dong Xing, Nicholas Daley, X. Sunney Xie. (2019). Three-dimensional genome structures of single sensory neurons in mouse visual and olfactory systems. Nat Struct Mol Biol. 26, 297-307;
- K. Miyamichi. (2005). Continuous and Overlapping Expression Domains of Odorant Receptor Genes in the Olfactory Epithelium Determine the Dorsal/Ventral Positioning of Glomeruli in the Olfactory Bulb. Journal of Neuroscience. 25, 3586-3592;
- Fumiaki Imamura, Sanae Hasegawa-Ishii. (2016). Environmental Toxicants-Induced Immune Responses in the Olfactory Mucosa. Front. Immunol.. 7.
Neural Crest and Placodes
Jun Suzuki, Noriko Osumi, in Current Topics in Developmental Biology, 2015
6.4 Olfactory receptor neurons
ORNs are bipolar transduction cells in the OE that transmit olfactory information to the brain. In the classic view, all the ORNs are derived solely from placode cells (Whitfield, 2013). Recent reports show that the NCCs can give rise to microvillous neurons in the zebrafish olfactory system (Saxena, Peng, & Bronner, 2013). In the zebrafish OE, there are two main types of ORNs: ciliated sensory neurons that detect volatile or easily evaporated substances, and microvillous sensory neurons that detect pheromones and nucleotides (Saxena et al., 2013). Using a Sox10:eGFP line and photoconversion, the authors showed that microvillous neurons are derived from the NC, and that placode cells cannot compensate for the loss of NC-derived neurons. In mice, occasionally labeled ORNs have been identified in Wnt1-Cre/Floxed-YFP (Forni et al., 2011) and P0-Cre/Floxed-LacZ mice (Katoh et al., 2011) under normal physiological conditions. Furthermore, the percentage of NC-derived mORNs was significantly increased during OE regeneration caused by methimazole administration (Fig. 3) (Suzuki et al., 2013). Methimazole is a drug used in the treatment of hyperthyroidism which functions by inhibiting the enzyme thyroperoxidase that acts in thyroid hormone synthesis. Methimazole also exhibits an olfactory toxicity in rodents and causes OE degeneration and regeneration (Fletcher et al., 2011; Genter, Deamer, Blake, Wesley, & Levi, 1995). Following methimazole administration, most olfactory cells except for the basal cells in the OE die within 24 h. Shortly thereafter, the OE gradually begins to regenerate and the tissue is nearly completely recovered by 30 days postinjury (dpi) (Fig. 3B–E). Interestingly, the incidence of NC-derived ORNs significantly increased in the regenerated OE (Fig. 3F–F‴). This result suggests that NC-derived stem cells have an important role to play in regenerating ORNs. Presently, there are no reports that have investigated the differences between NC-derived ORNs and placode-derived ORNs. Moreover, we still do not know whether regenerated NC-derived ORNs function normally. If NC-derived ORNs function correctly, NC-derived stem cells could be a major target for the treatment of olfaction disorders that currently have no effective treatment.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0070215314000118
Smell and Taste
S.S. Schiffman, in Encyclopedia of Gerontology (Second Edition), 2007
Smell
Olfactory receptor neurons (ORNs) are bipolar neurons that are activated when airborne molecules in inspired air bind to olfactory receptors (ORs) expressed on their cilia. The ORs belong to a G-protein-coupled receptor superfamily. The ORNs are located high within the nasal vault in the olfactory epithelium. The olfactory epithelium is situated on the undersurface of the cribriform plate of the ethmoid bone, on the medial surface of the superior and middle turbinates, and on the upper nasal septum. The turbinates are scrolled spongy bones in the nasal passages that create airflow patterns that allow volatile compounds inhaled through the nares to reach the olfactory epithelium. ORs in the olfactory epithelium can also be activated through ‘retronasal olfaction’ when molecules from the oral cavity (e.g., from food) pass up through the nasopharynx into the nose.
The axons of the bipolar ORNs pass through small foramina (natural openings) in the cribriform plate joined together in fascicles (bundles), where they synapse in intricate neural masses called glomeruli in the olfactory bulb. Each ORN axon innervates only a single glomerulus. There is considerable convergence at the level of the olfactory bulb, with millions of ORNs converging on far fewer glomeruli. During the aging process, the glomeruli atrophy as fibers degenerate and disappear such that the olfactory bulb takes on a moth-eaten appearance. ORNs are vulnerable to trauma (e.g., blows to head, domestic falls, automobile accidents, and assaults) due to shearing of the axons by the ethmoid bone.
Axons from two principal cell types (mitral and tufted cells) emerge from the olfactory bulb to form the lateral olfactory tract, which subsequently projects to the anterior olfactory nucleus, the olfactory tubercle, the prepyriform cortex, and the amygdala, which are known collectively as the olfactory cortex. Many of these structures constitute the so-called ‘limbic system’ of the brain, which also processes emotions and memories. The neuroanatomical overlap between neurons that mediate olfaction and emotions provides an anatomical basis for the capacity of odors to produce hedonic responses. Olfactory information is ultimately transmitted to the hypothalamus, an area of the brain that is intricately involved in eating and nutrition.
The direct accessibility of ORNs to airborne agents makes them vulnerable to toxins and infectious agents that occur in breathed air. This vulnerability to the damage from the external environments is probably why ORNs, unlike most other neurons, have the ability to regenerate from a precursor population. ORNs turn over every 30 days on average; they are replaced from a stem cell population of basal cells.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0123708702001736
Reproduction and Development
G.S.X.E. Jefferis, L. Luo, in Comprehensive Molecular Insect Science, 2005
1.12.2.2.2 Antennal lobe
ORN axons terminate in the CNS in the antennal lobe (in insects) or olfactory bulb (in mammals). Although these structures may not share an evolutionary heritage (Strausfeld and Hildebrand, 1999), the organizational features are very similar. Morphologically, the key features are the glomeruli (Figure 1), spherical neuropil regions usually surrounded by a glial sheath. In many insects, these glomeruli appear to be stereotyped in size, shape, and relative position, so that atlases can be generated (e.g., Drosophila: Laissue et al., 1999; Apis: Galizia et al., 1999a; moths: Berg et al., 2002). Glomeruli are the site of synaptic contact between three key neuronal types: ORN axons, PN dendrites (Figure 1; see also Figure 4b), and the processes of local interneurons (LNs; Figure 1) (review: Anton and Homberg, 1999). PNs and LNs are the major analogs of vertebrate mitral cells and granule cells, respectively. In Drosophila, ORNs and PNs usually synapse in single glomeruli, while LNs ramify through large areas of the lobe (Stocker et al., 1990) (Figure 1); this organization is typical of most insects, but see Section 1.12.2.3 for variations on this theme. ORNs and most PNs are believed to use acetylcholine as a transmitter (review: Homberg and Muller, 1999); a subset of PNs whose axons project via the middle antenno-cerebral tract (mACT) (see Section 1.12.2.2.3 below) have been demonstrated to be GABAergic in a number of species including Manduca, Apis, and Periplaneta (review: Homberg and Muller, 1999). While LNs are largely GABAergic in most species (e.g., Manduca: Hoskins et al., 1986; honeybee: Schafer and Bicker, 1986), there has been no formal demonstration of this in Drosophila, although GABA receptors are present in the glomeruli (Aronstein and ffrench-Constant, 1995).
Figure 4. Schematic of the olfactory anatomy of the insect brain. (a) Frontal view of the Drosophila brain (the same orientation as the head in Figure 2a). Olfactory information arrives from the antenna, with a minor afferent from the maxillary palp taking a different route through the subesophageal ganglion (SOG), and terminates in the antennal lobe (AL) glomeruli. Projection neuron axons relay that information to the calyx of the mushroom body (MB) and/or the lateral protocerebrum via three major antenno-cerebral tracts (ACTs). Uniglomerular cholinergic PNs of the inner ACT are the most numerous and project both to the MB calyx and the lateral horn (LH) of the protocerebrum. PNs employing the middle ACT are usually GABAergic and project generally to the lateral protocerebrum. The outer ACT contains PNs that project to the inferior lateral protocerebrum. (b) Example of a labeled single cell and a group of projection neurons generated using the MARCM method (review: Lee and Luo, 2001). The single cell labeled using a membrane targeted green fluorescent protein has a cell body (dotted line) from which a neurite extends, connecting to a dendritic arbor that innervates the glomerulus DL1 and an axon that projects through the iACT to the mushroom body calyx and lateral horn. An antibody recognizing synaptic structures (red), reveals the general organization of the brain, including the glomeruli of the antennal lobe. (Reproduced with permission from Jefferis, G.S.X.E., Marin, E.C., Stocker, R.F., Luo, L., 2001. Target neuron prespecification in the olfactory map of Drosophila. Nature 414, 204–208; © Nature Publishing Group.)
The synaptic connectivity within glomeruli has perhaps been most studied in the cockroach, Periplaneta americana (review: Distler and Boeckh, 1998). There are extensive synaptic connections between the three different neuronal cell types, such that PNs receive input from ORNs and LNs, while LNs are postsynaptic to ORNs, PNs, and LNs. Finally, it appears that LNs can make connections back to ORNs (review: Distler and Boeckh, 1998). The existence of these direct, indirect, and feedback pathways is likely at the origins of the oscillatory phenomena investigated most especially in the locust, S. americana (review: Laurent, 2002).
Besides the neurons in the AL, there are of course glia, which wrap the whole AL and send processes into it. It should be noted that the extent of glial processes within the lobe varies widely among different insects, with substantial glial presence in moths and bees (Boeckh and Tolbert, 1993; Hahnlein and Bicker, 1996), but little glia in flies and cockroaches (Stocker et al., 1990; Boeckh and Tolbert, 1993). In the mature organism, glial cells are likely to have a metabolic role, for example, in neurotransmitter cycling (Hahnlein and Bicker, 1996); however, they have also been shown to be of great significance for antennal lobe development in some species (see Section 1.12.4 below; review: Oland and Tolbert, 2003).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0444519246000077
The Olfactory System
Ken Ashwell, in The Mouse Nervous System, 2012
Main Olfactory Epithelium (Regio Olfactoria)
Olfactory receptor neurons within the olfactory neuroepithelium serve the transduction of odorant information and provide the first step in the olfactory pathway (from epithelium to olfactory bulb). Olfactory receptor neurons occupy an unusually traumatic environment for a neuron; by being positioned within the nasal epithelium, and with processes extending across the mucosal surface, they are continually exposed to noxious physical, chemical and microbiological agents. Consequently, olfactory receptor neurons are subject to continual turnover and the sensory neuron population must be replenished throughout adult life (Graziadei and Graziadei, 1979). The lifespan of olfactory neurons in rodents appears to be approximately 40 days (Shipley et al., 2004). This special feature of olfactory neurons is served by support cells within the epithelium and along the first order pathway to the bulb.
The olfactory neuroepithelium is a pseudostratified columnar epithelium, which is thicker than the surrounding respiratory epithelium and can be distinguished from it by the presence of mucus-secreting goblet cells in the latter. The olfactory neuroepithelium rests on a vascular lamina propria and contains the bipolar receptor neurons, microvillar cells, sustentacular cells, and globose and horizontal basal cells (Cuschieri and Bannister 1975a, b; Shipley et al., 2004). Bowman’s glands of the olfactory region have their serous secretory portion located within the lamina propria and ducts opening to the nasal cavity surface.
The cell bodies of olfactory receptor neurons lie within the deeper two thirds of the epithelium. Each neuron has an apical dendritic process that continues to the epithelial surface, where a slightly thickened olfactory knob extends six to eight olfactory cilia across the surface. An unmyelinated axon arises from the basal aspect of each receptor neuron body. This axon penetrates the lamina propria and bundles with other axons to form axon fascicles (fila olfactoria) that penetrate openings in the cribriform plate of the ethmoid bone and pierce the pial surface of the olfactory bulb. As noted above, olfactory receptor neurons must be replenished throughout life, so an environment that is permissive of regeneration of olfactory axons must be maintained along this pathway. Specialized Schwann cells known as olfactory ensheathing cells, arranged along the fila olfactoria, provide this.
Supporting cells of the olfactory neuroepithelium (microvillar and sustentacular cells) both have processes that extend onto the epithelial surface and penetrate the mucus layer. They may regulate the serous composition of the surface, which in turn influences the partitioning of odorants between air and mucus and thereby determines the effectiveness of odors. The basal ends of microvillar cells in rats may not only penetrate the lamina propria, but reach as far as the olfactory bulb (Rowley et al., 1989). This observation has led to the suggestion that microvillar cells may be a class of bipolar neuron (Rowley et al., 1989; Shipley et al., 2004). The expression of molecules of the P450 enzyme systems by supporting cells may be indicative of a role in detoxification of the olfactory neuroepithelial environment (Shipley et al., 2004).
Basal cells (horizontal and globose) sit on a basement membrane immediately superficial to the lamina propria. The basal cells are stem cells for provision of new olfactory receptor neurons.
The projection from the olfactory neuroepithelium to the main olfactory bulb largely maintains the topography of the epithelial surface regardless of the presence of turbinates. In other words, receptor neurons in the medial, lateral, dorsal and ventral parts of the neuroepithelium project to topographically matching parts of the bulbar surface.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123694973100263
Retronasal Olfaction
B.P. Halpern, in Encyclopedia of Neuroscience, 2009
Nasal Cavity Sensory Systems
Two different sensory systems supply receptors in a nasal cavity (Figures 1 and 3). Trigeminal receptors occur on all its surfaces, but ORNs are located only in an area away from the main path of respiratory air. In humans, the olfactory epithelium occurs on the superior turbinate and the upper part of the middle turbinate (Figure 1). This area, the olfactory cleft, receives air that is at body temperature, is humidified, and is free of large suspended particles because of the twisted airflow paths produced by the turbinates. A consequence is that only the chemicals in respiratory air are available to stimulate the ORNs. In some mammals, perhaps including humans, ORNs that respond well to one type of odorant are grouped together, somewhat separate from ORNs that respond well to another type of odorant. Because of this local grouping of ORNs, the opposite flow directions of retronasal and orthonasal olfaction may produce opposite patterns of ORNs responses.
Olfactory receptors are not permanent
Individual ORNs are not permanent structures. In vertebrates, including humans, each is replaced in normal adults on a timescale of several months. Every new ORN must extend to and make appropriate connections in the central nervous system (CNS; see the section titled ‘CNS connections’) in order to maintain a functional olfactory system.
Trigeminal receptors are not replaced
In contrast, trigeminal sensory neurons, in common with all other nonolfactory peripheral sensory neurons, are not replaced in mammals. Recovery is possible if the receptor end is damaged, but loss of an entire trigeminal neuron is permanent.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469016971
The Regulation of Visual Transduction and Olfaction
Bastien D. Gomperts, … Peter E.R. Tatham, in Signal Transduction (Second Edition), 2009
Olfactory receptor cells
The ORNs are bipolar cells. Their single axons project into the olfactory bulbs (extensions of the forebrain, one located above each nasal cavity), where they terminate in glomeruli. These are spherical bundles 50–100 μm in diameter, composed of neuronal and glial processes (known as neuropil). Regardless of their location on the surface of the nasal epithelium, the axons of ORNs bearing the same receptor are gathered together and cross the cribriform plate, terminating in a single glomerulus within the bulb. Here they form synapses with the dendrites of a much smaller number of mitral cells. These are the most numerous cells in the bulb (∼50 000) and they interact laterally with each other and with other cells. It is in this layer that the inputs of individual ORNs are integrated. The axons of the mitral cells form the lateral olfactory tract that conveys signals to the primary olfactory cortex in the brain (Figure 6.14). The convergence is such that a single mitral cell may receive input from ∼1000 ORNs. This means that although the amount of transmitted information is reduced, a very high sensitivity is ensured.
Mitral: pertains to the form of a mitre, a bishop’s hat.
Each day large numbers of ORNs must be replaced and each one of these must be correctly wired up to its own specific target glomerulus. It is evident that the receptors, in addition to providing the means of chemoperception, themselves provide the signals that guide the axons through the maze to their individual target glomeruli. Thus, in mice engineered to express a defined receptor coupled to an axonal marker (coloured blue in the image shown in Figure 6.15), it was found that the axons project to specific pairs of glomeruli, situated symmetrically in each of the olfactory bulbs.35,36
FIG 6.15. Specificity of axonal targeting to olfactory glomeruli.
Gene targeting technology was used to generate a strain of mice in which expression of a particular odorant receptor gene is coupled to that of an axonal marker, which is revealed as a blue stain.
From Mombaerts.35
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123694416000064
TASTE, SMELL AND CHEMESTHESIS IN PRODUCT EXPERIENCE
ARMAND V. CARDELLO, PAUL M. WISE, in Product Experience, 2008
Receptors for olfactory experience
Olfactory receptor neurons extend hair-like cilia into the mucous layer that covers the olfactory epithelium (Lledo et al., 2005; Rawson and Yee, 2006). Like taste receptor cells, these cilia contain specialized receptor-proteins that recognize odor molecules. Recent research has identified many of the genes that encode receptor-proteins (Glusman et al., 2001). Humans have approximately 350 potentially functional genes, which implies that we may have as many functional receptor-proteins (Rawson and Yee, 2006). Research suggests that each type of receptor-protein is expressed by many olfactory receptor neurons, but that each individual receptor neuron expresses only a single type of receptor-protein (Buck, 1996). A given receptor-protein, and therefore the olfactory receptor neuron that expresses that protein, will respond to multiple odorants, and a given odorant will stimulate multiple receptor neurons (Hildebrand and Shepherd, 1997). The overall pattern, or mosaic, of stimulated receptor neurons signals the identity of the molecule at this level of the olfactory system.
Recent research on odor receptors provides new insights into consumer olfactory experience. It is clear that odor perception differs substantially among people with a ‘normal’ sense of smell. For example, the compound androstenone, which is found in products like celery, pork, and truffles, is experienced quite differently among individuals. It is described as being either urinous, musky, or floral by different people. Yet, upwards of 50% of the population cannot even smell it (Labows and Wysocki, 1984). Wysocki and Beauchamp (1984) have shown a strong genetic basis for this difference and have demonstrated the involvement of genetic, developmental, and experiential factors (Wysocki and Beauchamp, 1991). Researchers are now attempting to link differences in olfactory experiences to specific mutations in genes that encode receptors. Those who develop consumer olfactory products, like perfume, know that a single formulation will rarely please all consumers. That we differ in our mosaic of smell receptors helps explain why we each seem to live in our own world of scents. As with taste experience, it may soon prove possible to infer much about the olfactory experiences and preferences of an individual by knowing the genes that he or she expresses.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450896500071
Olfaction & Taste
J. Caprio, C.D. Derby, in The Senses: A Comprehensive Reference, 2008
4.04.2.1 Introduction
ORNs of teleosts and crustaceans have served as important models not only for understanding the specifics of transduction in these species but also for elucidating fundamental and general principles of olfactory transduction (Ache, B. W. and Zhainazarov, A. B., 1995; Bruch, R. C., 1996; Ache, B. W. 2002; Ache, B. W. and Young, J. M. 2005). Transduction processes that are well characterized and that we describe in this section include perireception (in crustaceans), molecular biology of receptor molecules (in fish), second messengers, ion channels, and kinases. Much has been learned about chemoreception in fishes from only a few animal models of the more than 25 000 extant teleost species. These model species include catfishes, zebrafish, goldfish, and salmonids. For crustaceans, the spiny lobster Panulirus argus and the clawed lobster Homarus americanus are the models of choice for studying olfactory transduction.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123708809000736
Retronasal Olfaction☆
B.P. Halpern, in Reference Module in Neuroscience and Biobehavioral Psychology, 2017
Olfactory Bulb
Each ORN has an axon that can carry into the CNS action potentials generated at the receptor end (Fig. 3). All these axons end in a CNS structure, the olfactory bulb (Fig. 1), where thousands synapse with one of the principal neurons of the olfactory bulb (called mitral and tufted cells). These synaptic regions are known as glomeruli. In some mammals, and perhaps in humans, the axons of ORNs that respond better to one type of odorant than to other types of odorants (related to the molecular features of the odorants) converge into a few glomeruli. Such odorant-dependent (molecular feature-related) convergence can produce glomerular regions that are functionally distinct from other regions. This may yield, in the olfactory bulb, clusters of neural activity that are related to the odorants present at that time at the cilia of the various ORNs. For some fixed sets of odorants, retronasal olfaction may give bulbar neural activity patterns that are different from those for orthonasal olfaction. This can occur because odorants in retronasal airflow may reach, and stimulate, some ORN regions earlier than would odorants in orthonasal airflow. In addition, the opposite concentration profiles resulting from opposite flow directions across the mucus will contribute to different active olfactory bulb regions across time.
The olfactory bulb is a complex CNS structure. Its mitral and tufted cells have connections to each other through small neurons within the olfactory bulb (interneurons) which transform the input from the ORNs. The mitral and tufted cells themselves have axons which leave the olfactory bulb and reach other parts of the CNS. In addition, axons from other CNS areas enter the olfactory bulb and affect its neural activity.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128093245029060
Invertebrate Learning and Memory
Jean-Christophe Sandoz, in Handbook of Behavioral Neuroscience, 2013
Primary Processing: The Antennal Lobe
ORN axons form the antennal nerve to reach the antennal lobe (AL), the primary olfactory center of the insect brain (Figure 30.2). The antennal nerve splits into six sensory tracts upon entrance into the AL. Four of these tracts (T1–T4) innervate distinct portions of the AL, whereas the two remaining tracts (T5 and T6) bypass the AL. The bee AL is compartmentalized in 165 anatomical and functional units, the glomeruli. Glomeruli can be recognized based on their position, size, and shape.25 In Drosophila, axons of ORNs expressing the same OR converge onto the same glomerulus.26 Thus, the array of AL glomeruli would correspond to the array of approximately 163 OR types found in the genome.24 Two main neuron types comprise the AL.
Figure 30.2. The honeybee brain and the olfactory pathway.
For clarity, different neuron types are represented separately in the two brain hemispheres. On the left, major excitatory pathways involved in the transmission of olfactory information in the brain are shown. On the right, mostly inhibitory connections and modulatory neurons are presented. The antennal lobe (AL), first-order olfactory neuropil, receives input from ~60,000 olfactory receptor neurons (ORNs), which detect odorants within placode sensilla on the antenna. Within the AL’s anatomical and functional units, the 160 glomeruli, ORNs contact ~4000 inhibitory local neurons (LNs), which carry out local computations, and ~800 projection neurons, which further convey processed information via different tracts. The lateral antenno-protocerebral tract (l-APT) projects first to the lateral horn (LH) and then to the mushroom body (MB) calyces (lips and basal ring), whereas the medial tract (m-APT) projects to the same structures but in the reverse order. Both tracts are uniglomerular, with each neuron taking information within a single glomerulus. They form two parallel, mostly independent olfactory subsystems (green and magenta) from the periphery until higher order centers, where they project in mostly non-overlapping regions. Multiglomerular projection neurons form three mediolateral tracts (ml-APT), which convey information directly to the medial protocerebrum and to the LH. The dendrites of the Kenyon cells (KC), the mushroom bodies’ 170,000 intrinsic neurons, form the calyces, whereas their axons form the peduncle. The output regions of the MB are the α and β lobes, formed by two collaterals of each KC axon. Within the MBs, feedback neurons (FN) project from the peduncles and lobes back to the calyces, providing inhibitory feedback to the MB input regions. Extrinsic neurons (EN) take information from the peduncle and the lobes and project to different parts of the protocerebrum and most conspicuously to the LH. It is thought that descending neurons from these areas are then involved in the control of olfactory behavior. The scheme also presents a single identified octopaminergic neuron, VUMmx1, which was shown to represent reinforcement during appetitive conditioning. This neuron projects from the subesophageal ganglion (SOG), where it gets gustatory input from sucrose receptors, to the brain and converges with the olfactory pathway in three areas—the AL, the MB calyces, and the LH.
Source: Reproduced with permission from Sandoz.4
Local neurons (LNs) have branching patterns restricted to the AL. They are especially numerous in the honeybee (~4000 LNs) and can be classified in two main types.27,28 Homogeneous LNs innervate most, if not all, glomeruli in a uniform manner; heterogeneous LNs innervate one dominant glomerulus with very dense innervation and a few other glomeruli with sparse processes. Approximately 750 LNs are GABAergic, but glutamate, histamine, and several peptides have also been identified in the AL. To date, there is no evidence of excitatory LNs in honeybees.
Projection neurons (PNs) connect the AL with higher order brain areas, the mushroom bodies (MBs) and the lateral horn (LH), following five different pathways, called antenno-protocerebral tracts (APTs).29,30 PNs can be classified as two types. Uniglomerular projection neurons (uPNs) branch in a single glomerulus and project to the MBs and to the LH using the two major APT tracts. Multiglomerular projection neurons (mPNs) branch in most glomeruli. Their axons form three lesser tracts, the mediolateral APTs, leading not to the MBs but to different regions of the medial protocerebrum and the LH.29,31
The more numerous uPNs (~800) form two roughly equal tracts toward higher-order brain centers—the lateral (l-APT) and the medial (m-APT) tract. The l-APT runs on the lateral side of the protocerebrum, forming collaterals in the LH, and continues to the MB calyces. The m-APT runs along the brain midline first toward the MBs, where collaterals enter into the calyces, and then travels laterally to the LH.29,31 l-APT neurons take information from glomeruli receiving input from the T1 tract of ORNs, whereas m-APT neurons receive input from T2, T3, and T4 glomeruli.29 This corresponds to non-overlapping groups of 84 and 77 glomeruli, respectively,31 so that each tract conveys information about two different subparts of the AL.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780124158238000307
В последнее десятилетие ХХ века в науке о запахах произошла подлинная революция. Решающую роль сыграло открытие 1000 видов обонятельных рецепторов, связывающих молекулы пахучих веществ. Однако механизм передачи обонятельного сигнала в центральную нервную систему таит в себе еще много загадок.
Наука и жизнь // Иллюстрации
Пути передачи информации о запахах в головной мозг.
Схематическое изображение обонятельного эпителия. Базальные клетки являются клетками-предшественниками обонятельных рецепторных нейронов.
Изображение реснички обонятельного нейрона, сделанное с помощью флуоресцентного красителя. На мембране ресничек расположены рецепторные белки, взаимодействующие с молекулами одорантов.
Модель молекулы обонятельного рецепторного белка мыши, к которому присоединена молекула одоранта — гексанола (пурпурного цвета).
Одна из моделей процесса преобразования сигнала внутри реснички обонятельного нейрона.
Схематическое изображение комбинаторных рецепторных кодов одорантов.
Электроольфактограмма (ЭОГ) — электрический колебательный сигнал, регистрируемый специальным электродом с участка внешней поверхности обонятельного эпителия крысы.
‹
›
Чуть более четверти века назад в журнале «Наука и жизнь» (№ 1, 1978 г.) была опубликована статья «Загадка запаха». Ее автор, кандидат химических наук Г. Шульпин, справедливо отмечал, что современное ему состояние науки о запахах примерно такое же, как состояние органической химии в 1835 году. Тогда один из зачинателей этой науки, Ф. Велер, писал, что органическая химия представляется ему дремучим лесом, из которого невозможно выбраться. Но уже через четверть века А. М. Бутлеров, создав теорию химического строения вещества, сумел «выбраться из чащи». Шульпин выражал уверенность, что загадка запаха будет решена едва ли не быстрее, чем в случае органической химии.
И он оказался прав на все 100%! В последнее время произошел настоящий прорыв в понимании молекулярных основ обоняния. Разберем основные стадии восприятия запахов в свете современных представлений.
КАК ВОСПРИНИМАЕТСЯ ЗАПАХ
Проделаем простой опыт. Возьмем флакон с пахучей жидкостью, например духами, откроем пробку и понюхаем содержимое в спокойном ритме дыхания. Легко обнаружить, что мы ощущаем запах только во время вдоха; начинается выдох — запах исчезает.
При вдохе через нос воздух вместе с молекулами пахучего вещества (называемого обонятельным стимулом или одорантом) проходит в каждой из двух носовых полостей по щелевидному каналу сложной конфигурации, который образован продольной носовой перегородкой и тремя носовыми раковинами. Здесь воздух очищается от пыли, увлажняется и нагревается. Затем часть воздуха поступает в расположенную в верхней задней зоне канала обонятельную область, имеющую вид щели, покрытой обонятельным эпителием.
Общая поверхность, занимаемая эпителием в обеих половинках носа взрослого человека, невелика — 2 — 4 см2 (у кролика эта величина равна 7-10 см2, у собак — 27 — 200 см2). Эпителий покрыт слоем обонятельной слизи и содержит три типа первичных клеток: обонятельные рецепторы, опорные и базальные клетки. Влекомые воздухом пахучие молекулы проникают в носовую полость и переносятся над поверхностью эпителия. При нормальном спокойном дыхании вблизи обонятельного эпителия проходит 7 -10% вдыхаемого воздуха. Обонятельный эпителий имеет толщину приблизительно 150-300 мкм. Он покрыт слоем слизи (10-50 мкм), который молекулам одоранта предстоит преодолеть, прежде чем они провзаимодействуют со специальными сенсорными нейронами — обонятельными рецепторами.
Основная функция обонятельного рецептора состоит в выделении, кодировании и передаче информации об интенсивности, качестве и продолжительности запаха в обонятельную луковицу и специальным центрам в головном мозге. Эпителий в обеих носовых полостях у человека содержит приблизительно 10 млн обонятельных нейронов ( у кролика — около 100 млн, а у немецкой овчарки — до 225 млн).
Как известно, нейрон состоит из тела и отростков: аксонов и дендритов. Нервный импульс с одной нервной клетки на другую передается с аксона на дендрит. Диаметр утолщенной центральной части обонятельного нейрона (сомы) 5-10 мкм. Дендритная часть в виде волокнистых отростков диаметром 1-2 мкм выходит к внешней поверхности эпителия. Здесь дендриты заканчиваются утолщением, от которого отходит пучок из 6-12 ресничек (цилий) диаметром 0,2-0,3 мкм и длиной до 200 мкм, погруженный внутрь слоя слизи (у кролика число ресничек в одном рецепторном нейроне составляет 30-60, а у собак достигает 100-150). Отходящее от сомы нервное волокно (аксон) имеет диаметр около 0,2 мкм и выходит к внутренней поверхности эпителия. Здесь аксоны от соседних нейронов объединяются в жгуты (филы), доходящие до обонятельной луковицы.
СЕМИОТИКА ОБОНЯНИЯ
Для того чтобы обонятельный сигнал был воспринят нейроном, молекула одоранта связывается со специальной белковой структурой, расположен ной в нейрональной клеточной мембране. Такая структура называется рецепторным белком. Используя методы молекулярной биологии, американские ученые Линда Бак и Ричард Аксель в 1991 году установили, что обонятельные нейроны у млекопитающих содержат около 1000 различных видов рецепторных белков (у человека их меньше — около 350). Признанием важности этого открытия стало присуждение им в 2004 году Нобелевской премии за исследования в области физиологии и медицины (см. «Наука и жизнь» № 12, 2004 г).
Каким образом рецепторы распределяются по нейронам: имеются ли отдельные представители этого семейства во всех обонятельных нейронах или каждый нейрон несет на своей мембране только один вид рецепторного белка? Как может мозг определить, какой из 1000 типов рецепторов подал сигнал? Имеющиеся данные позволяют сделать заключение о том, что на одном нейроне присутствует только обонятельный рецепторный белок одного вида. Нейроны с разными рецепторами обладают различной функциональностью, то есть в эпителии имеются тысячи различных типов нейронов. В этом случае проблема идентификации активированного запахом отдельного рецептора сводится к задаче выявления подавшего сигнал нейрона.
Принимая во внимание, что общее число обонятельных нейронов у человека около 10 млн, число обонятельных рецепторов одного типа исчисляется в среднем десятками тысяч.
Обонятельная система использует комбинаторную схему для идентификации одорантов и кодирования сигнала. Согласно ей один тип обонятельных рецепторов активируется множеством одорантов и один одорант активирует множество типов рецепторов. Различные одоранты кодируются различными комбинациями обонятельных рецепторов, причем увеличение концентрации стимула приводит к возрастанию числа активируемых рецепторов и к усложнению его рецепторного кода. В этой схеме каждый рецептор выступает в качестве одного из компонентов комбинаторного рецепторного кода для многих одорантов и как бы выполняет роль буквы своеобразного алфавита, из совокупности которых составляются соответствующие слова-запахи.
Минимальные структурные отличия молекул одорантов, например, по функциональной группе, по длине углеродной цепи, по пространственной структуре приводят к различному рецепторному коду. Для отличительного признака молекулы одоранта, способного изменить кодировку запаха, был предложен термин «одотоп» (odotope), или детерминант запаха. Различные обонятельные рецепторы, которые распознают один и тот же одорант, могут идентифицировать различные его признаки-одотопы. Одиночный обонятельный рецептор способен «различать» молекулы, отличающиеся длиной углеродной цепочки всего лишь на один атом углерода, или молекулы, имеющие одинаковую длину углеродной цепочки, но отличающиеся функциональной группой. Учитывая, что в эпителии млекопитающих имеется приблизительно 1000 видов обонятельных рецепторов, можно полагать, что такая комбинаторная схема позволяет различить громадное число одорантов (даже человек различает до 10 000 запахов).
Полученные в последнее время результаты экспериментальных исследований свойств обонятельных рецепторных белков позволили создать на молекулярном уровне структурную модель спиральной молекулы обонятельного белка. Обонятельные рецепторные белки принадлежат к суперсемейству мембранносвязанных рецепторов. Они пересекают двухслойную липидную мембрану реснички семь раз. У содержащей 300-350 аминокислот молекулы рецепторного белка три наружные петли соединяются с тремя внутриклеточными петлями семью пересекающими мембрану трансмембранными участками.
НЕОБХОДИМАЯ СЛИЗЬ
Находящиеся в потоке воздуха молекулы одоранта, перед тем как достичь обонятельных рецепторных нейронов, должны пересечь обволакива ющий поверхность обонятельного эпителия слой слизи. Физиологические функции слоя слизи полностью до сих пор не выяснены. Не вызывает сомнения, что она создает гидрофильную оболочку для чувствительных и хрупких обонятельных рецепторов, выполняя защитную функцию. Ведь систему восприятия сигнала нужно защитить от воздействия внешней среды, то есть от молекул одорантов, среди которых могут быть достаточно опасные и химически активные вещества.
Слой слизи состоит из двух подслоев. Внешний, водный, имеет толщину примерно 5 мкм, а внутренний, более вязкий, — около 30 мкм. Реснички-цилии направлены наклонно к внешней поверхности слоя слизи. Они образуют своего рода сетку с нерегулярными ячейками, причем эта сетка размещена у поверхности раздела подслоев так, что основная часть поверхности ресничек (около 85%) оказывается расположен ной вблизи границы раздела.
Слой слизи содержит разнообразные растворимые в воде белки, значительную часть которых составляют так называемые гликопротеины. Благодаря разветвленной молекулярной структуре эти белки способны связывать и удерживать молекулы воды, образуя гель.
Другие виды белков, содержащихся в слизи, взаимодействуют с молекулами одорантов и тем самым могут оказывать влияние на восприятие и распознавание запахов. Эти белки подразделяются на два основных класса — одорант-связующие белки (OBP) и одорант-разрушающие ферменты.
ОВР относятся к семейству белков, имеющих складчатую бочкообразную структуру с внутренней глубокой полостью, в которую попадают маленькие молекулы гидрофильных (жирорастворимых) одорантов. Разные подвиды этих белков отличаются высокой избирательностью взаимодействия с одорантами различных химических классов.
Полагают, что OBP способствуют растворению одоранта и транспортируют его молекулы сквозь слой слизи, действуют как фильтр для разделения одорантов, могут облегчать связывание одоранта с рецепторным белком и даже очищать околорецепторное пространство от ненужных компонентов.
Кроме одорант-связующих белков в слизи обонятельного эпителия вблизи рецепторных нейронов обнаружены несколько видов одорант-разрушающих ферментов. Все эти ферменты запускают реакции превращения молекул одорантов в другие соединения. Образующиеся в результате этих реакций продукты также вносят свой вклад в восприятие запаха. В конечном итоге все поступающие в слой слизи молекулы одорантов быстро, практически одновременно с завершением вдоха, теряют свою «запаховую» активность. Так что обонятельная система при каждом вдохе получает новую информацию от свежих порций одоранта.
ОБОНЯНИЕ НА УРОВНЕ МОЛЕКУЛ
Многие свойства системы восприятия запахов можно объяснить на молекулярном уровне. Молекула одоранта встречает на поверхности слизи, покрывающей обонятельный эпителий, молекулу одорант-связующего белка, которая связывает и переносит молекулу одоранта через слой слизи к поверхности реснички обонятельного нейрона. В ресничках осуществляется основной процесс передачи обонятельного сигнала. Его механизм достаточно типичен для многих видов взаимодействий физиологически активных веществ с рецепторами нервных клеток.
Молекула одоранта прикрепляется к определенному обонятельному рецептору (R). Между
процессом связывания молекулы одоранта с рецептором и передачей обонятельного
сигнала в нервную систему лежит сложный каскад биохимических реакций, проходящих
в нейроне. Связывание молекулы одоранта с рецепторным белком активирует так называемый
G-белок, расположенный на внутренней стороне клеточной мембраны. G-белок в свою
очередь активирует аденилатциклазу (AC) — фермент, преобразующий внутриклеточный
аденозинтрифосфат (ATP) в циклический аденозинмонофосфат (cAMP). А уже cAMP активирует
другой мембранносвязанный белок, который называется ионным каналом, поскольку
открывает и закрывает вход заряженным частицам внутрь клетки. Когда ионный канал
открыт, в клетку проникают катионы металлов. Таким способом меняется электрический
потенциал клеточной мембраны и генерируется электрический импульс, передающий
сигнал с одного нейрона на другой.
Несколько молекулярных стадий передачи внутриклеточного сигнала обеспечивают его усиление, в результате чего небольшого числа молекул одоранта становится достаточно для генерирования нейроном электрического импульса. Такие усилительные каскады обеспечивают большую чувствительность системы восприятия запахов.
Итак, активация рецепторного белка молекулой одоранта в конечном счете приводит к генерированию электрического тока в обонятельном рецепторном нейроне. Ток распространяется по дендриту нейрона в его соматическую часть, где возбуждает выходной электрический импульс. Этот импульс передается по нейрональному аксону в обонятельную луковицу.
Одиночный электрический сигнал-импульс на выходе имеет длительность не более 5 мс и пиковую амплитуду около 100 мкВ. Почти все нейроны генерируют импульсы и при отсутствии воздействия одоранта, то есть обладают спонтанной активностью, называемой биологическим шумом. Частота этих импульсов меняется в диапазоне от 0,07 до 1,8 импульса в секунду.
ЛУКОВИЧНАЯ НЕЙРОСЕТЬ
Обонятельные рецепторные нейроны распознают громадное число разнообразных молекул пахучих веществ и посылают информацию о них через аксоны в обонятельную луковицу, служащую первым центром обработки обонятельной информации в головном мозге. Парные обонятельные луковицы представляют собой продолговатые образования «на ножках». Отсюда начинается путь обонятельного сигнала к полушариям мозга. Аксоны обонятельных нейронов оканчиваются в обонятельной луковице разветвлениями в сферических концентраторах (диаметром 100-200 мкм), называемых гломерулами. В гломерулах осуществляется контакт между окончаниями аксонов обонятельных нейронов и дендритами нейронов второго порядка, которыми являются митральные и пучковые клетки.
Митральные клетки — самые крупные нервные клетки, выходящие из обонятельной луковицы. Пучковые клетки меньше митральных, но функционально с ними схожи. Представление о количестве нервных клеток у млекопитающих могут дать характеристики обонятельной системы кролика. В ней имеется по 50 миллионов обонятельных рецепторных нейронов справа и слева (ровно в десять раз больше, чем у человека). Аксоны обонятельных рецепторов распределены между 1900 гломерулами обонятельной луковицы — примерно по 26 000 аксонов на гломерулу. Дендритные окончания 45 000 митральных и 130 000 пучковых клеток получают сигналы от аксонов в гломерулах и передают их из обонятельной луковицы в центры обоняния в головном мозге. Около 24 митральных и 70 пучковых клеток получают информацию от аксонов в каждой гломеруле. У человека около 10 млн аксонов обонятельных нейронов распределяются по 2000 гломерул обонятельной луковицы.
Все аксоны одной популяции обонятельных нейронов сходятся на две гломерулы, зеркально расположенные по разные стороны двумерного поверхностного слоя обонятельной луковицы. В зависимости от содержания передаваемого сигнала гломерулы активируются различным образом. Совокупность активированных гломерул называется картой запаха и представляет своего рода «слепок» запаха, то есть она показывает, из каких пахучих веществ состоит воспринимаемый обонятельный объект.
Механизм активации гломерул до сих пор не выяснен. Усилия исследователей направлены на то, чтобы выяснить, каким образом многообразие одорантов воспроизводится в двумерном слое гломерул на поверхности обонятельной луковицы. Кстати, эти отображения имеют динамический характер — они постоянно меняются в ходе восприятия запаха, усложняя научную задачу.
Обонятельная луковица — это большая многослойная нейросеть для пространственно-временнoй обработки отображения запаха в гломерулах. Ее можно рассматривать как совокупность множества микросхем с большим количеством связей, со взаимной активацией и ингибированием активности нейронов. Выполняемые нейронами операции выделяют характерные свойства карты запаха.
От обонятельной луковицы аксоны митральных и пучковых клеток передают информацию в первичные обонятельные участки коры головного мозга, а затем в высшие ее участки, где формируется осознанное ощущение запаха, и в лимбическую систему, которая порождает эмоциональную и мотивационную реакцию на обонятельный сигнал.
Свойства обонятельных зон коры головного мозга позволяют формировать ассоциативную память, которая устанавливает связь нового аромата с отпечатками воспринятых ранее обонятельных стимулов. Полагают, что процесс идентификации одоранта включает сравнение получающегося отображения с его описанием в семантической памяти. В случае совпадения отпечатка и памяти о запахе происходит какой-либо ответ (эмоциональный, двигательный) организма. Процесс этот осуществляется очень быстро, в течение секунды, и информация о совпадении после ответа сразу сбрасывается, поскольку мозг готовит себя к решению следующей задачи восприятия запаха.
ЗАГАДКИ ЗАПАХОВ
То, о чем говорилось в предыдущих разделах, относится пусть к самому сложному,
основополагающему, но начальному разделу науки о запахах — к их восприятию. Не
раскрыт механизм взаимодействия обоняния с другими системами восприятия, например
со вкусом (см. «Наука и жизнь» № 8, 2003 г., с. 16-20). Ведь известно, что если
человеку зажать ноздри, то при дегустации даже хорошо известных вкусовых пищевых
продуктов (например — кофе) он не в состоянии точно определить, что он пробовал.
Достаточно разжать ноздри — и вкусовые ощущения восстанавливаются.
С молекулярной точки зрения пока непонятно, в каких единицах измерять интенсивность запаха и от чего она зависит, что такое качество запаха, его «букет», чем отличается один запах от другого и как охарактеризовать это отличие, что происходит с запахом при смешивании различных одорантов. Оказывается, что независимо от вида одорантов и уровня подготовленности даже опытный эксперт не может определить все составляющие смесь компоненты, если их больше трех. Если же смесь содержит более десяти одорантов, то человек не в состоянии идентифицировать ни одного из них.
Остается еще множество вопросов, касающихся механизмов и видов воздействия запахов на эмоциональное, психическое и физическое состояния человека. В последнее время на эту тему появилось немало спекуляций, чему поспособствовал вышедший в 1985 году роман П. Зюскинда «Парфюмер», более восьми лет прочно занимавший место в первой десятке бестселлеров на западном книжном рынке. Фантазии на тему чрезвычайной силы подсознательного воздействия ароматов на эмоциональное состояние человека обеспечили этому произведению огромный успех.
Однако художественный вымысел постепенно получает обоснование. Недавно в периодической печати появились сообщения о том, что американские военные «парфюмеры» разработали на редкость дурно пахнущую бомбу, способную не только вызвать отвращение, но и разогнать солдат противника или агрессивно настроенную толпу.
Общественные аллюзии на парфюмерные темы подстегнули всеобщий интерес к искусству ароматерапии. Расширилось использование ароматов в общественных местах, таких, как офисы, торговые залы, холлы гостиниц. Появились даже специальным образом ароматизированные товары, улучшающие настроение. Возникла такая отрасль рыночной экономики, как аромамаркетинг — «наука» о привлечении клиентов с помощью приятных запахов. Так, запах кожи навевает покупателю мысли о дорогом качественном товаре, аромат кофе побуждает к покупкам для домашнего ужина и т.д. Каким образом запахи формируют в головном мозге сигналы, побуждающие человека совершать покупки? Ученым предстоит совершить еще немало открытий, прежде чем ответить на этот и многие другие вопросы и отделить мифы о запахах от реальности.
Литература
Лозовская Е., канд. физ.-мат. наук. Штрих-код запаха // Наука и жизнь, 2004, № 12.
Майоров В. А. Запахи: их восприятие, воздействие, устранение. — М.: Мир, 2006.
Марголина А., канд. биол. наук. Сладкая власть феромонов // Наука и жизнь, 2005, № 7.
Шульпин Г., канд. хим. наук. Загадка запаха // Наука и жизнь, 1978, № 1.
Содержание
- Какую роль в нашей жизни играет обоняние
- Как работает наше обоняние
- Причины ухудшения обоняния
- Способы улучшения обоняния
Обоняние – это чувство человека, которое дает ему возможность ощущать различные запахи. Оно позволяет воспринимать более 10 тысяч разных ароматов, которые способны, и улучшить аппетит, и поднять настроение, и позволить вовремя распознать опасность. Важность носа, как самого главного органа обоняния, недооценивать нельзя. Но, к сожалению, о нем мы вспоминаем только во время его поражения инфекциями, когда сильная заложенность на дает нам наслаждаться любимыми ароматами. Ниже мы рассмотрим, какова биологическая роль обоняния, как его сохранить и улучшить.
Какую роль в нашей жизни играет обоняние
Обоняние, осязание и другие чувства являются своего рода инструментами, которые позволяют нам получать информацию извне и познавать окружающий нас мир. Без них жизнь не будет столь красочной и интересной, а нарушенное с детства обоняние, к тому же, может серьезно извратить общее представление о мире.
Обоняние особенно важно для предупреждения нас об опасности, для создания настроения и влияния на другие чувства. К примеру, запах сдобной выпечки сразу повышает аппетит, кислый запах лимона провоцирует активизацию работы слюнных желез, а шум морского прибоя успокаивает наши нервы и настраивает на благодушный лад.
Обоняние-важное чувство
В целом же, распознавание ароматов – это одна из высших функций работы нашей нервной системы, ее импульсы запускают работу других органов и систем нашего организма, что приводит к появлению тех или иных эмоций.
Потеряв способность к распознаванию запахов, человек становится раздражительным и злым, ведь это равноценно потере зрения или слуха и, соответственно, может привести к глубокой депрессии. Ниже мы разберемся с тем, как работает эта система чувств и что нужно сделать для недопущения ее дисфункции.
Как работает наше обоняние
Нос по праву считается главным органом обоняния. Одной из ее функций является восприятие витающих вокруг нас раздражителей. Оно не будет возможным без наличия и нормальной работы таких органов, как:
- Слизистая оболочка носовых ходов;
- Обонятельная луковица и нити;
- Кора головного мозга;
- Обонятельные нервы;
- Рецепторные клетки.
Место, где расположены рецепторы обоняния находится в районе пересечения верхнего носового хода и носовой перегородки с задней части назальной области. Его устилает обонятельный эпителий, который занимает площадь в 4 кв.см. Эти рецепторы обеспечивают передачу всех полученных сигналов в головной мозг, которые распознаются в его коре.
Рецепторы обоняния тесно связаны с отростками тройничных и обонятельных нервов, а именно:
- С дендритами, которые они похожи на палочки, обрамленные обонятельными ресничками;
- С аксонами, которые по своему виду очень похожие на нити.
Аксоны считаются центральными отростками нервных клеток. Они через ячейки решетчатой кости, которая расположена в полости носа, проникают внутрь черепа для того, чтобы присоединиться к находящейся на его основании обонятельной луковице. Она составляет отдельную часть головного мозга.
Таким образом, на вопрос, где расположен орган обоняния однозначно ответить невозможно.
Изначально функцию приема сигнала того или иного запаха берет на себя нос и находящиеся в нем рецепторы, а вот распознаванием запахов занимается наш головной мозг, вернее отдельный участок его коры, именуемый висцеральным мозгом, где находятся обонятельные анализаторы, регулирующую пищевую, эмоциональную, оборонительную и любую другу врожденную активность человека.
К другим его функциям относится регуляция гемостаза, поддержка вегетации, а также обеспечение нормального развития эмоций, памяти и волевого поведения у детей.
Поскольку нос – это орган обоняния человека, значит к его функциям относится регуляция темпа мышления, поскольку все составляющие его анализатора запахов участвуют, и в поведенческой реакции на то или иное событие, и в процессе запоминания, и в возбуждении и в прочей активности, исходящей из коры головного мозга. Во время формирования в мозгу ощущения запаха у человека учащается дыхание и пульс, а также повышается артериальное давление.
Нормальная чувствительность носа различает пару тысяч оттенков разных запахов, в то время как нюх животного различает более ста их тысяч. Но в то же время острота обоняния напрямую зависит от того, в какой физиологической форме пребывает человек и в какое время суток проводится проверка его анализаторов. Научно доказано, что острота ощущения запахов у людей появляется после пробуждения и тогда, когда они испытывают голод.
Причины ухудшения обоняния
Что такое обоняние и осязание это мы уже выяснили, теперь перейдем к тому, как исключить возможное снижение остроты этих необходимых органов чувств на протяжении всей своей жизни.
Обоняние развито у человека с самого рождения. Более того, считается, что младенец до года, больше информации воспринимает с помощью именно этого органа чувств. Но уже после года нос малыша значительно теряет свою чувствительность, поскольку работу по переработке информации включаются другие органы – зрение, слух, речь и т.д.
Согласно данных медицинских исследований обоняние человека медленно, но неуклонно снижается на протяжении всей его жизни. И виной тому необратимая атрофия их рецепторов.
Пожилые люди слышат окружающие их запахи гораздо хуже своих внуков. Тем не менее, это снижение является физиологическим, то есть нормой.
Потеря обоняния
Но иногда это чувство резко снижается по независящим от возраста причинам, которыми чаще всего выступают заболевания, локализующиеся там, где расположен орган обоняния. А именно:
- При наличии острых и хронических воспалительных процессов в носоглотке;
- При сезонных аллергиях, которые сказываются на многих органах чувств;
- При полипах и других новообразованиях на слизистой оболочке носовых ходов;
- При стоматологических проблемах;
- При приеме некоторых лекарственных препаратов;
- При авитаминозе;
- При интоксикации организма;
- После острого течения вирусного гепатита.
Кроме того, снижают функциональность рецепторов и некоторые тяжелые заболевания, в том числе и связанные с нарушениями в работе мозга и ЦНС (болезнь Альцгеймера, ДЦП, эпилепсия и т.д.).
Способы улучшения обоняния
Нормальное кровоснабжение органа обоняния позволяет продлить жизнь его рецепторам, отвечающим за сохранность у человека этого чувства. Тем не менее, его атрофия наступает тогда, когда им мало пользуются или не пользуются вовсе. Тренировать это чувство нужно постоянно, особенно при первых «звоночках», указывающих на его снижение.
Тренировка обоняния
Как сохранить обоняние подскажет любой сурдолог. Есть несколько проверенных способов этого:
- Тренировки;
- Специальные упражнения;
- Физиотерапевтические процедуры;
- Прием витаминов;
- Ведение правильного образа жизни;
- Своевременное лечение аллергий и ЛОР заболеваний;
- Создание для себя благоприятной среды обитания.
Тренировать свое обоняние рекомендуется постоянно. Для этого следует постараться окружать себя только приятными запахами.
Неплохую тренировку дает посещение парфюмерного магазина или магазина специй и пряностей. Хорошо развивает нюх запах свежей выпечки, трав, эфирных масел.
Еще один способ того, как улучшить обоняние будет заключаться в его тренировке посредством включения в свой пищевой рацион щедро приправленных ароматных блюд. Хорошо развивает и стимулирует работу рецепторов запах свежесвареного кофе. Блюдце с кофейными зернами всегда должно стоять на вашей кухне – это не только будет стимулировать аппетит, но и спасет вас от плохого настроения с утра.
Важно тренировать обоняние постояно
Что касается физических упражнений, то к ним можно отнести ежедневную гимнастику лица, которая улучшит кровообращение в назальной области и прогревание ее синей лампой. Физиотерапевтические процедуры будут заключаться в промывании носа теплым раствором морской соли. В устранении возможных застойных явлений в носовых ходах и будет заключаться гигиена обоняния.
Считается, что снижение функций обонятельных рецепторов происходит при гипо- и авитаминозе, а также при недостатке цинка в организме. Именно поэтому свой пищевой рацион нужно обогатить красным мясом, чечевицей, шпинатом, орехами и другими продуктами, содержащими этот полезный минерал. Не стоит забывать и о регулярном приеме витаминных препаратов и пищевых добавок. К тому же рекомендуется вести здоровый образ жизни, постараться не находиться слишком долго в душны помещения с сухим воздухом, реже простужаться и своевременно устранять все воспалительные процессы в носу.
Обонятельный нерв (обонятельные нервы) (лат. nervi olfactorii) — первый из черепномозговых (черепных) нервов, отвечающий за обонятельную чувствительность.
Анатомия
Обонятельные нервы представляют собой нервы специальной чувствительности — обонятельной. Они начинаются от обонятельных нейросенсорных клеток, образующих первый нейрон обонятельного пути и залегающих в обонятельной области слизистой оболочки полости носа. В виде 15-20 тонких нервных стволов (обонятельные нити), состоящих из безмиелиновых нервных волокон, они, не образуя общего ствола обонятельного нерва, проникают через горизонтальную пластинку решётчатой кости (лат. lamina cribrosa os ethmoidale) в полость черепа, где вступают в обонятельную луковицу (лат. bulbus olfactorius) (здесь лежит тело второго нейрона), переходящую в обонятельный тракт (лат. tractus olfactorius), представляющий собой аксоны клеток, залегающих в (лат. bulbus olfactorius). Обонятельный тракт переходит в обонятельный треугольник (лат. ). Последний состоит преимущественно из нервных клеток и разделяется на две обонятельные полоски, вступающие в переднее продырявленное вещество (лат. substantia perforata anterior), лат. area subcallosa и прозрачную перегородку (лат. septum pellucidum), где находятся тела третьих нейронов. Затем волокна клеток этих образований различными путями достигают коркового конца обонятельного анализатора, залегающего в области крючка (лат. uncus) и парагиппокампальную извилины лат. gyrus parahyppocampalis височной доли больших полушарий мозга.
Функция
Схема внечерепной части обонятельного нерва, обонятельной луковицы и обонятельных трактов (показаны жёлтым)
Обонятельные нервы — нервы специальной чувствительности.
Система обоняния начинается с обонятельной части слизистой носа (область верхнего носового хода и верхней части носовой перегородки). В ней находятся тела первых нейронов обонятельного анализатора. Эти клетки являются биполярными.
Как уже было отмечено выше, обонятельный анализатор представляет собой трёхнейронную цепь:
- Тела первых нейронов представлены биполярными клетками, находящимися в слизистой носа. Их дендриты оканчиваются на поверхности слизистой носа и образуют рецепторный аппарат обоняния. Аксоны этих клеток в виде обонятельных нитей заканчиваются на телах вторых нейронов, морфологически находящихся в обонятельных луковицах
- Аксоны вторых нейронов формируют обонятельные тракты, которые оканчиваются на телах третьих нейронов в переднем продырявленном веществе (лат. substantia perforata anterior), лат. area subcallosa и прозрачной перегородке (лат. septum pellucidum)
- Тела третьих нейронов также называются первичными обонятельными центрами. Важно отметить, что первичные обонятельные центры связаны с корковыми территориями как своей, так и противоположной стороны; переход части волокон на другую сторону происходит через переднюю спайку (лат. comissura anterior). Кроме этого, она обеспечивает связь с лимбической системой. Аксоны третьих нейронов направляются к передним отделам парагиппокампальной извилины, где расположено цитоархитектоническое поле Бродмана 28. В этой области коры представлены проекционные поля и ассоциативная зона обонятельной системы.
Запах, вызывающий аппетит, вызывает одновременно рефлекс слюноотделения, тогда как неприятный запах приводит к тошноте и рвоте. Эти реакции связаны с эмоциями. Запахи, могут быть приятными или неприятными. Основными волокнами, обеспечивающими связь обонятельной системы с автономными зонами мозга, являются волокна медиальных пучков переднего мозга и мозговых полосок зрительного бугра.
Медиальный пучок переднего мозга состоит из волокон, которые восходят от базальной обонятельной области, периминдалевидной области и ядер перегородки. На своём пути через гипоталамус часть волокон заканчивается на ядрах подбугорной области. Большинство же волокон направляется в ствол мозга и осуществляет контакт с вегетативными зонами ретикулярной формации, со слюноотделительными и дорсальными ядрами лат. n.intermedius (нерв Врисберга), языкоглоточного (лат. n. glossopharyngeus) и блуждающего (лат. n.vagus) нервов.
Мозговые полоски зрительного бугра отдают синапсы к ядрам поводка. От этих ядер к межножковому ядру (узлу Гансера) и к ядрам покрышки идёт поводково-ножковый путь, а от них волокна направляются к вегетативным центрам ретикулярной формации ствола мозга.
Волокна, осуществляющие связь обонятельной системы со зрительным бугром, гипоталамусом и лимбической системой, вероятно, и обеспечивают сопровождение обонятельных раздражителей эмоциями. Область перегородки, кроме прочих мозговых зон, связана через ассоциативные волокна с поясной извилиной (лат. gyrus cinguli).
Клиника поражения
Аносмия и гипосмия
Аносмия (отсутствие обоняния) или гипосмия (снижение обоняния) с обеих сторон чаще отмечается при заболеваниях слизистой носа. Гипосмия или аносмия с одной стороны — обычно признак серьёзного заболевания.
Возможные причины аносмии:
- Недоразвитие обонятельных путей.
- Заболевания обонятельной слизистой носа (ринит, опухоли носа и т. д.).
- Разрыв обонятельных нитей при переломе lamina cribrosa решётчатой кости вследствие черепно-мозговой травмы.
- Деструкция обонятельных луковиц и путей при очаге ушиба по типу противоудара, наблюдаемый при падении на затылок
- Воспаление пазух решётчатой кости (лат. os ethmoidale, воспалительный процесс прилежащей мягкой мозговой оболочки и окружающих областей.
- Срединные опухоли или другие объёмные образования передней черепной ямки.
Следует обратить внимание, что прерывание целостности путей, идущих от первичных обонятельных центров, не ведёт к аносмии, так как они являются двусторонними.
Гиперосмия
Гиперосмия — повышенное обоняние отмечается при некоторых формах истерии и иногда у кокаиновых наркоманов.
Паросмия
Извращённое ощущение запаха наблюдается в некоторых случаях шизофрении, поражения крючка парагиппокампальной извилины и при истериях. К паросмии можно отнести получение приятных эмоций от запаха бензина и других технических жидкостей у больных железодефицитной анемией.
Обонятельные галлюцинации
Обонятельные галлюцинации наблюдаются при некоторых психозах. Могут являться аурой эпилептического припадка, которые вызываются наличием патологического очага в области височной доли.
Также
Обонятельный нерв может служить входными воротами для инфекций мозга и менингеальных оболочек. Больной может не осознавать потерю обоняния. Вместо этого он в связи с исчезновением обоняния может жаловаться на нарушение вкусовых ощущений, поскольку восприятие запахов очень важно для формирования вкуса пищи (прослеживается связь между обонятельной системой и лат. nucleus tractus solitarii).
Методика исследования
Состояние обоняния характеризуется способностью восприятия запахов различной интенсивности каждой половиной носа в отдельности и идентификации (узнавания) различных запахов. При спокойном дыхании и закрытых глазах проводится прижатие пальцем крыла носа с одной стороны и постепенное приближение пахучего вещества к другой ноздре. Лучше использовать знакомые нераздражающие запахи (летучие масла): хозяйственное мыло, розовую воду (или одеколон), горькоминдальную воду (или валериановые капли), камфору. Следует избегать использования раздражающих веществ, таких как нашатырный спирт или уксус, так как при этом одновременно возникает раздражение окончаний тройничного нерва (лат. n.trigeminus). Отмечается, правильно ли идентифицируются запахи. При этом необходимо иметь в виду, свободны ли носовые пути или имеются катаральные явления из них. Хотя обследуемый может быть неспособным назвать тестируемое вещество, само осознание наличия запаха исключает аносмию.