Александра Коростышевская, Андрей Савелов, Ирина Приходько, Яна Исаева, Василий Ярных
«Наука из первых рук» № 3(88), 2020
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации.
Об авторах
|
Александра Михайловна Коростышевская — доктор медицинских наук, ведущий научный сотрудник лаборатории МРТ-технологий, заведующая диагностическим отделением института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 70 научных работ. |
|
Андрей Александрович Савелов — кандидат физико-математических наук, старший научный сотрудник лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 90 научных работ. |
|
Ирина Юрьевна Приходько — инженер-программист лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор 3 научных работ. |
|
Яна Олеговна Исаева — студентка Института медицины и психологии им. В. Зельмана Новосибирского государственного университета. |
|
Василий Леонидович Ярных — кандидат химических наук, заведующий лабораторией отделения радиологии, профессор университета Вашингтона (Сиэтл, США) и Томского государственного университета. Автор и соавтор более 70 научных работ, в том числе 5 патентов. |
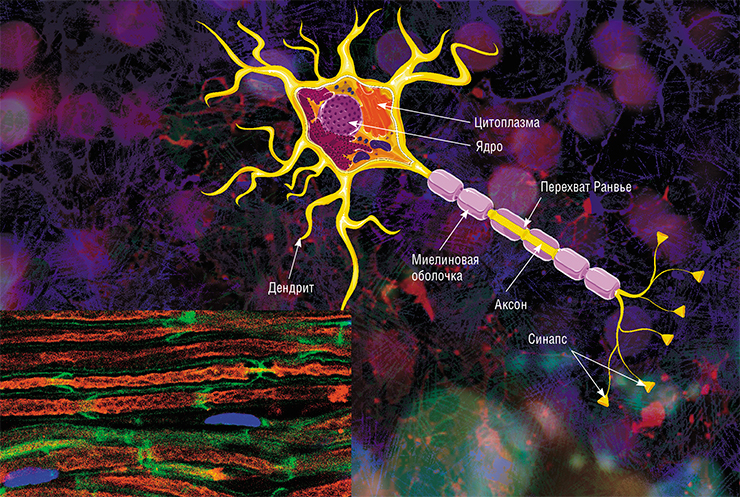
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом — миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз — хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей — через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода — сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18–20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) — биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин — в норме и патологии
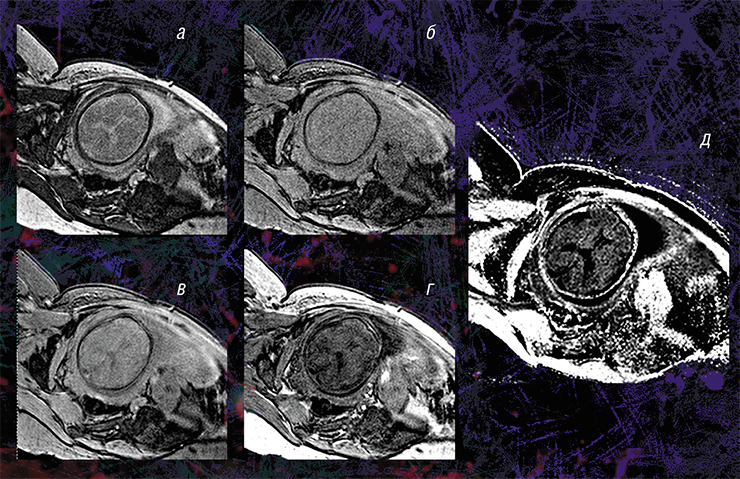
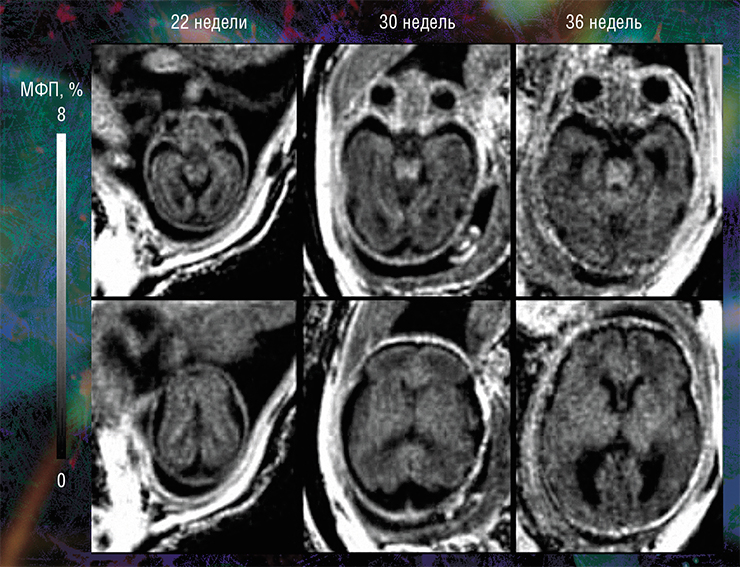
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
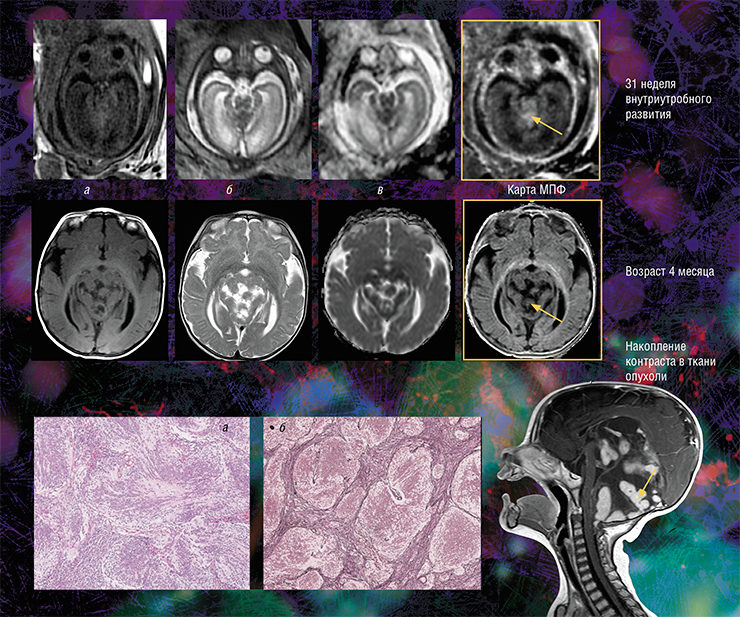
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы — врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH).
Литература
1. Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
2. Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
3. Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635.
4. Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
5. Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
6. Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
У нервных клеток есть два вида отростков — небольшие и чрезвычайно разветвлённые дендриты, с помощью которых нейрон собирает импульсы от других нервных клеток, и очень длинные аксоны, которые отправляют импульсы дальше. Почти все аксоны в центральной нервной системе (то есть в головном и спинном мозге) покрыты миелином — светлой субстанцией, состоящей преимущественно из липидов. Миелинизированных нервных волокон также много в периферической нервной системе, то есть в нервах, которые выходят из головного и спинного мозга и идут к другим органам.
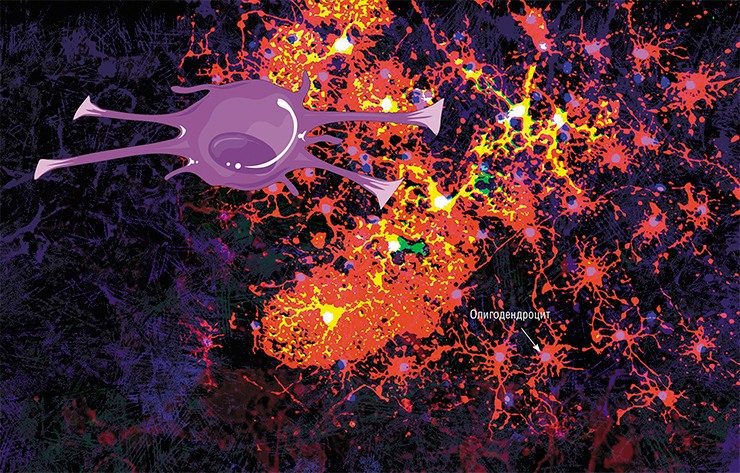
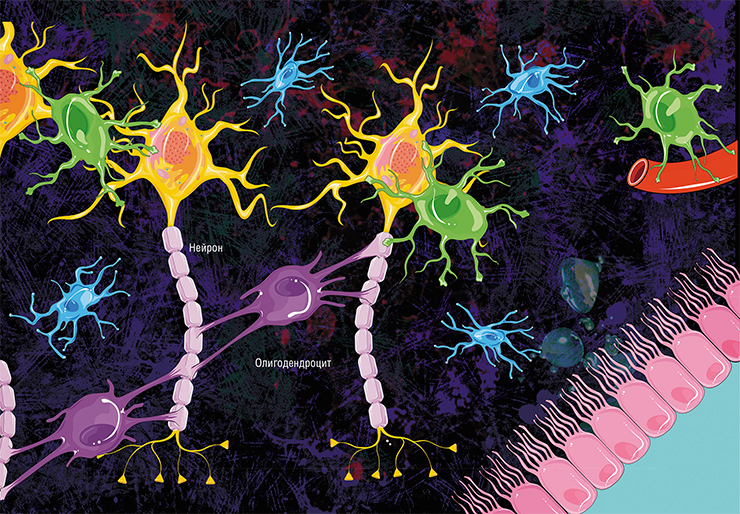
Олигодендроцит и миелиновая оболочка. Один олигодендроцит формирует миелиновую оболочку сразу на нескольких аксонах, но на каждом из них он создаёт только один сегмент оболочки (от одного перехвата Ранвье до другого). Иллюстрация: Holly Fischer/Wikimedia Commons/CC BY 3.0.
‹
›
Миелин одновременно ускоряет электрохимические импульсы, бегущие по аксонам, и изолирует их друг от друга, не допуская «короткого замыкания» между нейронными «проводами». Чтобы понять, как миелин ускоряет импульсы, нужно вспомнить, что любой импульс в нейроне — это перегруппировка ионов между наружной и внутренней стороной клеточной мембраны. Когда на каком-то участке мембраны открываются ионные каналы, то такие же ионные потоки сразу открываются на соседнем участке мембраны, потом — на участке чуть подальше и т. д. Электрические свойства мембраны последовательно меняются вдоль нейронного отростка — это и есть бегущий импульс. Миелин окутывает аксоны не всплошную с начала и до конца. В миелиновой обмотке есть пробелы, где мембрана не покрыта миелином, — перехваты Ранвье (названные так в честь открывшего их французского физиолога Луи Антуана Ранвье). И когда импульс распространяется по аксону, то перегруппировка ионов происходит как раз на перехватах Ранвье. То есть импульс не переползает медленно между участками, которые находятся вплотную друг к другу, а скачет от одного перехвата к другому. И если в аксоне без миелина импульс бежит со скоростью 0,5—10 м/с, то в таком же аксоне, но с миелином, скорость импульса достигает 150 м/с.
Скопления аксонов, обмотанных миелином, выглядят светлее, поэтому области в мозге, где преобладают аксонные «провода», называют белым веществом. (Скопления дендритов, которые обходятся без миелина, образуют серое вещество. Поскольку дендриты намного короче аксонов, они не передают импульсы на большие расстояния и скорость для них не так важна.) Нейроны не сами вырабатывают миелин, для того есть специальные клетки — олигодендроциты в центральной нервной системе и шванновские клетки в периферических нервах. И те и другие относятся к глие, или нейроглие — так называют совокупность различных клеток нервной системы, которые обслуживают нейроны, создавая им условия для работы. В последнее время появляется всё больше данных о том, что глиальные клетки не просто обслуживают нейроны, но напрямую вмешиваются в их работу (см. статью «Иммунные ”электрики” мозга», «Наука и жизнь» № 8, 2020 г.). Задача олигодендроцитов и шванновских клеток — сделать нейронам миелиновую обмотку. Олигодендроцит или шванновская клетка выпячивают собственную мембрану и обхватывают аксон, мембрана нарастает — и в итоге вокруг аксона получается слоистый липидный рулон. Глиальная клетка остаётся живой и поддерживает целостность миелиновой обмотки на том участке аксона, за который она отвечает.
Разрушение миелиновой оболочки приводит к неврологическим симптомам различного вида и различной степени тяжести. Есть много заболеваний, связанных с утратой миелина на аксонах, и рассеянный склероз среди них — самое известное. Это одна из аутоиммунных болезней, когда иммунитет по какой-то причине атакует собственные клетки и молекулы организма. При рассеянном склерозе срабатывают разные иммунные механизмы, в которых участвуют как иммунные клетки мозга, так и иммунные клетки, вошедшие в мозг из крови. Но, так или иначе, заканчивается всё тем, что миелиновая оболочка вокруг аксонов разрушается, а иногда разрушаются и сами аксоны. В очаг болезни приходят астроциты — так называется ещё одна разновидность глиальных клеток. Их задача — поддерживать и питать нейроны, а также залечивать повреждения; именно это они и делают, стараясь зарубцевать больной участок и формируя характерную бляшку. Стоит добавить, что обычно рассеянный склероз поражает центральную нервную систему; периферические нервы страдают от него редко.
Нервная система выполняет важнейшие функции в организме. Она отвечает за все действия и мысли человека, формирует его личность. Но вся эта сложная работы была бы невозможна без одной составляющей — миелина.
Миелин – это вещество, образующее миелиновую (мякотную) оболочку, которая отвечает за электроизоляцию нервных волокон и скорость передачи электрического импульса.
Анатомия миелина в строении нерва
Главная клетка нервной системы – нейрон. Тело нейрона называется сома. Внутри нее находится ядро. Тело нейрона окружено короткими отростками, которые называются дендриты. Они отвечают за связь с другими нейронами. От сомы отходит один длинный отросток – аксон. Он несет импульс от нейрона к другим клеткам. Чаще всего на конце он соединяется с дендритами других нервных клеток.
Всю поверхность аксона покрывает миелиновая оболочка, которая представляет собой отросток клетки Шванна, лишенный цитоплазмы. По сути, это несколько слоев клеточной мембраны, обернутые вокруг аксона.
Шванновские клетки, обволакивающие аксон, разделяются перехватами Ранвье, в которых отсутствует миелин.
Функции
Основными функциями миелиновой оболочки являются:
- изоляция аксона;
- ускорение проведения импульса;
- экономия энергии за счет сохранения ионных потоков;
- опора нервного волокна;
- питание аксона.
Как работают импульсы
Нервные клетки изолированы благодаря своей оболочке, но все же взаимосвязаны между собой. Участки, в которых клетки соприкасаются, называются синапсы. Это место, где встречаются аксон одной клетки и сома или дендрит другой.
Электрический импульс может передаваться внутри одной клетки или от нейрона к нейрону. Это сложный электрохимический процесс, который основан на перемещении ионов через оболочку нервной клетки.
В спокойном состоянии внутрь нейрона попадают только ионы калия, а ионы натрия остаются снаружи. В момент возбуждения они начинаются меняться местами. Аксон положительно заряжается изнутри. Затем натрий перестает поступать через мембрану, а отток калия не прекращается.
Изменение напряжения из-за движения ионов калия и натрия называется «потенциал действия». Он распространяется медленно, но миелиновая оболочка, обволакивающая аксон, ускоряет это процесс, препятствуя оттоку и притоку ионов калия и натрия из тела аксона.
Проходя через перехват Ранвье, импульс перескакивает с одного участка аксона на другой, что и позволяет ему двигаться быстрее.
После того, как потенциал действия пересекает разрыв в миелине, импульс останавливается, и возвращается состояние покоя.
Такой способ передачи энергии характерен для ЦНС. Что касается вегетативной нервной системы, в ней часто встречаются аксоны, покрытые малым количеством миелина или вообще не покрытые им. Скачки между шванновскими клетками не осуществляются, и импульс проходит гораздо медленнее.
Состав
Миелиновый слой состоит из двух слоев липидов и трех слоев белка. Липидов в нем гораздо больше (70-75%):
- фосфолипиды (до 50%);
- холестерин (25%);
- глактоцереброзид (20%) и др.
Большое содержание жиров обусловливает белый цвет миелиновой оболочки, благодаря чему нейроны, покрытые ей, называются «белым веществом».
Белковые слои тоньше липидных. Содержание белка в миелине – 25-30%:
- протеолипид (35-50%);
- основной белок миелина (30%);
- белки Вольфграма (20%).
Существуют простые и сложные белки нервной ткани.
Роль липидов в строении оболочки
Липиды играют ключевую роль в строении мякотной оболочки. Они являются структурным материалом нервной ткани и защищают аксон от потери энергии и ионных потоков. Молекулы липидов обладают способностью восстанавливать ткани мозга после повреждений. Липиды миелина отвечают за адаптацию зрелой нервной системы. Они выступают в роли рецепторов гормонов и осуществляют коммуникацию между клетками.
Роль белков
Немаловажное значение в строении миелинового слоя имеют молекулы белков. Они наряду с липидами выступают в роли строительного материала нервной ткани. Их главной задачей является транспортировка питательных веществ в аксон. Также они расшифровывают сигналы, поступающие в нервную клетку и ускоряют реакции в ней. Участие в обмене веществ – важная функция молекул белка миелиновой оболочки.
Дефекты миелинизации
Разрушение миелинового слоя нервной системы – очень серьезная патология, из-за которой происходит нарушение передачи нервного импульса. Она вызывает опасные заболевания, зачастую несовместимые с жизнью. Существуют два типа факторов, влияющие на возникновение демиелинизации:
- генетическая предрасположенность к разрушению миелина;
- воздействие на миелин внутренних или внешних факторов.
- Демиелизация делится на три вида:
- острая;
- ремиттирующая;
- острая монофазная.
Почему происходит разрушение
Наиболее частыми причинами разрушения мякотной оболочки являются:
- ревматические болезни;
- существенное преобладание белков и жиров в питании;
- генетическая предрасположенность;
- бактериальные инфекции;
- отравление тяжелыми металлами;
- опухоли и метастазы;
- продолжительные сильные стрессы;
- плохая экология;
- патологии иммунной системы;
- длительный прием нейролептиков.
Заболевания вследствие демиелинизации
Демиелинизирующие заболевания центральной нервной системы:
- Болезнь Канавана – генетическое заболевание, возникающее в раннем возрасте. Его характеризуют слепота, проблемы с глотанием и приемом пищи, нарушение моторики и развития. Также следствием этой болезни являются эпилепсия, макроцефалия и мышечная гипотония.
- Болезнь Бинсвангера. Чаще всего вызвана артериальной гипертонией. Больных ожидают расстройства мышления, слабоумие, а также нарушения ходьбы и функций тазовых органов.
- Рассеянный склероз. Может вызвать поражения нескольких частей ЦНС. Ему сопутствуют парезы, параличи, судороги и нарушение моторики. Также в качестве симптомов рассеянного склероза выступают поведенческие расстройства, ослабление лицевых мышц и голосовых связок, нарушение чувствительности. Зрение нарушается, меняется восприятие цвета и яркости. Рассеянный склероз также характеризуется расстройствами тазовых органов и дистрофией ствола мозга, мозжечка и черепных нервов.
- Болезнь Девика – демиелинизация в зрительном нерве и спинном мозге. Болезнь характеризуют нарушения координации, чувствительности и функций тазовых органов. Ее отличают серьезные нарушения зрения и даже слепота. В клинической картине также наблюдаются парезы, мышечная слабость и вегетативная дисфункция.
- Синдром осмотической демиелинизации. Возникает из-за недостатка натрия в клетках. Симптомами выступают судороги, нарушения личности, потери сознания вплоть до комы и смерти. Следствием заболевания являются отек головного мозга, инфаркт гипоталамуса и грыжа ствола мозга.
- Миелопатии – различные дистрофические изменения в спинном мозге. Их характеризуют мышечные нарушения, сенсорные расстройства и дисфункция тазовых органов.
- Лейкоэнцефалопатия – разрушение миелиновой оболочки в подкорке головного мозга. Больных мучают постоянная головная боль и эпилептические припадки. Также наблюдаются нарушения зрения, речи, координации и ходьбы. Снижается чувствительность, наблюдаются расстройства личности и сознания, прогрессирует слабоумие.
- Лейкодистрофия – генетическое нарушение метаболизма, вызывающее разрушение миелина. Течение болезни сопровождают мышечные и двигательные расстройства, параличи, нарушение зрения и слуха, прогрессирующее слабоумие.
Демиелинизирующие заболевания периферической нервной системы:
- Синдром Гийена-Барре – острая воспалительная демиелинизация. Она характеризуется мышечными и двигательными нарушениями, дыхательной недостаточностью, частичным или полным отсутствием сухожильных рефлексов. Больные страдают заболеваниями сердца, нарушением работы пищеварительной системы и тазовых органов. Парезы и нарушения чувствительности так же являются признаками этого синдрома.
- Невральная амиотрофия Шарко-Мари-Тута – наследственная патология миелиновой оболочки. Ее отличают нарушения чувствительности, дистрофия конечностей, деформация позвоночника и тремор.
Это лишь часть заболеваний, возникающих из-за разрушения миелинового слоя. Симптомы в большинстве случаев схожи. Точный диагноз можно поставить лишь после проведения компьютерной или магнитно-резонансной томографии. Немаловажную роль в постановке диагноза играет уровень квалификации врача.
Принципы лечения дефектов оболочки
Заболевания, связанные с разрушением мякотной оболочки, очень сложно лечить. Терапия направлена в основном на купирование симптомов и остановку процессов разрушения. Чем раньше диагностировано заболевание, тем больше шансов остановить его течение.
Возможности восстановления миелина
Благодаря своевременному лечению можно запустить процесс восстановления миелина. Однако, новая миелиновая оболочка не будет так же хорошо выполнять свои функции. Кроме того, болезнь может перейти в хроническую стадию, а симптомы сохранятся, лишь слегка сгладятся. Но даже незначительная ремиелинизация способна остановить ход болезни и частично вернуть утраченные функции.
Современные лекарственные средства, направленные на регенерацию миелина более эффективны, но отличаются очень высокой стоимостью.
Терапия
Для лечения заболеваний, вызванных разрушением миелиновой оболочки, используются следующие препараты и процедуры:
- бета-интерфероны (останавливают течение заболевания, снижают риск возникновения рецидивов и инвалидности);
- иммуномодуляторы (воздействуют на активность иммунной системы);
- миорелаксанты (способствуют восстановлению двигательных функций);
- ноотропы (восстанавливают проводниковую активность);
- противовоспалительные (снимают воспалительный процесс, вызвавший разрушение миелина);
- нейропротекторы (предупреждают повреждение нейронов мозга);
- обезболивающие и противосудорожные препараты;
- витамины и антидепрессанты;
- фильтрация ликвора (процедура, направленная на очищение спинномозговой жидкости).
Прогноз по заболеваниям
В настоящее время лечение демиелинизации не дает стопроцентного результата, но учеными активно ведутся разработки лекарственных средств, направленных на восстановление мякотной оболочки. Исследования проводятся по следующим направлениям:
- Стимуляция олигодендроцитов. Это клетки, производящие миелин. В организме, пораженном демиелинизацией, они не работают. Искусственная стимуляция этих клеток поможет запустить процесс восстановления разрушенных участков миелиновой оболочки.
- Стимуляция стволовых клеток. Стволовые клетки могут превращаться в полноценную ткань. Есть вероятность, что они могут заполнять и мякотную оболочку.
- Регенерация гематоэнцефалического барьера. При демиелинизации этот барьер разрушается и позволяет лимфоцитам негативно влиять на миелин. Его восстановление защищает миелиновый слой от атаки иммунной системы.
Возможно, в скором времени заболевания, связанные с разрушением миелина, перестанут быть неизлечимыми.
: 30 окт 2020 , Братство кольца , том 88,
№3
МИЕЛИНовая защита нейрона: все начинается до рождения
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом – миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз – хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей – через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода – сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18—20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Не все знают, что миелин – это множество слоев клеточной мембраны, много раз «намотанных» на аксон. Формируется миелин плоскими выростами «служебных» глиальных клеток, цитоплазма в которых практически отсутствует. Миелиновая оболочка не непрерывна, а дискретна, с промежутками (перехватами Ранвье). Поэтому аксон обладает более быстрой скачкообразной проводимостью: скорость прохождения сигнала по волокнам с миелином и без него может отличаться в сотни раз. Что касается молекулярного состава «изолятора», то он, как и все клеточные мембраны, состоит преимущественно из липидов и белков
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
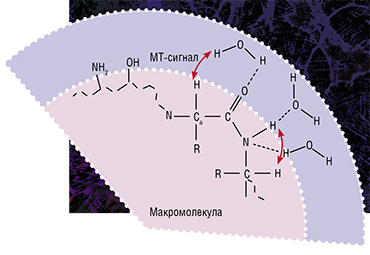
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) – биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин – в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы – врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Литература
Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635
Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH)
: 30 окт 2020 , Братство кольца , том 88,
№3