| Axon | |
|---|---|

An axon of a multipolar neuron |
|
| Identifiers | |
| MeSH | D001369 |
| FMA | 67308 |
| Anatomical terminology
[edit on Wikidata] |
An axon (from Greek ἄξων áxōn, axis), or nerve fiber (or nerve fibre: see spelling differences), is a long, slender projection of a nerve cell, or neuron, in vertebrates, that typically conducts electrical impulses known as action potentials away from the nerve cell body. The function of the axon is to transmit information to different neurons, muscles, and glands. In certain sensory neurons (pseudounipolar neurons), such as those for touch and warmth, the axons are called afferent nerve fibers and the electrical impulse travels along these from the periphery to the cell body and from the cell body to the spinal cord along another branch of the same axon. Axon dysfunction can be the cause of many inherited and acquired neurological disorders that affect both the peripheral and central neurons. Nerve fibers are classed into three types – group A nerve fibers, group B nerve fibers, and group C nerve fibers. Groups A and B are myelinated, and group C are unmyelinated. These groups include both sensory fibers and motor fibers. Another classification groups only the sensory fibers as Type I, Type II, Type III, and Type IV.
An axon is one of two types of cytoplasmic protrusions from the cell body of a neuron; the other type is a dendrite. Axons are distinguished from dendrites by several features, including shape (dendrites often taper while axons usually maintain a constant radius), length (dendrites are restricted to a small region around the cell body while axons can be much longer), and function (dendrites receive signals whereas axons transmit them). Some types of neurons have no axon and transmit signals from their dendrites. In some species, axons can emanate from dendrites known as axon-carrying dendrites.[1] No neuron ever has more than one axon; however in invertebrates such as insects or leeches the axon sometimes consists of several regions that function more or less independently of each other.[2]
Axons are covered by a membrane known as an axolemma; the cytoplasm of an axon is called axoplasm. Most axons branch, in some cases very profusely. The end branches of an axon are called telodendria. The swollen end of a telodendron is known as the axon terminal which joins the dendron or cell body of another neuron forming a synaptic connection. Axons make contact with other cells – usually other neurons but sometimes muscle or gland cells – at junctions called synapses. In some circumstances, the axon of one neuron may form a synapse with the dendrites of the same neuron, resulting in an autapse. At a synapse, the membrane of the axon closely adjoins the membrane of the target cell, and special molecular structures serve to transmit electrical or electrochemical signals across the gap. Some synaptic junctions appear along the length of an axon as it extends; these are called en passant («in passing») synapses and can be in the hundreds or even the thousands along one axon.[3] Other synapses appear as terminals at the ends of axonal branches.
A single axon, with all its branches taken together, can innervate multiple parts of the brain and generate thousands of synaptic terminals. A bundle of axons make a nerve tract in the central nervous system,[4] and a fascicle in the peripheral nervous system. In placental mammals the largest white matter tract in the brain is the corpus callosum, formed of some 200 million axons in the human brain.[4]
Anatomy[edit]
A typical myelinated axon
Axons are the primary transmission lines of the nervous system, and as bundles they form nerves. Some axons can extend up to one meter or more while others extend as little as one millimeter. The longest axons in the human body are those of the sciatic nerve, which run from the base of the spinal cord to the big toe of each foot. The diameter of axons is also variable. Most individual axons are microscopic in diameter (typically about one micrometer (µm) across). The largest mammalian axons can reach a diameter of up to 20 µm. The squid giant axon, which is specialized to conduct signals very rapidly, is close to 1 millimeter in diameter, the size of a small pencil lead. The numbers of axonal telodendria (the branching structures at the end of the axon) can also differ from one nerve fiber to the next. Axons in the central nervous system (CNS) typically show multiple telodendria, with many synaptic end points. In comparison, the cerebellar granule cell axon is characterized by a single T-shaped branch node from which two parallel fibers extend. Elaborate branching allows for the simultaneous transmission of messages to a large number of target neurons within a single region of the brain.
There are two types of axons in the nervous system: myelinated and unmyelinated axons.[5] Myelin is a layer of a fatty insulating substance, which is formed by two types of glial cells: Schwann cells and oligodendrocytes. In the peripheral nervous system Schwann cells form the myelin sheath of a myelinated axon. Oligodendrocytes form the insulating myelin in the CNS. Along myelinated nerve fibers, gaps in the myelin sheath known as nodes of Ranvier occur at evenly spaced intervals. The myelination enables an especially rapid mode of electrical impulse propagation called saltatory conduction.
The myelinated axons from the cortical neurons form the bulk of the neural tissue called white matter in the brain. The myelin gives the white appearance to the tissue in contrast to the grey matter of the cerebral cortex which contains the neuronal cell bodies. A similar arrangement is seen in the cerebellum. Bundles of myelinated axons make up the nerve tracts in the CNS. Where these tracts cross the midline of the brain to connect opposite regions they are called commissures. The largest of these is the corpus callosum that connects the two cerebral hemispheres, and this has around 20 million axons.[4]
The structure of a neuron is seen to consist of two separate functional regions, or compartments – the cell body together with the dendrites as one region, and the axonal region as the other.
Axonal region[edit]
The axonal region or compartment, includes the axon hillock, the initial segment, the rest of the axon, and the axon telodendria, and axon terminals. It also includes the myelin sheath. The Nissl bodies that produce the neuronal proteins are absent in the axonal region.[3] Proteins needed for the growth of the axon, and the removal of waste materials, need a framework for transport. This axonal transport is provided for in the axoplasm by arrangements of microtubules and intermediate filaments known as neurofilaments.
Axon hillock[edit]
Detail showing microtubules at axon hillock and initial segment.
The axon hillock is the area formed from the cell body of the neuron as it extends to become the axon. It precedes the initial segment. The received action potentials that are summed in the neuron are transmitted to the axon hillock for the generation of an action potential from the initial segment.
Axonal initial segment[edit]
The axonal initial segment (AIS) is a structurally and functionally separate microdomain of the axon.[6][7] One function of the initial segment is to separate the main part of an axon from the rest of the neuron; another function is to help initiate action potentials.[8] Both of these functions support neuron cell polarity, in which dendrites (and, in some cases the soma) of a neuron receive input signals at the basal region, and at the apical region the neuron’s axon provides output signals.[9]
The axon initial segment is unmyelinated and contains a specialized complex of proteins. It is between approximately 20 and 60 µm in length and functions as the site of action potential initiation.[10][11] Both the position on the axon and the length of the AIS can change showing a degree of plasticity that can fine-tune the neuronal output.[10][12] A longer AIS is associated with a greater excitability.[12] Plasticity is also seen in the ability of the AIS to change its distribution and to maintain the activity of neural circuitry at a constant level.[13]
The AIS is highly specialized for the fast conduction of nerve impulses. This is achieved by a high concentration of voltage-gated sodium channels in the initial segment where the action potential is initiated.[13] The ion channels are accompanied by a high number of cell adhesion molecules and scaffolding proteins that anchor them to the cytoskeleton.[10] Interactions with ankyrin G are important as it is the major organizer in the AIS.[10]
Axonal transport[edit]
The axoplasm is the equivalent of cytoplasm in the cell. Microtubules form in the axoplasm at the axon hillock. They are arranged along the length of the axon, in overlapping sections, and all point in the same direction – towards the axon terminals.[14] This is noted by the positive endings of the microtubules. This overlapping arrangement provides the routes for the transport of different materials from the cell body.[14] Studies on the axoplasm has shown the movement of numerous vesicles of all sizes to be seen along cytoskeletal filaments – the microtubules, and neurofilaments, in both directions between the axon and its terminals and the cell body.
Outgoing anterograde transport from the cell body along the axon, carries mitochondria and membrane proteins needed for growth to the axon terminal. Ingoing retrograde transport carries cell waste materials from the axon terminal to the cell body.[15] Outgoing and ingoing tracks use different sets of motor proteins.[14] Outgoing transport is provided by kinesin, and ingoing return traffic is provided by dynein. Dynein is minus-end directed.[15] There are many forms of kinesin and dynein motor proteins, and each is thought to carry a different cargo.[14] The studies on transport in the axon led to the naming of kinesin.[14]
Myelination[edit]
TEM of a myelinated axon in cross-section.
In the nervous system, axons may be myelinated, or unmyelinated. This is the provision of an insulating layer, called a myelin sheath. The myelin membrane is unique in its relatively high lipid to protein ratio.[16]
In the peripheral nervous system axons are myelinated by glial cells known as Schwann cells. In the central nervous system the myelin sheath is provided by another type of glial cell, the oligodendrocyte. Schwann cells myelinate a single axon. An oligodendrocyte can myelinate up to 50 axons.[17]
The composition of myelin is different in the two types. In the CNS the major myelin protein is proteolipid protein, and in the PNS it is myelin basic protein.
Nodes of Ranvier[edit]
Nodes of Ranvier (also known as myelin sheath gaps) are short unmyelinated segments of a myelinated axon, which are found periodically interspersed between segments of the myelin sheath. Therefore, at the point of the node of Ranvier, the axon is reduced in diameter.[18] These nodes are areas where action potentials can be generated. In saltatory conduction, electrical currents produced at each node of Ranvier are conducted with little attenuation to the next node in line, where they remain strong enough to generate another action potential. Thus in a myelinated axon, action potentials effectively «jump» from node to node, bypassing the myelinated stretches in between, resulting in a propagation speed much faster than even the fastest unmyelinated axon can sustain.
Axon terminals[edit]
An axon can divide into many branches called telodendria (Greek for ‘end of tree’). At the end of each telodendron is an axon terminal (also called a synaptic bouton, or terminal bouton). Axon terminals contain synaptic vesicles that store the neurotransmitter for release at the synapse. This makes multiple synaptic connections with other neurons possible. Sometimes the axon of a neuron may synapse onto dendrites of the same neuron, when it is known as an autapse.
Action potentials[edit]
| Structure of a typical chemical synapse |
|---|
|
Postsynaptic Voltage- Synaptic Neurotransmitter Receptor Neurotransmitter Axon terminal Synaptic cleft Dendrite |
Most axons carry signals in the form of action potentials, which are discrete electrochemical impulses that travel rapidly along an axon, starting at the cell body and terminating at points where the axon makes synaptic contact with target cells. The defining characteristic of an action potential is that it is «all-or-nothing» – every action potential that an axon generates has essentially the same size and shape. This all-or-nothing characteristic allows action potentials to be transmitted from one end of a long axon to the other without any reduction in size. There are, however, some types of neurons with short axons that carry graded electrochemical signals, of variable amplitude.
When an action potential reaches a presynaptic terminal, it activates the synaptic transmission process. The first step is rapid opening of calcium ion channels in the membrane of the axon, allowing calcium ions to flow inward across the membrane. The resulting increase in intracellular calcium concentration causes synaptic vesicles (tiny containers enclosed by a lipid membrane) filled with a neurotransmitter chemical to fuse with the axon’s membrane and empty their contents into the extracellular space. The neurotransmitter is released from the presynaptic nerve through exocytosis. The neurotransmitter chemical then diffuses across to receptors located on the membrane of the target cell. The neurotransmitter binds to these receptors and activates them. Depending on the type of receptors that are activated, the effect on the target cell can be to excite the target cell, inhibit it, or alter its metabolism in some way. This entire sequence of events often takes place in less than a thousandth of a second. Afterward, inside the presynaptic terminal, a new set of vesicles is moved into position next to the membrane, ready to be released when the next action potential arrives. The action potential is the final electrical step in the integration of synaptic messages at the scale of the neuron.[5]
(A) pyramidal cell, interneuron, and short durationwaveform (Axon), overlay of the three average waveforms;
(B) Average and standard error of peak-trough time for pyramidal cells interneurons, and putative axons;
(C) Scatter plot of signal to noise ratios for individual units againstpeak-trough time for axons, pyramidal cells (PYR) and interneurons (INT).
Extracellular recordings of action potential propagation in axons has been demonstrated in freely moving animals. While extracellular somatic action potentials have been used to study cellular activity in freely moving animals such as place cells, axonal activity in both white and gray matter can also be recorded. Extracellular recordings of axon action potential propagation is distinct from somatic action potentials in three ways: 1. The signal has a shorter peak-trough duration (~150μs) than of pyramidal cells (~500μs) or interneurons (~250μs). 2. The voltage change is triphasic. 3. Activity recorded on a tetrode is seen on only one of the four recording wires. In recordings from freely moving rats, axonal signals have been isolated in white matter tracts including the alveus and the corpus callosum as well hippocampal gray matter.[19]
In fact, the generation of action potentials in vivo is sequential in nature, and these sequential spikes constitute the digital codes in the neurons. Although previous studies indicate an axonal origin of a single spike evoked by short-term pulses, physiological signals in vivo trigger the initiation of sequential spikes at the cell bodies of the neurons.[20][21]
In addition to propagating action potentials to axonal terminals, the axon is able to amplify the action potentials, which makes sure a secure propagation of sequential action potentials toward the axonal terminal. In terms of molecular mechanisms, voltage-gated sodium channels in the axons possess lower threshold and shorter refractory period in response to short-term pulses.[22]
Development and growth[edit]
Development[edit]
The development of the axon to its target, is one of the six major stages in the overall development of the nervous system.[23] Studies done on cultured hippocampal neurons suggest that neurons initially produce multiple neurites that are equivalent, yet only one of these neurites is destined to become the axon.[24] It is unclear whether axon specification precedes axon elongation or vice versa,[25] although recent evidence points to the latter. If an axon that is not fully developed is cut, the polarity can change and other neurites can potentially become the axon. This alteration of polarity only occurs when the axon is cut at least 10 μm shorter than the other neurites. After the incision is made, the longest neurite will become the future axon and all the other neurites, including the original axon, will turn into dendrites.[26] Imposing an external force on a neurite, causing it to elongate, will make it become an axon.[27] Nonetheless, axonal development is achieved through a complex interplay between extracellular signaling, intracellular signaling and cytoskeletal dynamics.
[edit]
The extracellular signals that propagate through the extracellular matrix surrounding neurons play a prominent role in axonal development.[28] These signaling molecules include proteins, neurotrophic factors, and extracellular matrix and adhesion molecules.
Netrin (also known as UNC-6) a secreted protein, functions in axon formation. When the UNC-5 netrin receptor is mutated, several neurites are irregularly projected out of neurons and finally a single axon is extended anteriorly.[29][30][31][32] The neurotrophic factors – nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NTF3) are also involved in axon development and bind to Trk receptors.[33]
The ganglioside-converting enzyme plasma membrane ganglioside sialidase (PMGS), which is involved in the activation of TrkA at the tip of neutrites, is required for the elongation of axons. PMGS asymmetrically distributes to the tip of the neurite that is destined to become the future axon.[34]
Intracellular signaling[edit]
During axonal development, the activity of PI3K is increased at the tip of destined axon. Disrupting the activity of PI3K inhibits axonal development. Activation of PI3K results in the production of phosphatidylinositol (3,4,5)-trisphosphate (PtdIns) which can cause significant elongation of a neurite, converting it into an axon. As such, the overexpression of phosphatases that dephosphorylate PtdIns leads into the failure of polarization.[28]
Cytoskeletal dynamics[edit]
The neurite with the lowest actin filament content will become the axon. PGMS concentration and f-actin content are inversely correlated; when PGMS becomes enriched at the tip of a neurite, its f-actin content is substantially decreased.[34] In addition, exposure to actin-depolimerizing drugs and toxin B (which inactivates Rho-signaling) causes the formation of multiple axons. Consequently, the interruption of the actin network in a growth cone will promote its neurite to become the axon.[35]
Growth[edit]
Axon of nine-day-old mouse with growth cone visible
Growing axons move through their environment via the growth cone, which is at the tip of the axon. The growth cone has a broad sheet-like extension called a lamellipodium which contain protrusions called filopodia. The filopodia are the mechanism by which the entire process adheres to surfaces and explores the surrounding environment. Actin plays a major role in the mobility of this system. Environments with high levels of cell adhesion molecules (CAMs) create an ideal environment for axonal growth. This seems to provide a «sticky» surface for axons to grow along. Examples of CAMs specific to neural systems include N-CAM, TAG-1 – an axonal glycoprotein[36] – and MAG, all of which are part of the immunoglobulin superfamily. Another set of molecules called extracellular matrix-adhesion molecules also provide a sticky substrate for axons to grow along. Examples of these molecules include laminin, fibronectin, tenascin, and perlecan. Some of these are surface bound to cells and thus act as short range attractants or repellents. Others are difusible ligands and thus can have long range effects.
Cells called guidepost cells assist in the guidance of neuronal axon growth. These cells that help axon guidance, are typically other neurons that are sometimes immature. When the axon has completed its growth at its connection to the target, the diameter of the axon can increase by up to five times, depending on the speed of conduction required.[37]
It has also been discovered through research that if the axons of a neuron were damaged, as long as the soma (the cell body of a neuron) is not damaged, the axons would regenerate and remake the synaptic connections with neurons with the help of guidepost cells. This is also referred to as neuroregeneration.[38]
Nogo-A is a type of neurite outgrowth inhibitory component that is present in the central nervous system myelin membranes (found in an axon). It has a crucial role in restricting axonal regeneration in adult mammalian central nervous system. In recent studies, if Nogo-A is blocked and neutralized, it is possible to induce long-distance axonal regeneration which leads to enhancement of functional recovery in rats and mouse spinal cord. This has yet to be done on humans.[39] A recent study has also found that macrophages activated through a specific inflammatory pathway activated by the Dectin-1 receptor are capable of promoting axon recovery, also however causing neurotoxicity in the neuron.[40]
Length regulation[edit]
Axons vary largely in length from a few micrometers up to meters in some animals. This emphasizes that there must be a cellular length regulation mechanism allowing the neurons both to sense the length of their axons and to control their growth accordingly. It was discovered that motor proteins play an important role in regulating the length of axons.[41] Based on this observation, researchers developed an explicit model for axonal growth describing how motor proteins could affect the axon length on the molecular level.[42][43][44][45] These studies suggest that motor proteins carry signaling molecules from the soma to the growth cone and vice versa whose concentration oscillates in time with a length-dependent frequency.
Classification[edit]
The axons of neurons in the human peripheral nervous system can be classified based on their physical features and signal conduction properties. Axons were known to have different thicknesses (from 0.1 to 20 µm)[3] and these differences were thought to relate to the speed at which an action potential could travel along the axon – its conductance velocity. Erlanger and Gasser proved this hypothesis, and identified several types of nerve fiber, establishing a relationship between the diameter of an axon and its nerve conduction velocity. They published their findings in 1941 giving the first classification of axons.
Axons are classified in two systems. The first one introduced by Erlanger and Gasser, grouped the fibers into three main groups using the letters A, B, and C. These groups, group A, group B, and group C include both the sensory fibers (afferents) and the motor fibers (efferents). The first group A, was subdivided into alpha, beta, gamma, and delta fibers – Aα, Aβ, Aγ, and Aδ. The motor neurons of the different motor fibers, were the lower motor neurons – alpha motor neuron, beta motor neuron, and gamma motor neuron having the Aα, Aβ, and Aγ nerve fibers, respectively.
Later findings by other researchers identified two groups of Aa fibers that were sensory fibers. These were then introduced into a system that only included sensory fibers (though some of these were mixed nerves and were also motor fibers). This system refers to the sensory groups as Types and uses Roman numerals: Type Ia, Type Ib, Type II, Type III, and Type IV.
Motor[edit]
Lower motor neurons have two kind of fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (meters/second) |
Associated muscle fibers |
|---|---|---|---|---|---|
| Alpha (α) motor neuron | Aα | 13–20 | Yes | 80–120 | Extrafusal muscle fibers |
| Beta (β) motor neuron | Aβ | ||||
| Gamma (γ) motor neuron | Aγ | 5-8 | Yes | 4–24[46][47] | Intrafusal muscle fibers |
Sensory[edit]
Different sensory receptors innervate different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (m/s) |
Associated sensory receptors | Proprioceptors | Mechanoceptors | Nociceptors and thermoreceptors |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13–20 | Yes | 80–120 | Primary receptors of muscle spindle (annulospiral ending) | ✔ | ||
| Ib | Aα | 13–20 | Yes | 80–120 | Golgi tendon organ | |||
| II | Aβ | 6–12 | Yes | 33–75 | Secondary receptors of muscle spindle (flower-spray ending). All cutaneous mechanoreceptors |
✔ | ||
| III | Aδ | 1–5 | Thin | 3–30 | Free nerve endings of touch and pressure Nociceptors of lateral spinothalamic tract Cold thermoreceptors |
✔ | ||
| IV | C | 0.2–1.5 | No | 0.5–2.0 | Nociceptors of anterior spinothalamic tract Warmth receptors |
Autonomic[edit]
The autonomic nervous system has two kinds of peripheral fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin[48] | Conduction velocity (m/s) |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 | Yes | 3–15 |
| postganglionic fibers | C | 0.2–1.5 | No | 0.5–2.0 |
Clinical significance[edit]
In order of degree of severity, injury to a nerve can be described as neurapraxia, axonotmesis, or neurotmesis.
Concussion is considered a mild form of diffuse axonal injury.[49] Axonal injury can also cause central chromatolysis. The dysfunction of axons in the nervous system is one of the major causes of many inherited neurological disorders that affect both peripheral and central neurons.[5]
When an axon is crushed, an active process of axonal degeneration takes place at the part of the axon furthest from the cell body. This degeneration takes place quickly following the injury, with the part of the axon being sealed off at the membranes and broken down by macrophages. This is known as Wallerian degeneration.[50] Dying back of an axon can also take place in many neurodegenerative diseases, particularly when axonal transport is impaired, this is known as Wallerian-like degeneration.[51] Studies suggest that the degeneration happens as
a result of the axonal protein NMNAT2, being prevented from reaching all of the axon.[52]
Demyelination of axons causes the multitude of neurological symptoms found in the disease multiple sclerosis.
Dysmyelination is the abnormal formation of the myelin sheath. This is implicated in several leukodystrophies, and also in schizophrenia.[53][54][55]
A severe traumatic brain injury can result in widespread lesions to nerve tracts damaging the axons in a condition known as diffuse axonal injury. This can lead to a persistent vegetative state.[56] It has been shown in studies on the rat that axonal damage from a single mild traumatic brain injury, can leave a susceptibility to further damage, after repeated mild traumatic brain injuries.[57]
A nerve guidance conduit is an artificial means of guiding axon growth to enable neuroregeneration, and is one of the many treatments used for different kinds of nerve injury.
History[edit]
German anatomist Otto Friedrich Karl Deiters is generally credited with the discovery of the axon by distinguishing it from the dendrites.[5] Swiss Rüdolf Albert von Kölliker and German Robert Remak were the first to identify and characterize the axon initial segment. Kölliker named the axon in 1896.[58] Louis-Antoine Ranvier was the first to describe the gaps or nodes found on axons and for this contribution these axonal features are now commonly referred to as the nodes of Ranvier. Santiago Ramón y Cajal, a Spanish anatomist, proposed that axons were the output components of neurons, describing their functionality.[5] Joseph Erlanger and Herbert Gasser earlier developed the classification system for peripheral nerve fibers,[59] based on axonal conduction velocity, myelination, fiber size etc. Alan Hodgkin and Andrew Huxley also employed the squid giant axon (1939) and by 1952 they had obtained a full quantitative description of the ionic basis of the action potential, leading to the formulation of the Hodgkin–Huxley model. Hodgkin and Huxley were awarded jointly the Nobel Prize for this work in 1963. The formulae detailing axonal conductance were extended to vertebrates in the Frankenhaeuser–Huxley equations. The understanding of the biochemical basis for action potential propagation has advanced further, and includes many details about individual ion channels.
Other animals[edit]
The axons in invertebrates have been extensively studied. The longfin inshore squid, often used as a model organism has the longest known axon.[60] The giant squid has the largest axon known. Its size ranges from 0.5 (typically) to 1 mm in diameter and is used in the control of its jet propulsion system. The fastest recorded conduction speed of 210 m/s, is found in the ensheathed axons of some pelagic Penaeid shrimps[61] and the usual range is between 90 and 200 meters/s[62] (cf 100–120 m/s for the fastest myelinated vertebrate axon.)
In other cases as seen in rat studies an axon originates from a dendrite; such axons are said to have «dendritic origin». Some axons with dendritic origin similarly have a «proximal» initial segment that starts directly at the axon origin, while others have a «distal» initial segment, discernibly separated from the axon origin.[63] In many species some of the neurons have axons that emanate from the dendrite and not from the cell body, and these are known as axon-carrying dendrites.[1] In many cases, an axon originates at an axon hillock on the soma; such axons are said to have «somatic origin». Some axons with somatic origin have a «proximal» initial segment adjacent the axon hillock, while others have a «distal» initial segment, separated from the soma by an extended axon hillock.[63]
See also[edit]
- Electrophysiology
- Ganglionic eminence
- Giant axonal neuropathy
- Neuronal tracing
- Pioneer axon
References[edit]
- ^ a b Triarhou LC (2014). «Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues». Frontiers in Neuroanatomy. 8: 133. doi:10.3389/fnana.2014.00133. PMC 4235383. PMID 25477788.
- ^ Yau KW (December 1976). «Receptive fields, geometry and conduction block of sensory neurones in the central nervous system of the leech». The Journal of Physiology. 263 (3): 513–38. doi:10.1113/jphysiol.1976.sp011643. PMC 1307715. PMID 1018277.
- ^ a b c Squire, Larry (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 61–65. ISBN 978-0-12-385-870-2.
- ^ a b c Luders E, Thompson PM, Toga AW (August 2010). «The development of the corpus callosum in the healthy human brain». The Journal of Neuroscience. 30 (33): 10985–90. doi:10.1523/JNEUROSCI.5122-09.2010. PMC 3197828. PMID 20720105.
- ^ a b c d e Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (April 2011). «Axon physiology» (PDF). Physiological Reviews. 91 (2): 555–602. doi:10.1152/physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Nelson AD, Jenkins PM (2017). «Axonal Membranes and Their Domains: Assembly and Function of the Axon Initial Segment and Node of Ranvier». Frontiers in Cellular Neuroscience. 11: 136. doi:10.3389/fncel.2017.00136. PMC 5422562. PMID 28536506.
- ^ Leterrier C, Clerc N, Rueda-Boroni F, Montersino A, Dargent B, Castets F (2017). «Ankyrin G Membrane Partners Drive the Establishment and Maintenance of the Axon Initial Segment». Frontiers in Cellular Neuroscience. 11: 6. doi:10.3389/fncel.2017.00006. PMC 5266712. PMID 28184187.
- ^ Leterrier C (February 2018). «The Axon Initial Segment: An Updated Viewpoint». The Journal of Neuroscience. 38 (9): 2135–2145. doi:10.1523/jneurosci.1922-17.2018. PMC 6596274. PMID 29378864.
- ^ Rasband MN (August 2010). «The axon initial segment and the maintenance of neuronal polarity». Nature Reviews. Neuroscience. 11 (8): 552–62. doi:10.1038/nrn2852. PMID 20631711. S2CID 23996233.
- ^ a b c d Jones SL, Svitkina TM (2016). «Axon Initial Segment Cytoskeleton: Architecture, Development, and Role in Neuron Polarity». Neural Plasticity. 2016: 6808293. doi:10.1155/2016/6808293. PMC 4967436. PMID 27493806.
- ^ Clark BD, Goldberg EM, Rudy B (December 2009). «Electrogenic tuning of the axon initial segment». The Neuroscientist. 15 (6): 651–68. doi:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- ^ a b Yamada R, Kuba H (2016). «Structural and Functional Plasticity at the Axon Initial Segment». Frontiers in Cellular Neuroscience. 10: 250. doi:10.3389/fncel.2016.00250. PMC 5078684. PMID 27826229.
- ^ a b Susuki K, Kuba H (March 2016). «Activity-dependent regulation of excitable axonal domains». The Journal of Physiological Sciences. 66 (2): 99–104. doi:10.1007/s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ a b c d e Alberts B (2004). Essential cell biology: an introduction to the molecular biology of the cell (2nd ed.). New York: Garland. pp. 584–587. ISBN 978-0-8153-3481-1.
- ^ a b Alberts B (2002). Molecular biology of the cell (4th ed.). New York: Garland. pp. 979–981. ISBN 978-0-8153-4072-0.
- ^ Ozgen, H; Baron, W; Hoekstra, D; Kahya, N (September 2016). «Oligodendroglial membrane dynamics in relation to myelin biogenesis». Cellular and Molecular Life Sciences. 73 (17): 3291–310. doi:10.1007/s00018-016-2228-8. PMC 4967101. PMID 27141942.
- ^ Sadler, T. (2010). Langman’s medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 300. ISBN 978-0-7817-9069-7.
- ^ Hess A, Young JZ (November 1952). «The nodes of Ranvier». Proceedings of the Royal Society of London. Series B, Biological Sciences. Series B. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. doi:10.1098/rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Robbins AA, Fox SE, Holmes GL, Scott RC, Barry JM (November 2013). «Short duration waveforms recorded extracellularly from freely moving rats are representative of axonal activity». Frontiers in Neural Circuits. 7 (181): 181. doi:10.3389/fncir.2013.00181. PMC 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian and Jin-Hui Wang* (2011) Molecular Brain 4(19), 1~11
- ^ Rongjing Ge, Hao Qian, Na Chen and Jin-Hui Wang* (2014) Molecular Brain 7(26):1-16
- ^ Chen N, Yu J, Qian H, Ge R, Wang JH (July 2010). «Axons amplify somatic incomplete spikes into uniform amplitudes in mouse cortical pyramidal neurons». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO…511868C. doi:10.1371/journal.pone.0011868. PMC 2912328. PMID 20686619.
- ^ Wolpert, Lewis (2015). Principles of development (5th ed.). pp. 520–524. ISBN 978-0-19-967814-3.
- ^ Fletcher TL, Banker GA (December 1989). «The establishment of polarity by hippocampal neurons: the relationship between the stage of a cell’s development in situ and its subsequent development in culture». Developmental Biology. 136 (2): 446–54. doi:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Jiang H, Rao Y (May 2005). «Axon formation: fate versus growth». Nature Neuroscience. 8 (5): 544–6. doi:10.1038/nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Goslin K, Banker G (April 1989). «Experimental observations on the development of polarity by hippocampal neurons in culture». The Journal of Cell Biology. 108 (4): 1507–16. doi:10.1083/jcb.108.4.1507. PMC 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (November 2002). «Mechanical tension can specify axonal fate in hippocampal neurons». The Journal of Cell Biology. 159 (3): 499–508. doi:10.1083/jcb.200207174. PMC 2173080. PMID 12417580.
- ^ a b Arimura N, Kaibuchi K (March 2007). «Neuronal polarity: from extracellular signals to intracellular mechanisms». Nature Reviews. Neuroscience. 8 (3): 194–205. doi:10.1038/nrn2056. PMID 17311006. S2CID 15556921.
- ^ Neuroglia and pioneer neurons express UNC-6 to provide global and local netrin cues for guiding migrations in C. elegans
- ^ Serafini T, Kennedy TE, Galko MJ, Mirzayan C, Jessell TM, Tessier-Lavigne M (August 1994). «The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6». Cell. 78 (3): 409–24. doi:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E (June 1999). «A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion». Cell. 97 (7): 927–41. doi:10.1016/S0092-8674(00)80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (January 1990). «The unc-5, unc-6, and unc-40 genes guide circumferential migrations of pioneer axons and mesodermal cells on the epidermis in C. elegans». Neuron. 4 (1): 61–85. doi:10.1016/0896-6273(90)90444-K. PMID 2310575. S2CID 23974242.
- ^ Huang EJ, Reichardt LF (2003). «Trk receptors: roles in neuronal signal transduction». Annual Review of Biochemistry. 72: 609–42. doi:10.1146/annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ a b Da Silva JS, Hasegawa T, Miyagi T, Dotti CG, Abad-Rodriguez J (May 2005). «Asymmetric membrane ganglioside sialidase activity specifies axonal fate». Nature Neuroscience. 8 (5): 606–15. doi:10.1038/nn1442. PMID 15834419. S2CID 25227765.
- ^ Bradke F, Dotti CG (March 1999). «The role of local actin instability in axon formation». Science. 283 (5409): 1931–4. Bibcode:1999Sci…283.1931B. doi:10.1126/science.283.5409.1931. PMID 10082468.
- ^ Furley AJ, Morton SB, Manalo D, Karagogeos D, Dodd J, Jessell TM (April 1990). «The axonal glycoprotein TAG-1 is an immunoglobulin superfamily member with neurite outgrowth-promoting activity». Cell. 61 (1): 157–70. doi:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Alberts, Bruce (2015). Molecular biology of the cell (Sixth ed.). p. 947. ISBN 9780815344643.
- ^ Kunik D, Dion C, Ozaki T, Levin LA, Costantino S (2011). «Laser-based single-axon transection for high-content axon injury and regeneration studies». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO…626832K. doi:10.1371/journal.pone.0026832. PMC 3206876. PMID 22073205.
- ^ Schwab ME (February 2004). «Nogo and axon regeneration». Current Opinion in Neurobiology. 14 (1): 118–24. doi:10.1016/j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Gensel JC, Nakamura S, Guan Z, van Rooijen N, Ankeny DP, Popovich PG (March 2009). «Macrophages promote axon regeneration with concurrent neurotoxicity». The Journal of Neuroscience. 29 (12): 3956–68. doi:10.1523/JNEUROSCI.3992-08.2009. PMC 2693768. PMID 19321792.
- ^ Myers KA, Baas PW (September 2007). «Kinesin-5 regulates the growth of the axon by acting as a brake on its microtubule array». The Journal of Cell Biology. 178 (6): 1081–91. doi:10.1083/jcb.200702074. PMC 2064629. PMID 17846176.
- ^ Rishal I, Kam N, Perry RB, Shinder V, Fisher EM, Schiavo G, Fainzilber M (June 2012). «A motor-driven mechanism for cell-length sensing». Cell Reports. 1 (6): 608–16. doi:10.1016/j.celrep.2012.05.013. PMC 3389498. PMID 22773964.
- ^ Karamched BR, Bressloff PC (May 2015). «Delayed feedback model of axonal length sensing». Biophysical Journal. 108 (9): 2408–19. Bibcode:2015BpJ…108.2408K. doi:10.1016/j.bpj.2015.03.055. PMC 4423051. PMID 25954897.
- ^ Bressloff PC, Karamched BR (2015). «A frequency-dependent decoding mechanism for axonal length sensing». Frontiers in Cellular Neuroscience. 9: 281. doi:10.3389/fncel.2015.00281. PMC 4508512. PMID 26257607.
- ^ Folz F, Wettmann L, Morigi G, Kruse K (May 2019). «Sound of an axon’s growth». Physical Review E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. doi:10.1103/PhysRevE.99.050401. PMID 31212501. S2CID 118682719.
- ^ Andrew BL, Part NJ (April 1972). «Properties of fast and slow motor units in hind limb and tail muscles of the rat». Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 57 (2): 213–25. doi:10.1113/expphysiol.1972.sp002151. PMID 4482075.
- ^ Russell NJ (January 1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». The Journal of Physiology. 298: 347–60. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Pocock G, Richards CD, et al. (2004). Human Physiology (2nd ed.). New York: Oxford University Press. pp. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 August 2017). «Traumatic Brain Injury (TBI) — Definition, Epidemiology, Pathophysiology». Medscape. Archived from the original on 12 June 2018. Retrieved 14 July 2018.
- ^ Trauma and Wallerian Degeneration Archived 2 May 2006 at the Wayback Machine, University of California, San Francisco
- ^ Coleman MP, Freeman MR (1 June 2010). «Wallerian degeneration, wld(s), and nmnat». Annual Review of Neuroscience. 33 (1): 245–67. doi:10.1146/annurev-neuro-060909-153248. PMC 5223592. PMID 20345246.
- ^ Gilley J, Coleman MP (January 2010). «Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons». PLOS Biology. 8 (1): e1000300. doi:10.1371/journal.pbio.1000300. PMC 2811159. PMID 20126265.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (November 2006). «Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia». The Journal of Neuroscience. 26 (45): 11743–52. doi:10.1523/JNEUROSCI.3581-06.2006. PMC 6674790. PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). «Canavan disease: studies on the knockout mouse». N-Acetylaspartate. Adv. Exp. Med. Biol. Advances in Experimental Medicine and Biology. Vol. 576. pp. 77–93, discussion 361–3. doi:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (August 2007). «Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia». The International Journal of Neuropsychopharmacology. 10 (4): 557–63. doi:10.1017/S1461145706007334. PMID 17291371.
- ^ «Brain Injury, Traumatic». Medcyclopaedia. GE. Archived from the original on 26 May 2011. Retrieved 20 June 2018.
- ^ Wright DK, Brady RD, Kamnaksh A, Trezise J, Sun M, McDonald SJ, et al. (October 2019). «Repeated mild traumatic brain injuries induce persistent changes in plasma protein and magnetic resonance imaging biomarkers in the rat». Scientific Reports. 9 (1): 14626. Bibcode:2019NatSR…914626W. doi:10.1038/s41598-019-51267-w. PMC 6787341. PMID 31602002.
- ^ Finger S (1994). Origins of neuroscience: a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Kölliker would give the «axon» its name in 1896.
- ^ Grant G (December 2006). «The 1932 and 1944 Nobel Prizes in physiology or medicine: rewards for ground-breaking studies in neurophysiology». Journal of the History of the Neurosciences. 15 (4): 341–57. doi:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Hellier, Jennifer L. (16 December 2014). The Brain, the Nervous System, and Their Diseases [3 volumes]. ABC-CLIO. ISBN 9781610693387. Archived from the original on 14 March 2018.
- ^ Hsu K, Terakawa S (July 1996). «Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction». Journal of Neurobiology. 30 (3): 397–409. doi:10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. PMID 8807532.
- ^ Salzer JL, Zalc B (October 2016). «Myelination». Current Biology. 26 (20): R971–R975. doi:10.1016/j.cub.2016.07.074. PMID 27780071.
- ^ a b Höfflin F, Jack A, Riedel C, Mack-Bucher J, Roos J, Corcelli C, et al. (2017). «Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex». Frontiers in Cellular Neuroscience. 11: 332. doi:10.3389/fncel.2017.00332. PMC 5684645. PMID 29170630.
External links[edit]
- Histology image: 3_09 at the University of Oklahoma Health Sciences Center – «Slide 3 Spinal cord»
https://ru.wikipedia.org/wiki/%D0%90%D0%BA%D1%81%D0%BE%D0%BD
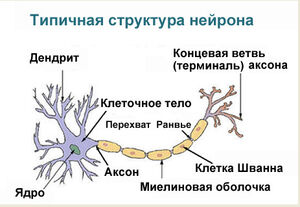
Нейрон состоит из одного аксона, тела и нескольких дендритов,
Аксон (греч. ἀξον — ось) — нервное волокно, длинная, вытянутая часть нервной клетки (нейрона), отросток или нейрит, элемент, который проводит электрические импульсы далеко от тела нейрона (сомы).
Строение нейрона
Нейрон состоит из одного аксона, тела и нескольких дендритов, в зависимости от числа которых нервные клетки делятся на униполярные, биполярные, мультиполярные. Передача нервного импульса происходит от дендритов (или от тела клетки) к аксону. Если аксон в нервной ткани соединяется с телом следующей нервной клетки, такой контакт называется аксо-соматическим, с дендритами — аксо-дендритический, с другим аксоном — аксо-аксональный (редкий тип соединения, встречается в ЦНС, участвует в обеспечении тормозных рефлексов).
В месте соединения аксона с телом нейрона находится аксонный холмик — именно здесь происходит преобразование постсинаптического потенциала нейрона в нервные импульсы, для чего требуется совместная работа натриевых, кальциевых и как минимум трех типов калиевых каналов.
Питание и рост аксона зависят от тела нейрона: при перерезке аксона его периферическая часть отмирает, а центральная сохраняет жизнеспособность. При диаметре в несколько микрон длина аксона может достигать у крупных животных 1 метра и более (например, аксоны, идущие от нейронов спинного мозга в конечности). У многих животных (кальмаров, рыб, кольчатых червей, форонид, ракообразных) встречаются гигантские аксоны толщиной в сотни мкм (у кальмаров — до 2-3 мм). Обычно такие аксоны отвечают за проведение сигналов к мышцам. обеспечивающим «реакцию бегства» (втягивание в норку, быстрое плавание и др.). При прочих равных условиях с увеличением диаметра аксона увеличивается скорость проведения по нему нервных импульсов.
В протоплазме аксона — аксоплазме — имеются тончайшие волоконца — нейрофибриллы, а также микротрубочки, митохондрии и агранулярная(гладкая)эндоплазматическая сеть. В зависимости от того, покрыты ли аксоны миелиновой (мякотной) оболочкой или лишены её, они образуют мякотные или безмякотные нервные волокна.
Миелиновая оболочка аксонов имеется только у позвоночных. Её образуют «накручивающиеся» на аксон специальные шванновские клетки, между которыми остаются свободные от миелиновой оболочки участки — перехваты Ранвье. Только на перехватах присутствуют потенциал-зависимые натриевые каналы и заново возникает потенциал действия. При этом нервный импульс распространяется по миелинизированным волокнам ступенчато, что в несколько раз повышает скорость его распространения.
Концевые участки аксона — терминали — ветвятся и контактируют с другими нервными, мышечными или железистыми клетками. На конце аксона находится синаптическое окончание — концевой участок, контактирующий с клеткой-мишенью. Вместе с постсинаптической мембраной клетки-мишени синаптическое окончание образует синапс. Через синапсы передаётся возбуждение.[1]
Анатомия
Аксоны — в действительности первичные линии передачи сигналов нервной системы, и как связки они помогают составлять нервные волокна. Индивидуальные аксоны являются микроскопическими в диаметре (типично 1 мкм в сечении), но могут достигать нескольких метров. Самые длинные аксоны в человеческом теле, например, аксоны седалищного нерва, которые простираются от позвоночника к большому пальцу ноги. Эти волокна единственной ячейки седалищного нерва могут увеличиться до метра или еще длинее.[2]
У позвоночных животных, аксоны многих нейронов вложены в ножны в миелине, который сформирован любым из двух типов глиальных ячеек: Ячейки Schwann ensheathing периферийные нейроны и oligodendrocytes изолирование таковых из центральной нервной системы. По myelinated волокнам нерва, промежутки в ножнах, известных, поскольку узлы Ranvier происходят в равномерно-раздельных интервалах. Myelination имеют очень быстрый способ электрического распространения импульса, названного скачкообразным. Demyelination аксоны, который вызывает множество неврологических признаков, типичных для заболевания под названием «рассеянный склероз». Аксоны некоторой ветви нейронов, формирующие имущественные залоги аксона, могут быть разделены на множество меньших ветвей, названных telodendria. По ним bifurcated импульс распространяются одновременно, для сигнализиции больше, чем одной ячейки другую ячейку.
Физиология
Физиология может быть описана Моделью Hodgkin-Huxley, распространённой на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Периферийные волокна нерва могут быть классифицированы на основанные, на аксонально-скоростные проводимости, mylenation, размеры волокна и т.д. Например, есть медленное проведение unmyelinated С fibers волокна и более быстрое проведение myelinated Aδ fibers волокна. Более сложное математическое моделирование проводится сегодня. Есть несколько типов сенсорных — таких как motorfibers. Другие волокна, не упомянутые в матеоиале — например, волокна автономной нервной системы
Двигательная функция
В таблице паказаны моторные нейроны, которые имеют два вида волокон:
| Тип | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные мускульные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 мкм | Yes | 80-120 m/s | Extrafusal muscle fibers |
| γ | Aγ | 5-8 мкм | Yes | 4-24 m/s[3][4] | Intrafusal muscle fibers |
Сенсорная функция
Различные сенсорные рецепторы возбуждаются различными типами волокон нерва. Proprioceptors возбуждены типом Ia, Ib и II сенсорными волокнами, механорецепторы — типом II и III сенсорными волокнами и типом nociceptors и thermoreceptors.
| Типы | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные сенсорные рецепторы |
|---|---|---|---|---|---|
| Ia | Aα | 13-20 мкм | Yes | 80-120 m/s | Primary receptors of muscle spindle |
| Ib | Aα | 13-20 мкм | Yes | 80-120 m/s | Golgi tendon organ |
| II | Aβ | 6-12 мкм | Yes | 33-75 m/s | Secondary receptors of muscle spindle All cutaneous mechanoreceptors |
| III | Aδ | 1-5 мкм | Thin | 3-30 m/s | Free nerve endings of touch and pressure Nociceptors of neospinothalamic tract Cold thermoreceptors |
| IV | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s | Nociceptors of paleospinothalamic tract Warmth receptors |
Автономная функция
Автономная нервная система имеет два вида периферийных волокон:
| Typы | Классификация | Диаметр | Миелин[5] | Скорость проводимости |
|---|---|---|---|---|
| preganglionic fibers | B | 1-5 мкм | Yes | 3-15 m/s |
| postganglionic fibers | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s |
Рост и развитие аксона
Нейрон
Рост аксонов происходит через их окружающую среду, в виде конуса роста, который находится в наконечнике аксона. Конус роста имеет широкий лист как расширение, названное lamellipodia, которое содержат выпячивания, названные filopodia. Filopodia — механизм, представляющий процесс придержки поверхностей. Он анализирует ближайшую окружающую среду. Актин играет главную роль в подвижности этой системы. Окружающие среды с высокими уровнями молекул прилипания ячейки или «КУЛАКА» создают идеальную окружающую среду для аксонального роста. Это, кажется, обеспечивает «липкую» поверхность для аксонов, для раста вперед. Примеры КУЛАКА, определенного для нервных систем включают: N-КУЛАК, neuroglial КУЛАК или NgCAM, ПОМЕТЬТЕ 1, МЭГ, и DCC, все из которых — часть суперсемьи иммуноглобулина. Другой набор молекул звонковый, внеклеточные матричные молекулы прилипания также обеспечивают липкое основание для аксонов, чтобы расти вперед. Примеры этих молекул включают laminin, fibronectin, tenascin, и perlecan. Некоторые из них — поверхность, привязанная к ячейкам и таким образом действуют, как короткие аттрактанты диапазона или repellents. Другие — difusible лиганды и таким образом могут долго сохранять эффекты диапазона.
Ячейки звонковые, ячейки указательного столба помогают в руководстве ростом аксона нейронала. Эти ячейки — типично другой, иногда незрелый, нейроны.
История
Часть первой внутриклеточной регистрации в нервной системе была сделана в конце 1930-ых учёными K. Капуста и H. Куртис. Алан Ходгкин и Эндрю Хакслей также использовали аксон гиганта кальмара (1939), и в 1952 они получили полное количественное описание действия ионного основания потенциала, введя формулировку Модели Hodgkin-Huxley. Ходгкину и Хакслей, были предтавлены совместно на паолучение Нобелевской премии по этой работе в 1963. Формулы, детализирующие аксональную проводимость были расширены на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Erlanger и Gasser ранее развивали систему классификации для периферийного[5] волокна нерва, основанные на аксональной скорости проводимости, myelination, размере волокна и т.д. Даже и сейчас наше понимание биохимического процесса распространения действия потенциала продвинулось, и теперь он включает много деталей об индивидуальных каналах иона.
Рана
Основная статья: Рана
На серьёзном уровне, рана нерва может быть описана как neuropraxia, axonotmesis, или neurotmesis. Сотрясение мозга считают умеренной формой разбросанной аксональной раны [6].
См. также
- Сенсорные нервы
- Сенсорный рецептор
- Нейрон
- Аксональный поиск пути
- Аксональный транспорт
- Аксон-рефлекс
- Конус роста
- Дендрит
- Валлерова дегенерация — при разрыве аксона
Примечания
- ↑ http://en.wikipedia.org/wiki/Axon
- ↑ DNA From The Beginning, section 6: Genes are real things., «Amination» section, final slide
- ↑ Andrew BL, Part NJ (1972) Properties of fast and slow motor units in hind limb and tail muscles of the rat. Q J Exp Physiol Cogn Med Sci 57:213-225.
- ↑ Russell NJ (1980) Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat. J Physiol 298:347-360.
- ↑ pp.187-9 ISBN 0-19-858527-6
- ↑ eMedicine — Traumatic Brain Injury: Definition, Epidemiology, Pathophysiology : Article by Segun T Dawodu, MD, FAAPMR, FAANEM, CIME, DipMI(RCSed)
Гистология: Нервная ткань |
|
|---|---|
| Нейроны (Серое вещество) |
Сома · Аксон (Аксонный холмик, Терминаль аксона, Аксоплазма, Аксолемма, Нейрофиламенты) Дендрит (Вещество Ниссля, Дендритный шипик, Апикальный дендрит, Базальный дендрит) типы: Биполярные нейроны · Псевдополярные нейроны · Мультиполярные нейроны · Пирамидальный нейрон · Клетка Пуркинье · Гранулярная клетка |
| Афферентный нерв/ Сенсорный нерв/ Сенсорный нейрон |
GSA · GVA · SSA · SVA · Нервные волокна (Мышечные веретёна (Ia), Нервно-сухожильное веретено, II or Aβ, Aδ-волокна, C-волокна) |
| Эфферентный нерв/ Моторный нерв/ Моторный нейрон |
GSE · GVE · SVE · Верхний моторный нейрон · Нижний моторный нейрон (α мотонейроны, γ мотонейроны) |
| Синапс |
Нейропиль · Синаптический пузырек · Нервно-мышечный синапс · Электрический синапс · Интернейрон (Клетки Реншоу) |
| Сенсорный рецептор |
Чувствительное тельце Мейснера · Нервное окончание Меркеля · Тельца Пачини · Окончание Руффини · Нервномышечное веретено · Свободное нервное окончание · Обонятельный нейрон · Фоторецепторные клетки · Волосковые клетки · Вкусовая луковица |
| Нейроглия |
Астроциты (Радиальная глия) · Олигодендроглиоциты · Клетки эпендимы (Танициты) · Микроглия |
| Миелин (Белое вещество) |
CNS: Олигодендроцит PNS: Клетки Шванна · Невролемма · Перехват Ранвье/Межузловой сегмент · Насечка миелина |
| Соединительная ткань |
Эпиневрий · Периневрий · Эндоневрий · Нервные пучки · Оболочки мозга |
Роль аксона в функционировании нервной системы
Информация носит справочный характер. Не занимайтесь самодиагностикой и самолечением. Обращайтесь ко врачу.

Аксон (от греческого— ось) — мозговое волокно, длинный, вытянутый фрагмент мозговой клетки (нейрона), отросток или нейрит, участок, транслирующий электросигналы на дистанции от самой мозговой клетки (сомы).
Множеству клеток нервов присущ только один отросток; клетки в малом количестве вообще без нейтритов.
Аксон выглядит как вытянутый отросток конусообразной формы, продолжительность и окружность которого различна и зависит от размера мозговой клетки.
Несмотря на то, что аксоны отдельных клеток нервов короткие, как правило, они характеризуются весьма существенной длиной. К примеру, отростки двигательных спинномозговых нейронов, которые передают мышцы стопы, могут доходить в длину до 100 см. Основанием всех аксонов является небольшой фрагмент треугольной формы — холмик нейтрита, — ответвляющийся от самого тела нейрона. Внешний защитный слой аксона называется аксолемма (от греческого axon — ось + eilema — оболочка), а его внутренняя структура аксоплазма.
Свойства
По телу нейтрита проводится весьма активная обосторонняя транспортировка маленьких и больших молекул. Макромолекулы и органеллы, образовывающиеся в самом нейроне, бесперебойно перемещаются по этому отростку к его отделам. Активацией этого передвижения является вперед распространяющийся ток (транспорт). Этот электроток реализовывается тремя транспортами разной быстроты:
- Очень слабый ток (со скоростью некоторое количество мл в сутки) переносит белки и нити из мономеров актина.
- Ток со средней скоростью передвигает основные энергостанции организма, а быстрый ток (стремительность которого в 100 раз больше) перемещает малекулы, которые содержатся в пузырьках, требуемых для участка связи с другими клетками в момент перетрансляции сигнала.
- Параллельно с двигающим вперед током действует ретроградный ток (транспорт), который передвигает в обратном направлении (к самому нейрону) определенные молекулы, в том числе и материал, прихваченный при содействии эндоцитоза (включая вирусы и отравляющие соединения).
Данное явление применяют для исследования проекций нейронов, в этих целях используется окисление веществ при наличии перекиси или другого константного вещества, которое вводят в зону размещения синапсов и по истечении определенного времени отслеживают его распределение. Моторные белки, связанные с аксональным током, содержат молекулярные моторчики (динеин) перемещающие различные «грузы» от внешних границ клетки до ядра, характеризующийся АТФазным действием, находящийся в микротрубочках, и молекулярные моторы,(кинезин) перемещающие различные «грузы» от ядра к периферии клетки, формируя вперед распространяющийся ток в нейтрите.
Принадлежность питания и удлинения аксона к телу нейтрона несомненна: при иссечении аксона его периферический отдел отмирает, а начало остается жизнеспособным.
При окружности в малом количестве микронов общая длина отростка у больших животных может быть равна 100 см и более (к примеру, ответвления, направленные от спинномозговых нейронов в руки или ноги).
У большинства представителей беспозвоночного вида попадаются весьма крупные нейронные отростки окружностью в сотни мкм (у кальмаров — до 2—3 мм). Как правило подобные нейтриты отвечают за трансляцию импульсов к мышечной ткани, которая обеспечивает «сигнал к бегству» (вбирание в норку, скорое уплывание и др.). При иных схожих факторах с повышением окружности отростка прибавляется скорость трансляции по его телу нервных сигналов.
Строение
В содержимом материальном субстрате аксона — аксоплазме — находятся очень тонкие волоконца — нейрофибриллы, и кроме того микротрубочки, энергетические органоиды в форме гранулы, цитоплазматический ретикулум, обеспечивающий продуцирование и транспортировку липидов и углеводов. Существуют мякотные и безмякотные мозговые структуры:
- Мякотная (она же миелиновая или мислиновая) оболочка нейтритов есть исключительно у представителей позвоночного вида. Её формируют «наматывающиеся» на отросток особые леммоциты ( дополнительные клетки, сформированные вдоль нейтритов нервных структур периферии), посредине которых сохраняются незанятые мислиновой оболочкой места— пояса Ранвье. Лишь на данных участках находятся потенциал-зависимые натриевые каналы и вновь появляется потенциал активности. При этом мозговой сигнал продвигается по мислиновой структуре ступенчато, что в разы увеличивает скорость его трансляции. Быстрота передвижения импульса по нейтртим с мякотным слоем равна 100 метров в секунду.
- Безмякотные отростки меньше габаритами, чем нейтриты, обеспеченные мякотной оболочкой, что восполняет траты в быстроте трансляции сигнала в сопоставлении с мякотными ответвлениями.
На участке объединения аксона с телом самого нейрона у самых больших клеток в виде пирамид 5-й оболочки коры располагается аксонное возвышение. Не так давно существовала гипотеза о том, что именно в этом месте осуществляется превращение постсвязных возможностей нейрона в нервные сигналы, однако путем проведения экспериментов этот факт не доказан. Фиксация электрических возможностей определила, что нервный сигнал концентрируется в теле нейтрита, а точнее в стартовой зоне, удаленностью ~50 мкм от самой нервной клетки. В целях сохранения силы активности в стартовой зоне необходимо большое содержание натриевых проходов (до ста раз, касаемо самого нейрона).
Как формируется аксон
Удлинение и развитие данных отростков нейрона обеспечивается локацией их расположения. Удлинение аксонов становится возможным по причине присутствия на их верхнем завершении филоподий, между которыми размещаются, подобие гофры, мембранные образования — ламелоподии. Филоподий деятельно взаимодействуют с близлежащими структурами, пробиваясь в ткань все глубже, по итогам чего и осуществляется направленное удлинение аксонов.
Собственно филоподий задает направление увеличению аксона в длину, устанавливая, определенность организации волокон. Участие филоподий в направленном удлинении нейтритов было подтверждено в практическом эксперименте посредством введения в эмбрионы, цитохалазина В, разрушающего филоподий. При этом аксоны нейронов не дорастали до мозговых центров.
Продуцирование иммуноглобулина, который часто встречается в месте соединения участков роста аксонов с глиальными клетками и, согласно гипотезам ряда ученых, данный факт и предопределяет направление удлинения аксонов в зоне перекреста. Если данный фактор способствует удлинению аксонов, то хондроитинсульфат, напротив, замедляет рост нейтритов.
Аксон
-
Аксон (др.-греч. ἄξων «ось») — это нейрит (длинный цилиндрический отросток нервной клетки), по которому нервные импульсы идут от тела клетки (сомы) к иннервируемым органам и другим нервным клеткам.
Каждый нейрон состоит из одного аксона, тела (перикариона) и нескольких дендритов, в зависимости от числа которых нервные клетки делятся на униполярные, биполярные или мультиполярные. Передача нервного импульса происходит от дендритов (или от тела клетки) к аксону, а затем сгенерированный потенциал действия от начального сегмента аксона передаётся назад к дендритам. Если аксон в нервной ткани соединяется с телом следующей нервной клетки, такой контакт называется аксо-соматическим, с дендритами — аксо-дендритический, с другим аксоном — аксо-аксональный (редкий тип соединения, встречается в ЦНС).
Концевые участки аксона — терминали — ветвятся и контактируют с другими нервными, мышечными или железистыми клетками. На конце аксона находится синаптическое окончание — концевой участок терминали, контактирующий с клеткой-мишенью. Вместе с постсинаптической мембраной клетки-мишени синаптическое окончание образует синапс. Через синапсы передаётся возбуждение.
Источник: Википедия
Связанные понятия
Си́напс (греч. σύναψις, от συνάπτειν — соединение, связь) — место контакта между двумя нейронами или между нейроном и получающей сигнал эффекторной клеткой. Служит для передачи нервного импульса между двумя клетками, причём в ходе синаптической передачи амплитуда и частота сигнала могут регулироваться. Передача импульсов осуществляется химическим путём с помощью медиаторов или электрическим путём, посредством прохождения ионов из одной клетки в другую.
Нейро́н, или невро́н (от др.-греч. νεῦρον — волокно, нерв) — структурно-функциональная единица нервной системы. Нейрон — электрически возбудимая клетка, которая обрабатывает, хранит и передает информацию с помощью электрических и химических сигналов. Нейрон имеет сложное строение и узкую специализацию. Клетка содержит ядро, тело клетки и отростки (дендриты и аксоны). В головном мозге человека насчитывается около 90—95 миллиардов нейронов. Нейроны могут соединяться один с другим, формируя биологические…
Дендрит (от греч. δένδρον (dendron) — дерево) — разветвлённый отросток нейрона, который получает информацию через химические (или электрические) синапсы от аксонов (или дендритов и сомы) других нейронов и передаёт её через электрический сигнал телу нейрона (перикариону), из которого вырастает. Термин «дендрит» ввёл в научный оборот швейцарский ученый В. Гис в 1889 году.
Миелин (в некоторых изданиях употребляется некорректная теперь форма миэлин) — вещество, образующее миелиновую оболочку нервных волокон.
Вставочный нейрон (синонимы: интернейрон, промежуточный нейрон; англ. interneuron, relay neuron, association neuron, bipolar neuron) — нейрон, связанный только с другими нейронами, в отличие от двигательных нейронов, иннервирующих мышечные волокна, и сенсорных нейронов, преобразующих стимулы из внешней среды в электрические сигналы.
Упоминания в литературе
Аксон — длинное нервное волокно, отходящее от тела некоторых нейронов и заканчивающееся терминалями (до нескольких сотен) на клетках-мишенях: нейронах, миоцитах, клетках железы и др. В зависимости от наличия или отсутствия аксона выделяют нейроны I и II типа. Область тела нейрона, которой начинается аксон, называют начальным сегментом аксон, или аксонным холмиком. Мембрана аксонного холмика генерирует потенциалы действия (нервные импульсы), распространяющиеся по аксону. Некоторые аксоны покрыты прерывистыми цепочками миелиновых оболочек (муфт) и называются миелинизированными (волокна спинномозговых нервов). Аксоны, свободные от миелина, называются немиелинизированными (волокна вегетативных нервов). Между муфтами имеются промежутки – перехваты Ранвье. В участках, лишенных миелиновой оболочки, мембрана аксона контактирует непосредственно с внеклеточной средой. В ЦНС миелиновые муфты образованы глиальными клетками, олигодендритами. Миелиновые муфты аксонов, выходящих за пределы ЦНС (периферических волокон), образованы шванновскими клетками. Одна шванновская клетка может образовывать муфты, покрывая до девяти нервных волокон. Главная функция аксонов – передача нервных импульсов от тела нейрона к терминалям, которые заканчиваются на клетках-мишенях утолщениями, синаптическими бляшками. Скорость движения информации по аксонам составляет от нескольких миллиметров в секунду в мелких немиелинизированных волокнах до 90 м/с в крупных миелинизированных. Миелиновая оболочка увеличивает скорость передачи потенциалов действия по аксону.
НЕЙРО́Н, нервная клетка; основная структурная и функциональная единица нервной системы. Нейроны обладают особыми свойствами – возбудимостью и проводимостью. Из нейронов построена нервная ткань. Как и другие клетки, нейрон имеет ядро, цитоплазму и клеточную мембрану. Ядро содержится в теле нейрона (его расширенная часть), от которого отходят отростки – короткие (дендриты) и один длинный (аксон). Длина аксона может достигать 1 м и более. Аксоны образуют тяжки, которые называются нервами (наиболее крупные – нервными стволами). Дендриты принимают сигналы из внешней среды или от другой нервной клетки и проводят возбуждение к аксону, который передаёт его в удалённые от тела нейрона области. Тела нейронов образуют серое вещество головного и спинного мозга, а дендриты и аксоны – белое мозговое вещество.
Таким образом, основными функциями нейронов являются: восприятие внешних раздражений – рецепторная функция, их переработка – интегративная функция и передача нервных влияний на другие нейроны или различные рабочие органы – эффекторная функция. В теле нервной клетки, или соме, происходят основные процессы переработки информации. Многочисленные древовидно разветвленные отростки – дендриты (греч. дендрон – «дерево») служат входами нейрона, через которые сигналы поступают в нервную клетку. Выходом нейрона является отходящий от тела клетки отросток – аксон (греч. аксис – «ось»), который передает нервные импульсы дальше – другой нервной клетке или рабочему органу (мышце, железе). Особенно высокой возбудимостью обладает начальная часть аксона и расширение в месте его выхода из тела клетки – аксонный холмик нейрона. Именно в этом сегменте клетки возникает нервный импульс.
Таким образом, основными функциями нейронов являются: восприятие внешних раздражений – рецепторная функция, их переработка интегративная функция и передача нервных влияний на другие нейроны или различные рабочие органы – эффекторная функция. В теле нервной клетки, или соме, происходят основные процессы переработки информации. Многочисленные древовидно разветвленные отростки – дендриты (греч. дендрон – «дерево») служат входами нейрона, через которые сигналы поступают в нервную клетку. Выходом нейрона является отходящий от тела клетки отросток – аксон (греч. аксис – «ось»), который передает нервные импульсы дальше – другой нервной клетке или рабочему органу (мышце, железе). Особенно высокой возбудимостью обладает начальная часть аксона и расширение в месте его выхода из тела клетки – аксонный холмик нейрона. Именно в этом сегменте клетки возникает нервный импульс.
Нейрон. Основной функциональной и структурной единицей нервной системы является нейрон, строение которого показано на рис. 1.1. Нейрон состоит из клеточного тела, или сомы, коротких нервных отростков, называемых дендритами, и длинного нервного волокна – аксона. Область выхода аксона из клеточного тела нейрона называется аксонным холмиком. Хотя формально и дендриты и аксоны являются нервными волокнами, термин «нервное волокно» в основном употребляется при упоминании аксона. Дендриты передают нервный импульс к телу нейрона, тогда как аксон направляет импульс из тела нейрона на другие нервные клетки или на мышечные волокна.
Связанные понятия (продолжение)
Клетки Пуркинье (англ. Purkinje cells) — крупные нервные клетки коры мозжечка. Своё название клетки получили в честь их первооткрывателя, чешского врача и физиолога Яна Эвангелисты Пуркинье.
Пирамидальные нейроны, или пирамидные нейроны, — основные возбудительные нейроны мозга млекопитающих. Также обнаруживаются у рыб, птиц, рептилий. Напоминают по форме пирамиду, из которой вверх ведёт большой апикальный дендрит; имеют один аксон, идущий вниз, и множество базальных дендритов. Впервые были исследованы Рамон-и-Кахалем. Отмечены в таких структурах, как кора мозга, гиппокамп, миндалевидное тело (амигдала), но отсутствуют в обонятельной луковице, стриатуме, среднем мозге, ромбовидном мозге…
Подробнее: Пирамидальный нейрон
Нейроглия, или просто глия (от др.-греч. νεῦρον — волокно, нерв + γλία — клей), — совокупность вспомогательных клеток нервной ткани. Составляет около 40 % объёма ЦНС. Количество глиальных клеток в мозге примерно равно количеству нейронов. Термин ввёл в 1846 году Рудольф Вирхов.
Перикарион (др.-греч. περι- — приставка со значением «около, вокруг, кругом» + κάρυον — «орех») — сома (тело) нейрона, может иметь различную величину и форму. На цитолемме перикариона образуются многочисленные синаптические контакты с отростками других нейронов.
Нервная ткань — ткань эктодермального происхождения, представляет собой систему специализированных структур, образующих основу нервной системы и создающих условия для реализации её функций. Нервная ткань осуществляет восприятие и преобразование раздражителей в нервный импульс и передачу его к эффектору. Нервная ткань обеспечивает взаимодействие тканей, органов и систем организма и их регуляцию.
Мотонейро́н (от лат. motor — приводящий в движение и нейрон; двигательный нейро́н) — крупная нервная клетка в передних рогах спинного мозга. Мотонейроны обеспечивают моторную координацию и поддержание мышечного тонуса.
Шванновские клетки (леммоциты) — вспомогательные клетки нервной ткани, которые формируются вдоль аксонов периферических нервных волокон. Создают, а иногда и разрушают, электроизолирующую миелиновую оболочку нейронов. Выполняют опорную (поддерживают аксон) и трофическую (питают тело нейрона) функции. Описаны немецким физиологом Теодором Шванном в 1838 году и названы в его честь.
Астроцит (лат. astrocytus; от греч. astron — звезда; и kýtos, здесь — клетка) — тип нейроглиальной клетки звездчатой формы с многочисленными отростками. Совокупность астроцитов называется астроглией.
Гранулярные клетки — несколько разновидностей мелких нейронов мозга. Название «гранулярная клетка» («зернистая клетка», «клетка-зерно») используется анатомами для нескольких разных типов нейронов, единственной общей особенностью которых является крайне малый размер тел этих клеток.
Подробнее: Гранулярная клетка
Гипотала́мус (лат. hypothalamus, от греч. ὑπό — «под» и θάλαμος — «комната, камера, отсек, таламус») — небольшая область в промежуточном мозге, включающая в себя большое число групп клеток (свыше 30 ядер), которые регулируют нейроэндокринную деятельность мозга и гомеостаз организма. Гипоталамус связан нервными путями практически со всеми отделами центральной нервной системы, включая кору, гиппокамп, миндалину, мозжечок, ствол мозга и спинной мозг. Вместе с гипофизом гипоталамус образует гипоталамо-гипофизарную…
Не́рвные воло́кна — длинные отростки нейронов, покрытые глиальными оболочками. По нервным волокнам распространяются нервные импульсы, по каждому волокну изолированно, не заходя на другие.
Корзинчатые нейроны — тормозные ГАМК-эргические вставочные нейроны молекулярного слоя мозжечка. Длинные аксоны корзинчатых нейронов образуют корзиноподобные синапсы с телами клеток Пуркинье. Корзинчатые нейроны многополярны, их дендриты свободно ветвятся.
Подробнее: Корзинчатый нейрон
Тала́мус, иногда — зри́тельные бугры (лат. Thalamus; от др.-греч. θάλαμος — «камера, комната, отсек») — отдел головного мозга, представляющий собой большую массу серого вещества, расположенную в верхней части таламической области промежуточного мозга хордовых животных, в том числе и человека. Впервые описан древнеримским врачом и анатомом Галеном. Таламус — это парная структура, состоящая из двух половинок, симметричных относительно межполушарной плоскости. Таламус находится глубже структур большого…
Полоса́тое те́ло (лат. corpus striatum) — анатомическая структура конечного мозга, относящаяся к базальным ядрам полушарий головного мозга.
Гиппока́мп (от др.-греч. ἱππόκαμπος — морской конёк) — часть лимбической системы головного мозга (обонятельного мозга). Участвует в механизмах формирования эмоций, консолидации памяти (то есть перехода кратковременной памяти в долговременную). Генерирует тета-ритм при удержании внимания.
Латеральное коленчатое тело (наружное коленчатое тело, ЛКТ) — легко распознаваемая структура мозга, которая помещается на нижней латеральной стороне подушки таламуса в виде достаточно большого плоского бугорка. В ЛКТ приматов и человека морфологически определено шесть слоев: 1 и 2 — слои крупных клеток, 3-6 — слои мелких клеток. Слои 1, 4 и 6 получают афференты от контрлатерального (расположенного в противоположном по отношению к ЛКТ полушарии) глаза, а слои 2, 3 и 5 — от ипсилатерального (расположенного…
Зубчатая извилина (лат. gyrus dentatus) или зубчатая фасция гиппокампа (лат. fascia dentata hippocampi) — зазубренная извилина, расположенная в глубине борозды гиппокампа и переходящая в ленточную извилину. В некоторых классификациях она вместе с аммоновым рогом считается частью самого гиппокампа, однако большинство авторов относят её к гиппокамповой формации. В её структуре выделяют три слоя: полиморфный хилус, гранулярный слой и молекулярный слой, который непрерывно переходит в молекулярный слой…
Потенциа́л де́йствия — волна возбуждения, перемещающаяся по мембране живой клетки в виде кратковременного изменения мембранного потенциала на небольшом участке возбудимой клетки (нейрона или кардиомиоцита), в результате которого наружная поверхность этого участка становится отрицательно заряженной по отношению к внутренней поверхности мембраны, в то время, как в покое она заряжена положительно. Потенциал действия является физиологической основой нервного импульса.
Обонятельная луковица — часть обонятельного мозга, парное образование, состоящее из тел вторых нейронов биполярного типа обонятельного анализатора. Располагается во внутричерепной полости между лобной долей сверху и решётчатой пластинкой решётчатой кости снизу, через отверстие которой в неё поступают нервные волокна обонятельной области носа, а сзади продолжается в обонятельный тракт.
Реце́птор — объединение из терминалей (нервных окончаний) дендритов чувствительных нейронов, глии, специализированных образований межклеточного вещества и специализированных клеток других тканей, которые в комплексе обеспечивают превращение влияния факторов внешней или внутренней среды (раздражитель) в нервный импульс. В некоторых рецепторах (например, вкусовых и слуховых рецепторах человека) раздражитель непосредственно воспринимается специализированными клетками эпителиального происхождения или…
Ганглий (др.-греч. γάγγλιον — узел), или нервный узел — скопление нервных клеток, состоящее из тел, дендритов и аксонов нервных клеток и глиальных клеток. Обычно ганглий имеет также оболочку из соединительной ткани. Имеются у многих беспозвоночных и всех позвоночных животных. Часто соединяются между собой, образуя различные структуры (нервные сплетения, нервные цепочки и т. п.).
Голубое пятно (голубоватое место, голубоватое пятно, синее пятно/место, лат. locus coeruleus) — ядро, расположенное в стволе мозга на уровне моста (участок голубоватого цвета в верхнелатеральной части ромбовидной ямки ствола головного мозга кнаружи от верхней ямки), часть ретикулярной формации. Система его проекций очень широка — аксоны восходят к верхним слоям коры больших полушарий, гиппокампу, миндалине, перегородке, полосатому телу, коре мозжечка. Нисходящие проекции идут в спинной мозг к симпатическим…
Афферентация (от лат. afferens — «приносящий») — постоянный поток нервных импульсов, поступающих в центральную нервную систему от органов чувств, воспринимающих информацию как от внешних раздражителей (экстерорецепция), так и от внутренних органов (интерорецепция). Находится в прямой зависимости от количества и силы воздействующих раздражителей, а также от состояния — активности или пассивности — индивида.
Белое вещество (лат. substantia alba) — компонент центральной нервной системы позвоночных животных и человека, состоящий главным образом из пучков аксонов, покрытых миелином. Противопоставляется серому веществу мозга, состоящему из клеточных тел нейронов. Цветовая дифференциация белого и серого вещества нервной ткани обусловлена белым цветом миелина.
Нервно-мышечный синапс (также нейромышечный, либо мионевральный синапс) — эффекторное нервное окончание на скелетном мышечном волокне. Входит в состав нервно-мышечного веретена. Нейромедиатором в этом синапсе является ацетилхолин.
Ретикулярная формация (лат. reticulum — сеточка, formatio — образование) — это образование, тянущееся вдоль всей оси ствола головного мозга. Своим названием оно обязано сетчатой структуре, образуемой его нервными клетками с очень сложными связями. Формация состоит из ретикулярных ядер и большой сети нейронов с разветвлёнными аксонами и дендритами, представляющих единый комплекс, который осуществляет активацию коры головного мозга и контролирует рефлекторную деятельность спинного мозга. Эта сеть нейронов…
Средний мозг, или мезэнцефалон (англ. Midbrain, лат. Mesencephalon; термин «мезэнцефалон» происходит от др.-греч. μέσος — «месос» — средний, и ἐγκέφᾰλος — «энкефалос» — буквально «находящийся внутри головы», то есть головной мозг) — это отдел головного мозга хордовых животных, развивающийся из среднего из трёх первичных мозговых пузырей эмбриона. Этот отдел мозга ответствен за осуществление многих важных физиологических функций, таких, как зрение, слух, контроль движений, регуляция циклов сна и бодрствования…
Мозжечо́к (лат. cerebellum — дословно «малый мозг») — отдел головного мозга позвоночных, отвечающий за координацию движений, регуляцию равновесия и мышечного тонуса. У человека располагается позади продолговатого мозга и варолиева моста, под затылочными долями полушарий головного мозга. Посредством трёх пар ножек мозжечок получает информацию из коры головного мозга, базальных ганглиев, экстрапирамидной системы, ствола головного мозга и спинного мозга. У различных таксонов позвоночных взаимоотношения…
Мозгово́й ствол, или ствол головного мозга, — традиционно выделяющийся отдел третьего мозга, представляющий собой протяжённое образование, продолжающее спинной мозг.
Ганглионарная (ганглиозная) клетка — нервная клетка (нейрон) сетчатки глаза, способная генерировать нервные импульсы в отличие от других типов нейронов сетчатки (биполярных, горизонтальных, амакриновых). В их цитоплазме хорошо выражено базофильное вещество. Ганглионарные клетки граничат со стекловидным телом глаза и образуют слой сетчатки, который первым получает свет. Их аксоны по поверхности сетчатки направляются к слепому пятну (пятно Мариотта), собираются в зрительный нерв и направляются в мозг…
Конечный мозг (лат. telencephalon) — самый передний отдел головного мозга. Состоит из двух полушарий большого мозга (покрытых корой), мозолистого тела, полосатого тела и обонятельного мозга. Является наиболее крупным отделом головного мозга. Это также самая развитая структура, покрывающая собой все отделы головного мозга.
Дендритный шипик — мембранный вырост на поверхности дендрита, способный образовать синаптическое соединение. Шипики обычно имеют тонкую дендритную шейку, оканчивающуюся шарообразной дендритной головкой. Дендритные шипики обнаруживаются на дендритах большинства основных типов нейронов мозга. В создании шипиков участвует белок калирин.
Эпиталамус (буквально «надталамус») — это самая дорсальная (верхняя) задняя часть таламического мозга, или, иначе говоря, таламической области — той части промежуточного мозга, куда, помимо эпиталамуса, входят также таламус, субталамус и метаталамус, но не входят гипоталамус и гипофиз, причисляемые к гипоталамической области. Эпиталамус возвышается над таламусом. В число его структур входят поводок эпиталамуса, также называемый поводком мозга, треугольник поводка, спайка поводков, подспаечный орган…
Передний мозг, или прозэнцефалон (лат. prosencephalon, англ. forebrain) — это отдел головного мозга хордовых животных, выделяемый на основании особенностей его эмбрионального развития у этих видов животных. Передний мозг (прозэнцефалон) является одним из трёх первичных мозговых пузырей, образующихся в первичной нервной трубке вскоре после нейруляции и образования нейромер, на так называемой трёхпузырьковой стадии развития ЦНС эмбриона. Двумя другими первичными мозговыми пузырями являются средний…
Миоци́ты, или мы́шечные клетки — особый тип клеток, составляющий основную часть мышечной ткани. Миоциты представляют собой длинные, вытянутые клетки, развивающиеся из клеток-предшественников — миобластов. Существует несколько типов миоцитов: миоциты сердечной мышцы (кардиомиоциты), скелетной и гладкой мускулатуры. Каждый из этих типов обладает особыми свойствами. Например, кардиомиоциты, помимо прочего, генерируют электрические импульсы, задающие сердечный ритм.
Головно́й мозг (лат. cerebrum, др.-греч. ἐγκέφαλος) — главный орган центральной нервной системы подавляющего большинства хордовых, её головной конец; у позвоночных находится внутри черепа. В анатомической номенклатуре позвоночных, в том числе человека, мозг в целом чаще всего обозначается как encephalon — латинизированная форма греческого слова; изначально латинское cerebrum стало синонимом большого мозга (telencephalon).
Спинно́й мозг (лат. medulla spinalis) — орган центральной нервной системы позвоночных, расположенный в позвоночном канале. Принято считать, что граница между спинным и головным мозгом проходит на уровне перекреста пирамидных волокон (хотя эта граница весьма условна). Внутри спинного мозга имеется полость, называемая центральным каналом (лат. canalis centralis). Спинной мозг защищён мягкой, паутинной и твёрдой мозговой оболочкой. Пространства между оболочками и спинномозговым каналом заполнены спинномозговой…
Бледный шар (лат. globus pallidus s. pallidum) — парная структура переднего мозга, относящаяся к базальным ядрам, часть чечевицеобразного ядра, вентромедиальная часть полосатого тела. Подразделяется на латеральную и медиальную части.
Промежуточный мозг, или диэнцефалон (лат. Diencephalon, англ. Diencephalon; термин «диэнцефалон» происходит от др.-греч. διά — «диа-», обозначающее «через», «между», и ἐγκέφαλος — «энкефалос», буквально «находящийся внутри головы», то есть головной мозг) — отдел головного мозга хордовых животных, который образуется в процессе эмбрионального развития из задней части зародышевого переднего мозга (прозэнцефалона). На пятипузырьковой стадии из задней части зародышевого переднего мозга (прозэнцефалона…
Олигодендроциты, или олигодендроглия — это вид нейроглии, открытый Пио дель Рио-Ортегой (1928 год). Олигодендроциты есть только в центральной нервной системе, которая у позвоночных включает в себя головной мозг и спинной мозг.
Синаптогенез — процесс формирования синапсов между нейронами в нервной системе. Синаптогенез происходит на протяжении всей жизни здорового человека, а взрыв формирования синапсов, т. н. избыточный синаптогенез (exuberant synaptogenesis), наблюдается на ранних стадиях развития головного мозга. Синаптогенез особенно важен в ходе критического периода развития особи (в биологии развития, такого периода, когда нервная система особенно чувствительна к экзогенным стимулам), когда имеет место быть интенсивное…
Хвостатое ядро (лат. nucleus caudatus) — парная структура головного мозга, относящаяся к стриатуму. Расположена спереди от таламуса, от которого (на горизонтальном срезе) его отделяет белая полоска вещества — внутренняя капсула. Передний отдел хвостатого ядра утолщён и образует головку, caput nuclei caudati, которая составляет латеральную стенку переднего рога бокового желудочка. Головка хвостатого ядра примыкает внизу к переднему продырявленному веществу, в этом месте головка соединяется с чечевицеобразным…
Продолговатый мозг (лат. myelencephalon, medulla oblongata), или луковица головного мозга (лат. bulbus cerebri), — задний отдел головного мозга, непосредственное продолжение спинного мозга. Происходит из ромбовидного мозга и входит в ствол головного мозга. Регулирует такие основные процессы жизнедеятельности, как дыхание и кровообращение, поэтому в случае повреждения продолговатого мозга мгновенно наступает смерть.
Химический синапс — особый тип межклеточного контакта между нейроном и клеткой-мишенью. У данного типа синапса роль посредника (медиатора) передачи выполняет химическое вещество.
Электри́ческий си́напс (англ. electrical synapse) — место высокоспециализированных контактов (щелевых контактов) между нейронами, где происходит прямое перетекание электрических токов от одного нейрона к другому. В щелевых контактах мембраны соседних клеток находятся на расстоянии около 3,8 нм, в то время как в химическом синапсе расстояние между двумя нейронами составляет от 20 до 40 нм. У многих животных в нервной системе имеются как химические, так и электрические синапсы. По сравнению с химическими…
Упоминания в литературе (продолжение)
Основная единица нервной системы — нервная клетка (нейрон). Нейроны покрыты глиальными клетками, доставляющими им питание и удерживающими их на месте. Каждая нервная клетка состоит из тела, дендрита и аксона. В периферической нервной системе аксоны собраны в пучки – нервы. Бо́льшая часть аксонов покрыта миелиновой оболочкой, которая увеличивает скорость передачи информации в нервной системе, а также препятствует передаче нервных импульсов близлежащим клеткам. Современные исследователи опровергли бытовавшее ранее мнение о том, что «нервные клетки не восстанавливаются». Доказано, что клетки в зонах мозга, связанных с памятью и процессом обучения, продолжают развиваться и делиться в течение жизни человека.
Нервные клетки имеют несколько отростков – чувствительных древовидно ветвящихся дендритов, которые проводят к телу нейронов возбуждение, возникающее на их чувствительных нервных окончаниях, расположенных в органах, и одних двигательный аксон, по которому нервный импульс передается от нейрона к рабочему органу или другому нейрону. Нейроны вступают друг с другом в контакт с помощью окончаний отростков, образуя рефлекторные цепи, по которым передаются (распространяются) нервные импульсы.
От нервных центров по основному отростку (аксону) идут сигналы к каждой клетке и каждому органу тела, заставляя их путем электрической стимуляции выполнять определенную функцию. Нервные центры состоят из сотен и даже тысяч нервных клеток. Соответственно, существует такое же количество аксонов. Они собираются в пучки (так называемые тракты), которые, соединяясь вместе, образуют общий «кабель» – спинной мозг.
Основной ее элемент – нейрон: микроскопически малая нервная клетка с отходящими от нее отростками. Длинный отросток называется аксоном, короткий древовидной формы – дендритом. Посредством этих отростков все нервные клетки связаны между собой. Место соединения отростков называется синапсом. Пучки нервных волокон, идущие к поверхности тела, к внутренним органам и мышцам, образуют периферическую нервную систему. Разветвленные окончания нервных волокон образуют органы чувств.
Вспомогательные клетки нейроглии (астроциты) не только создают физическую опору для нейронов, но вместе с сосудами обеспечивают потребности нервной ткани в кислороде и необходимых для жизни веществах, включая аминокислоты, липиды, гликопротеиды. Тело нервной клетки имеет микроскопические размеры, но длина аксона может достигать одного метра! Отростки нейронов, как правило, укрыты миелиновой оболочкой, которая обеспечивает стабильность обмена веществ в длинных нервных проводниках и высокую скорость передачи возбуждения.
Нейрон представляет собой микроскопически малую нервную клетку с отходящими от нее отростками. Длинный отросток называется аксоном, короткий древовидной формы – дендритом. Посредством этих отростков все нервные клетки связаны между собой. Место соединения отростков называется синапсом. Пучки нервных волокон, идущие к поверхности тела, к внутренним органам и мышцам, образуют периферическую нервную систему. Разветвленные окончания нервных волокон образуют органы чувств.
Главная структурная и функциональная единица нервной системы – нейрон, представляющий собой клетку с отростками – длинным аксоном и короткими дендритами. Нейроны соединяются между собой синапсами, образуя нейронные цепи, приводимые в действие рефлекторно: в ответ на раздражение, поступаемое из внешней или внутренней среды, возбуждение из нервных окончаний передается по центростремительным волокнам в головной и спинной мозг, оттуда импульсы по центробежным волокнам поступают в различные органы, а по двигательным – к мышцам.
Аксон – вырост цитоплазмы, приспособленный для проведения информации, которая собирается ден-дритами и перерабатывается в нейроне. Аксон дендритной клетки имеет постоянный диаметр и покрыт миелиновой оболочкой, которая образована из глии, у аксона разветвленные окончания, в которых находятся митохондрии и секреторные образования.
Два слова о строении нейрона. У него есть центральная толстенькая часть – «тело», в котором находится клеточное ядро с генами. От тела отходят два вида отростков: «входные» (дендриты) и «выходные» (аксоны). Дендритов обычно много, а аксон, как правило, один, но на конце он может ветвиться.
При поражении центров коры головного мозга очень важна локализация, ведь повреждения происходят на микроскопическом уровне. Головной мозг состоит из нейронов и глиальных клеток, которые соединены между собой сложными проводимыми путями – аксонами и дендритами. По ним передаются нервные импульсы. Все мы еще со школьного курса биологии знаем, что в головном мозге есть серое и белое вещества. Серым веществом является скопление нейронов и коротких проводимых путей между ними. А вот белое вещество составляют длинные, сложные проводимые пути – нервные волокна, которые покрыты особой миелиновой оболочкой – она необходима для нормального прохождения импульсов и подобна изоляционной ленте на электрическом проводе.
В состоянии относительного физиологического покоя синапс находится в фоновой биоэлектрической активности. Ее значение заключается в том, что она повышает готовность синапса к проведению нервного импульса. В состоянии покоя 1–2 пузырька в терминале аксона могут случайно подойти к пресинаптической мембране, в результате чего вступят с ней в контакт. Везикула при контакте с пресинаптической мембраной лопается и ее содержимое в виде одного кванта АХ поступает в синаптическую щель, попадая при этом на постсинаптическую мембрану, где будет образовываться МПКН.
В состоянии относительного физиологического покоя синапс находятся в фоновой биоэлектрической активности. Ее значение заключается в том, что она повышает готовность синапса к проведению нервного импульса. В состоянии покоя 1–2 пузырька в терминале аксона могут случайно подойти к пресинаптической мембране, в результате чего вступят с ней в контакт. Везикула при контакте с пресинаптической мембраной лопается, и ее содержимое в виде 1 кванта АХ поступает в синаптическую щель, попадая при этом на постсинаптическую мембрану, где будет образовываться МПКН.
Таким образом, нейрофизиологические и психофизиологические механизмы tDCS и ТКМП достаточно многообразны, даже при приложении стандартизированных параметров тока и площади электродов (при tDCS). Нам представляется маловероятным сведение механизмов поляризаций к делоляризации или гиперполяризации мембраны нейронов. Если для пирамидных нейронов с их пространственной ориентацией в коре можно себе представить, что, например, при анодной поляризации входящий (гиперполяризующий) ток протекает преимущественно через дендрита, а выходящий (деполяризующий) ток – через начальный сегмент аксона (где генерируются спайки), вызывая его деполяризацию и увеличение возбудимости моторной коры, то это допущение плохо приложимо к другим областям коры, где ориентация нейронов не столь очевидна. Кроме того, возбуждающие или тормозные потенциалы длятся не более 10 мсек. Пассивная деполяризация мембраны еще короче. Установленные эффекты tDCS длятся десятки минут, а то и дольше. Следовательно, де– или гиперполяризация, если и играют существенную роль в возникновении эффектов, то она сводится к пусковой роли, запускающей каскад синаптических и метаболических реакций которые и лежат в основе более длительных эффектов поляризаций.
Надо сказать, что нейрон устроен очень интересно: у него, как у всякого компьютера, есть корпус – тело. И все же славится нейрон не этим, главное в нем – это его отростки. Весь нейрон чем-то напоминает дерево, которое имеет развитую крону и ствол. Крону у дерева образуют ветки, а у нейрона это короткие отростки, они называются дендритами. У дерева ствол, а у нейрона – длинный отросток, аксон. А теперь о месте соединения нервных клеток – это синапс. Если два компьютера соединить шнуром, то контакт компьютера и шнура будет как раз тем самым синапсом в нервной системе.
Активность генов в нейронах основана на свойствах молекул ДНК, т. е. активность вызвана причинно-следственными связями, которые определяют особенности контактов молекул ДНК с окружающими атомами и молекулами. В свою очередь, активность генов является причиной всех событий клеточного метаболизма и, значит, обмена веществ между нейронами и с окружающей средой. Все процессы в сообществе нервных клеток (клеточном сообществе – КС) – рождение клеток, их возбуждение и торможение, функциональная специализация и формирование в них устойчивых молекулярных структур, синтез в клетках нейромедиаторов и образование у них аксонов, дендритов и шипиков, образование и разрыв межклеточных связей, распространение и прекращение возбуждений в сообществе, гибель клеток – это детерминистские процессы. Так у нейронов в течение суток изменяются параметры метаболизма: количество и соотношение синтезируемых и разлагающихся веществ, в т. ч. количество синтезируемых нейромедиаторов и гормонов. У нейронов, как и у всех организмов, имеются суточные ритмы. В соответствии с этими ритмами в продолжение суток изменяются состав и количество клеток, возбуждающихся от воздействий окружающей среды и следов таких воздействий, результаты конкуренции клеток и узлов за прекращение своего возбуждения, используемые возбуждениями маршруты связей между клетками, конфигурация формирующихся способов прекращения возбуждений, распространяющихся из одних и тех же узлов.
Другая часть коллатералей соединяется с клетками ядра Кларка, расположенного в заднем роге спинного мозга. Данное ядро расположено от VIII шейного до II поясничного сегментов по длиннику спинного мозга. Клетки грудного ядра являются вторыми нейронами, чьи аксоны образуют задний спиномозжечковый путь. Коллатерали, идущие от задних корешков шейных сегментов, входят в состав клиновидного пучка, идут вверх к его ядру и к дополнительному клиновидному ядру. Его аксоны соединяются с мозжечком. Третья группа коллатеральных афферентных волокон заканчивается в задних рогах спинного мозга. Там расположены вторые нейроны, чьи аксоны образуют передний спино-мозжечковый путь.
Соответственно существует такое же количество аксонов. Они собираются в пучки (так называемые тракты), которые, соединяясь вместе, образуют общий «кабель» – спинной мозг.
Двигательная единица – это отдельный мотонейрон и мышечные волокна, которые он иннервирует. Таким образом, нейрон определяет, являются ли волокна медленно или быстро сокращающимися. Мотонейрон в МС двигательной единице имеет небольшое клеточное тело и иннервирует группу из 10-180 мышечных волокон. У мотонейрона в БС двигательной единице большое клеточное тело и больше аксонов, и он иннервирует от 300 до 800 мышечных волокон. Отсюда следует, что каждый МС-мотонейрон в состоянии активировать значительно меньшее количество мышечных волокон в противоположность БС-мотонейрону. При этом необходимо отметить, что сила, производимая отдельными МС- и БС-волокнами по величине отличается незначительно. МС- и БС-волокна имеют разные функции во время физической активности. МС-волокнам присущ высокий уровень аэробной выносливости, они эффективны в производстве АТФ на основе окисления углеводов и жиров и более приспособлены к выполнению длительной работы невысокой интенсивности. Быстро сокращающиеся мышечные волокна приспособлены к анаэробной деятельности (без кислорода), и при их работе АТФ образуется благодаря анаэробным реакциям. Б С двигательные единицы производят большую силу, однако легко устают ввиду ограниченной выносливости и используются главным образом при выполнении кратковременной работы высокой интенсивности.
• длинный отросток, отходящий от тела клетки, который тянется на большое расстояние – до 1,5–1,7 м. Он составляет основной, или осевой, отросток нервной клетки. Его называют аксоном (в переводе с латыни axis — ось, основание, основной).
Другая часть коллатералей соединяется с клетками ядра Кларка, расположенного в заднем роге спинного мозга. Данное ядро расположено от VIII шейного до II поясничного сегментов по длиннику спинного мозга. Клетки грудного ядра являются вторыми нейронами, чьи аксоны образуют задний спиномозжечковый путь.
Формирование мышечной ткани начинается на 4-6-й неделе внутриутробного развития. В это время формируются первичные мышечные волокна. Несколько позже в мышцы прорастают аксоны мотонейронов спинного мозга. С этой стадии начинается синхронное формирование нервно-мышечного аппарата, причем определяющее значение имеет развитие нервных элементов, происходящее на 6-7-м месяцах внутриутробного развития. К моменту рождения примерно половина мышечных волокон уже прошла стадию первичной дифференцировки, и уже определены как «белые» или «красные». Дифференцировочные процессы усиливаются в возрасте от 1 до 2 лет, а затем на стадии полового созревания.
Нейросекреторные клетки, как и обычные нервные клетки, воспринимают сигналы, поступающие к ним от других отделов нервной системы, но далее передают полученную информацию уже гуморальным путем (не по аксонам, а по сосудам) – посредством нейрогормонов. Таким образом, совмещая свойства нервных и эндокринных клеток, нейросекреторные клетки объединяют нервные и эндокринные регуляторные механизмы в единую нейроэндокринную систему. Этим обеспечивается, в частности, способность организма адаптироваться к изменяющимся условиям внешней среды. Объединение нервных эндокринных механизмов регуляции осуществляется на уровне гипоталамуса и гипофиза.
Гидроцефалический (интерстициальный) отек. Еще одной формой отека головного мозга, сопровождающейся увеличением объема интерстициального пространства, является гидроцефалический отек, обусловленный блокадой путей, соединяющих интерстициальное пространство головного мозга с макроскопическими ликворосодержащими пространствами. Для клинициста эта форма отека имеет практическое значение. Так, у больных с острой гидроцефалией в начале происходит увеличение объема интерстициальной жидкости в перивентрикулярных отделах. Узкие в норме пространства между глиальными клетками и аксонами расширяются. Астроциты набухают, атрофируются и погибают. У больных с хронической гидроцефалией деструкция аксонов, разрушение миелина, фагоцитоз липидов микроглии являются характерными гистологическими признаками. Кроме стаза внеклеточной жидкости, причиной отека у этих больных может быть и обратный ток спинномозговой жидкости из желудочков мозга. Так же, как и при любой иной форме отека мозга, в зоне отек; снижается регионарный мозговой кровоток. По-видимому, часть функциональных расстройств в ЦНС, наблюдаемых у больных с гидроцефалией, обусловлена снижением регионарного кровотока в зоне отека.
Эти два гормона относятся к особой группе, поскольку, синтезируясь в гипоталамусе, транспортируются по аксонам (отросткам нейронов) в задний гипофиз и там выделяются в системный кровоток.
Между концами может остаться небольшой диастаз, но он не должен превышать 1 мм. Свободный промежуток между концами нерва заполнит гематома, а в дальнейшем образуется соединительно—тканная прослойка, через эту гематому и соединительную ткань будут прорастать тяжи швашювских клеток и вновь сформированные аксоны.
Нервная ткань — основная ткань, формирующая нервную систему и создающая условия для реализации ее многочисленных функций. Нервная ткань имеет эктодермальное происхождение, не принято делить нервную ткань на какие-либо виды тканей. Обладает двумя основными свойствами: возбудимостью и проводимостью.
Нейрон
Структурно-функциональной единицей нервной ткани является нейрон (от др.-греч. νεῦρον — волокно, нерв) — клетка с одним
длинным отростком — аксоном (греч. axis — ось), и одним/несколькими короткими — дендритами (греч. dendros — дерево).
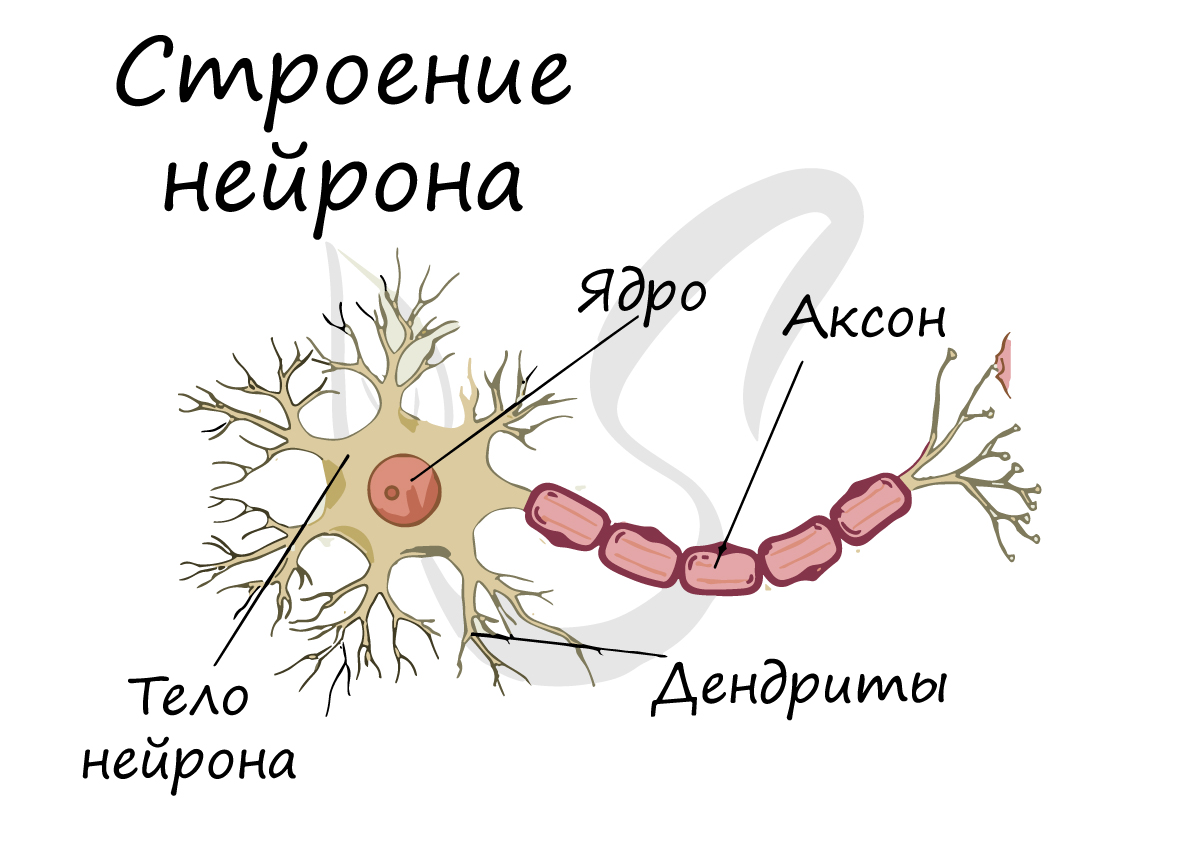
Спешу сообщить, что представление, будто короткий отросток нейрона — всегда дендрит, а длинный — всегда аксон, в корне неверно. С точки
зрения физиологии правильнее дать следующие определения: дендрит — отросток нейрона, по которому нервный импульс перемещается к телу нейрона, аксон — отросток нейрона, по которому импульс перемещается от тела нейрона.
Нейроны обладают 4 свойствами:
- Рецепция (лат. receptio — принятие) — способны воспринимать поступающие сигналы (дендриты)
- В ответ на сигналы способны переходить в состояние возбуждения или торможения
- Проведение возбуждения (от дендрита к телу нейрона, затем — к концу аксона)
- Передача сигнала другим объектам — нейрону или эффекторному органу
В физиологии эффекторным (от лат. efferes — выносящий) органом часто называют исполнительный орган или орган-мишень воздействия (мышцы, железы). Орган-эффектор выполняет те или иные «приказы» ЦНС (центральной нервной системы) или эндокринных желёз
Отростки нейронов проводят нервные импульсы и передают их другим нейронам, эффекторам, благодаря чему
мышцы сокращаются или расслабляются, а секреция желез усиливается или уменьшается.
Миелиновая оболочка
Нервные волокна подразделяются на миелиновые и безмиелиновые. Нервное волокно — это один или несколько отростков нейронов (могут быть как аксоны, так и дендриты) с окружающей оболочкой.
Безмиелиновые нервные волокна находятся преимущественно в составе вегетативной нервной системы (скорость проведения 1-2 м/c). Миелиновые — образуют белое вещество головного и спинного мозга, нервные волокна соматической нервной системы (5-120 м/с).
В миелиновых нервных волокнах отростки нейронов покрыты миелиновой оболочкой (на 70-75% состоит из липидов (жиров)), которая обеспечивает изолированное проведение нервного
импульса по нерву. Если бы не было миелиновой оболочки (вообразите!) нервные импульсы распространялись бы хаотично, и,
когда мы хотели сделать движение рукой, то вместе с рукой двигалась бы нога.
Существует болезнь при которой собственные антитела уничтожают миелиновую оболочку нервных волокон головного и спинного мозга (случаются и такие сбои в работе организма). Эта
болезнь — рассеянный склероз, по мере прогрессирования приводит к разрушению не только миелиновой оболочки, но и нервов — а значит,
происходит атрофия мышц и человек постепенно становится обездвиженным.

Миелиновый слой представлен несколькими слоями мембраны глиальной клетки (леммоцит, шванновская клетка), которые закручиваются вокруг осевого цилиндра (отростка нейрона). Это закручивание хорошо видно на картинке, где изображен здоровый нерв, чуть выше 
Миелиновый слой оболочки волокна регулярно прерывается в местах стыка соседних леммоцитов — перехваты Ранвье. Миелиновая оболочка обеспечивает изолированное и более быстрое проведение возбуждения (сальтаторный тип, лат. salto — скачу, прыгаю).

Нейроглия (греч. νεῦρον — волокно, нерв + γλία — клей)
Вы уже убедились, насколько значимы нейроны, их высокая специализация приводит к возникновению особого окружения — нейроглии.
Нейроглия (глиальные клетки, глиоциты) — вспомогательная часть нервной системы, которая выполняет ряд важных функций:
- Опорная — поддерживает нейроны в определенном положении
- Регенераторная (лат. regeneratio — возрождение) — в случае повреждения нервных структур нейроглия способствует регенерации
- Трофическая (греч. trophe — питание) — с помощью нейроглии осуществляется питание нейронов: напрямую с кровью нейроны не контактируют
- Электроизоляционная — леммоциты (шванновские клетки) закручиваются вокруг отростков нейронов и формируют миелиновую оболочку
- Барьерная и защитная — изолируют нейроны от тканей внутренней среды организма
- Некоторые глиоциты секретируют цереброспинальную (спинномозговую) жидкость — ликвор (от лат. liquor — жидкость)
В состав нейроглии входят разные клетки, их в десятки раз больше чем самих нейронов. В периферическом отделе нервной
системы миелиновая оболочка, изученная нами, образуется именно из нейроглии — шванновских клеток (леммоцитов). Между ними хорошо
заметны перехваты Ранвье — участки, лишенные миелиновой оболочки, между двумя смежными шванновскими клетками.
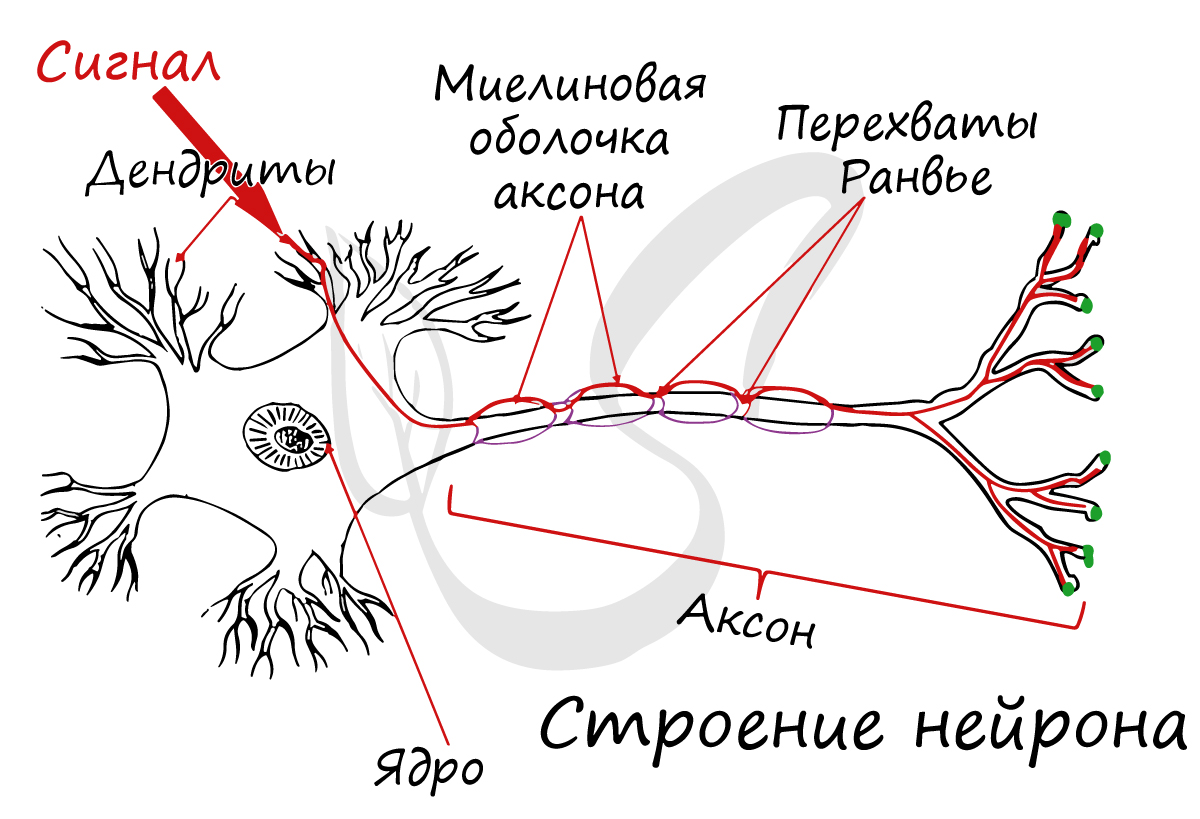
Классификация нейронов
Нейроны функционально подразделяются на чувствительные, двигательные и вставочные.
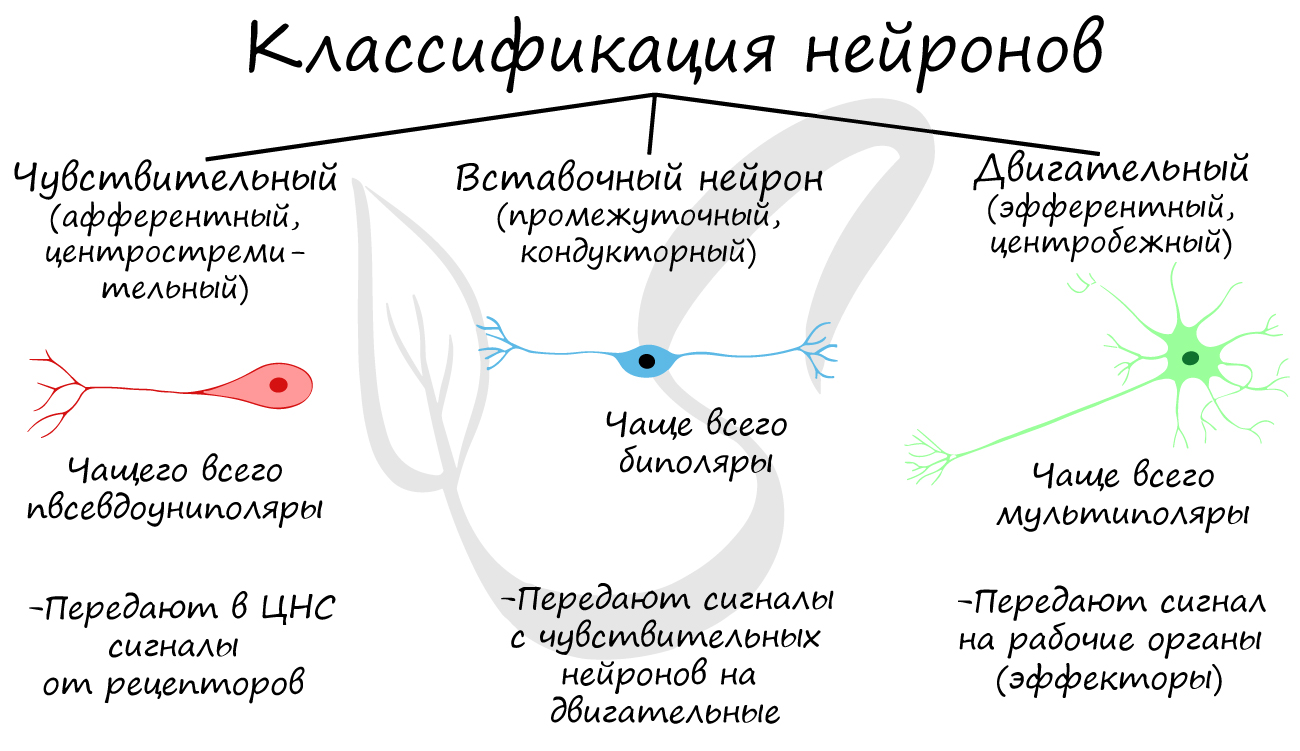
Чувствительные нейроны также называются афферентные, центростремительные, сенсорные, воспринимающие — они воспринимают раздражения, преобразуют их в нервные импульсы и передают в ЦНС. Рецептором называют концевое окончание чувствительных нервных
волокон, воспринимающих раздражитель.
Вставочные нейроны также называются промежуточные, ассоциативные — они обеспечивают связь между чувствительными и двигательными
нейронами, передают возбуждение в различные отделы ЦНС, участвуют в обработке информации и выработке команд.
Двигательные нейроны по-другому называются эфферентные, центробежные, мотонейроны — они передают нервный импульс (возбуждение) на
эффектор (рабочий орган). Наиболее простой пример взаимодействия нейронов — коленный рефлекс (однако вставочного нейрона
на данной схеме нет). Более подробно рефлекторные дуги и их виды мы изучим в разделе, посвященном нервной системе.
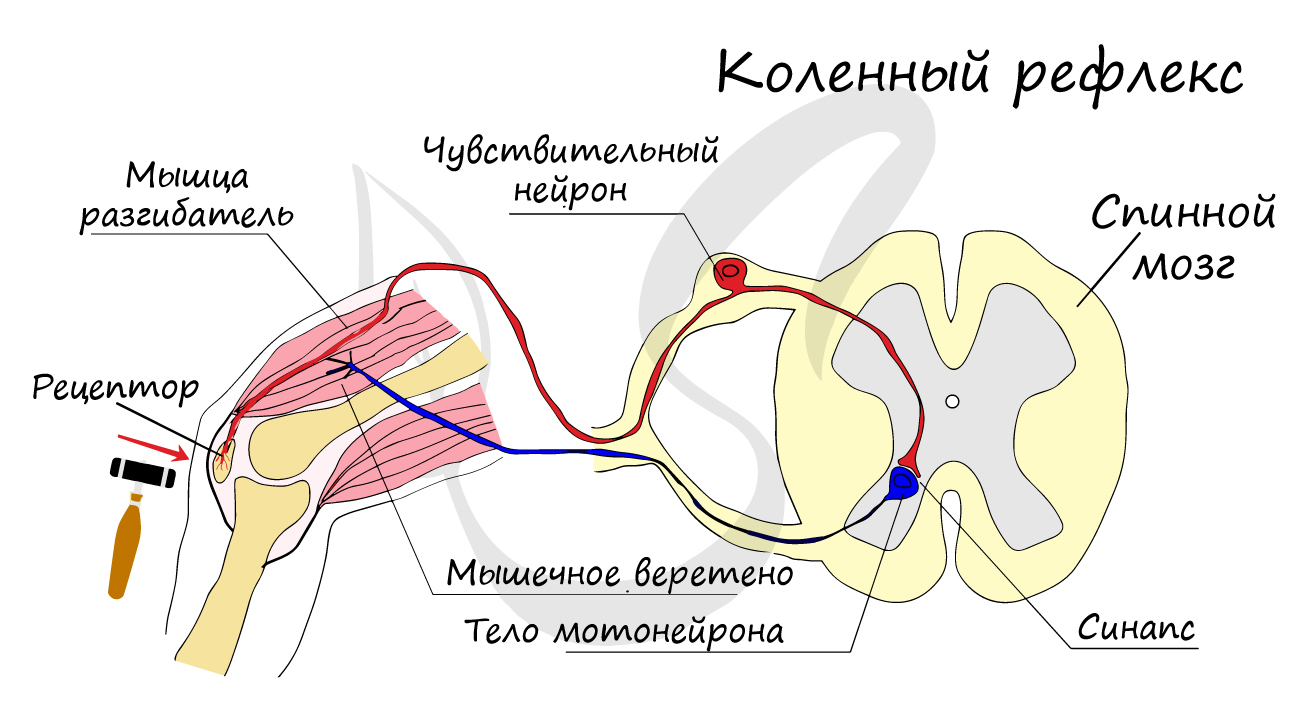
Синапс
На схеме выше вы наверняка заметили новый термин — синапс (греч. sýnapsis — соединение). Синапсом называют место контакта между двумя нейронами или между
нейроном и эффектором (органом-мишенью). В синапсе нервный импульс «преобразуется» в химический: происходит выброс особых
веществ — нейромедиаторов (наиболее известный — ацетилхолин) в синаптическую щель.
Разберем строение синапса на схеме. Его составляют пресинаптическая мембрана аксона, рядом с которой расположены везикулы (лат. vesicula — пузырек) с
нейромедиатором внутри (ацетилхолином). Если нервный импульс достигает терминали (окончания) аксона, то везикулы начинают
сливаться с пресинаптической мембраной: ацетилхолин поступает наружу, в синаптическую щель.
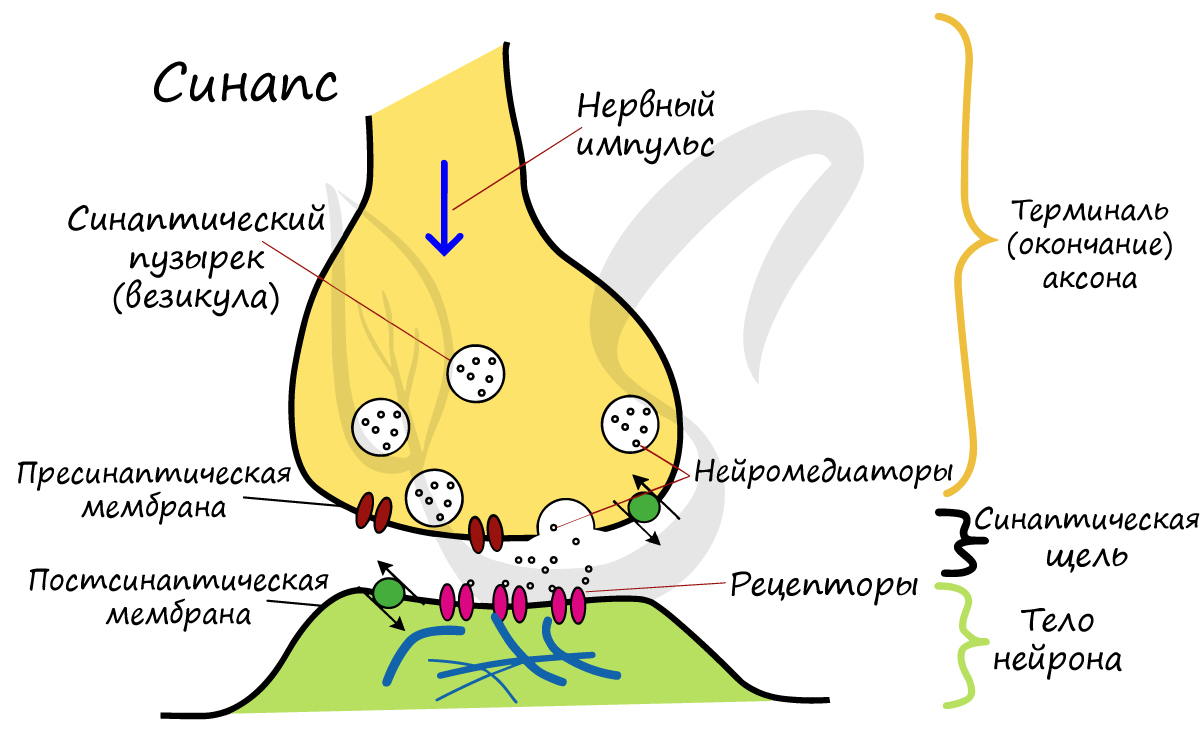
Попав в синаптическую щель, ацетилхолин связывается с рецепторами на постсинаптической мембране, таким образом, возбуждение (нервный импульс)
передается другому нейрону. Так устроена нервная система: электрический путь передачи сменяется
химическим (в синапсе).
Яд кураре
Гораздо интереснее изучать любой предмет на примерах, поэтому я постараюсь как можно чаще радовать вас ими 
историю о яде кураре, который используют индейцы для охоты с древних времен.
Этот яд блокирует ацетилхолиновые рецепторы на постсинаптической мембране, и, как следствие, химическая передача возбуждения с
одного нейрона на другой становится невозможна. Это приводит к тому, что нервные импульсы перестают поступать к эффекторам,
в том числе к дыхательным мышцам (межреберным, диафрагме), вследствие чего дыхание останавливается и наступает смерть животного.

Нервы и нервные узлы
Собираясь вместе, отростки нейронов (нервные волокна) образуют пучки нервных волокон. Нервные пучки объединяются в нервы, которые покрыты соединительнотканной оболочкой.
В случае, если тела нейронов концентрируются в одном месте за пределами центральной нервной системы, их скопления
называют нервным узлом — или ганглием (от др.-греч. γάγγλιον — узел).
В случае сложных соединений между нервными волокнами говорят о нервных сплетениях. Одно из наиболее известных —
плечевое сплетение.
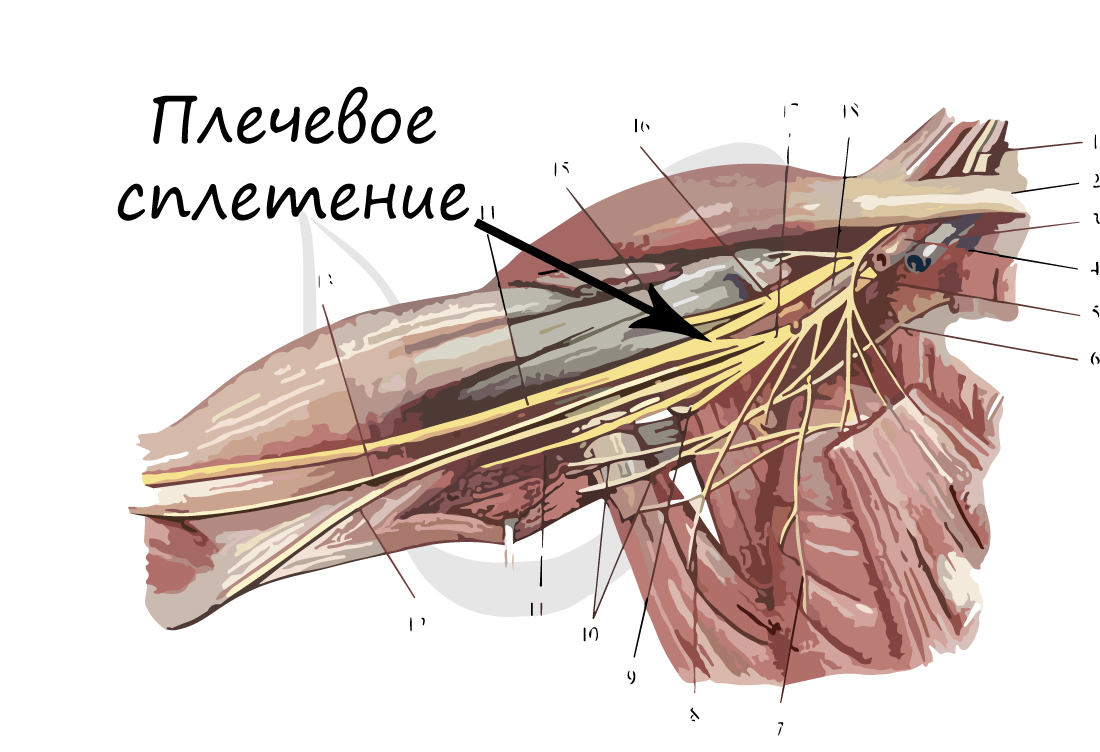
Болезни нервной системы
Неврологические болезни могут развиваться в любой точке нервной системы: от этого будет зависеть клиническая картина. В случае повреждения
чувствительного пути пациент перестает чувствовать боль, холод, тепло и другие раздражители в зоне иннервации пораженного нерва, при этом
движения сохранены в полном объеме.
Если повреждено двигательное звено, движение в пораженной конечности будет
невозможно: возникает паралич, но чувствительность может сохраняться.
Существует тяжелое мышечное заболеванием — миастения (от др.-греч. μῦς — «мышца» и ἀσθένεια — «бессилие, слабость»), при
котором собственные антитела разрушают мотонейроны (двигательные нейроны).

Постепенно любые движения мышцами становятся для пациента все труднее,
становится тяжело долго говорить, повышается утомляемость. Наблюдается характерный симптом — опущение верхнего века.
Болезнь может привести к слабости диафрагмы и дыхательных мышц, вследствие чего дыхание становится невозможным.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Аксон 9-дневной мыши
Аксон (греч. ἀξον — ось) — нейрит, осевой цилиндр, отросток нервной клетки, по которому нервные импульсы идут от тела клетки (сомы) к иннервируемым органам и другим нервным клеткам.
Нейрон состоит из одного аксона, тела и нескольких дендритов, в зависимости от числа которых нервные клетки делятся на униполярные, биполярные, мультиполярные. Передача нервного импульса происходит от дендритов (или от тела клетки) к аксону, а затем сгенерированный потенциал действия от начального сегмента аксона передается назад к дендритам [1]. Если аксон в нервной ткани соединяется с телом следующей нервной клетки, такой контакт называется аксо-соматическим, с дендритами — аксо-дендритический, с другим аксоном — аксо-аксональный (редкий тип соединения, встречается в ЦНС).
В месте соединения аксона с телом нейрона у наиболее крупных пирамидных клеток 5-ого слоя коры находится аксонный холмик. Ранее предполагалось, что здесь происходит преобразование постсинаптического потенциала нейрона в нервные импульсы, но экспериментальные данные это не подтвердили. Регистрация электрических потенциалов выявила, что нервный импульс генерируется в самом аксоне, а именно в начальном сегменте на расстоянии ~50 мкм от тела нейрона [2]. Для генерации потенциала действия в начальном сегменте аксона требуется повышенная концентрация натриевых каналов (до ста раз по сравнению с телом нейрона[3]).
Питание и рост аксона зависят от тела нейрона: при перерезке аксона его периферическая часть отмирает, а центральная сохраняет жизнеспособность. При диаметре в несколько микронов длина аксона может достигать у крупных животных 1 метра и более (например, аксоны, идущие от нейронов спинного мозга в конечности). У многих животных (кальмаров, рыб, кольчатых червей, форонид, ракообразных) встречаются гигантские аксоны толщиной в сотни мкм (у кальмаров — до 2—3 мм). Обычно такие аксоны отвечают за проведение сигналов к мышцам, обеспечивающим «реакцию бегства» (втягивание в норку, быстрое плавание и др.). При прочих равных условиях с увеличением диаметра аксона увеличивается скорость проведения по нему нервных импульсов.
В протоплазме аксона — аксоплазме — имеются тончайшие волоконца — нейрофибриллы, а также микротрубочки, митохондрии и агранулярная (гладкая) эндоплазматическая сеть. В зависимости от того, покрыты ли аксоны миелиновой (мякотной) оболочкой или лишены её, они образуют мякотные или безмякотные нервные волокна.
Миелиновая оболочка аксонов имеется только у позвоночных. Её образуют «накручивающиеся» на аксон специальные шванновские клетки (в центральной нервной системе — олигодендроциты), между которыми остаются свободные от миелиновой оболочки участки — перехваты Ранвье. Только на перехватах присутствуют потенциал-зависимые натриевые каналы и заново возникает потенциал действия. При этом нервный импульс распространяется по миелинизированным волокнам ступенчато, что в несколько раз повышает скорость его распространения. Скорость передачи сигнала по покрытым миелиновой оболочкой аксонам достигает 100 метров в секунду.[4]
Безмякотные аксоны меньше размерами чем аксоны покрытые миелиновой оболочкой, что компенсирует потери в скорости распространения сигнала по сравнению с мякотными аксонами.
Концевые участки аксона — терминали — ветвятся и контактируют с другими нервными, мышечными или железистыми клетками. На конце аксона находится синаптическое окончание — концевой участок терминали, контактирующий с клеткой-мишенью. Вместе с постсинаптической мембраной клетки-мишени синаптическое окончание образует синапс. Через синапсы передаётся возбуждение.
Примечания
- ↑ Dendritic backpropagation and the state of the awa… [J Neurosci. 2007] — PubMed result
- ↑ Action potentials initiate in the axon initial seg… [J Neurosci. 2010] — PubMed result
- ↑ Action potential generation requires a high sodium… [Nat Neurosci. 2008] — PubMed result
- ↑ Блум Ф., Лейзерсон А., Хофстедтер Л. Мозг, разум и поведение. М., 1988
Ссылки
- Савельев А. В. Моделирование логики самоорганизации активности нервного пучка эфаптическими взаимодействиями аксонного уровня // сб.: Моделирование неравновесных систем. — Институт вычислительного моделирования СО РАН, Красноярск, 2004. — С. 142-143.
См. также
- Аксональный поиск пути
- Аксональный транспорт
- Аксон-рефлекс
- Конус роста
- Дендрит
- Валлерова дегенерация — при разрыве аксона
| |
|
|---|---|
| Нейроны (Серое вещество) |
Сома · Аксон (Аксонный холмик, Терминаль аксона, Аксоплазма, Аксолемма, Нейрофиламенты) Дендрит (Вещество Ниссля, Дендритный шипик, Апикальный дендрит, Базальный дендрит) типы: Биполярные нейроны · Псевдополярные нейроны · Мультиполярные нейроны · Пирамидальный нейрон · Клетка Пуркинье · Гранулярная клетка |
| Афферентный нерв/ Сенсорный нерв/ Сенсорный нейрон |
GSA · GVA · SSA · SVA · Нервные волокна (Мышечные веретёна (Ia), Нервно-сухожильное веретено, II or Aβ, Aδ-волокна, C-волокна) |
| Эфферентный нерв/ Моторный нерв/ Моторный нейрон |
GSE · GVE · SVE · Верхний моторный нейрон · Нижний моторный нейрон (α мотонейроны, γ мотонейроны) |
| Синапс | Нейропиль · Синаптический пузырек · Нервно-мышечный синапс · Электрический синапс · Химический синапс · Интернейрон (Клетки Реншоу) |
| Сенсорный рецептор | Чувствительное тельце Мейснера · Нервное окончание Меркеля · Тельца Пачини · Окончание Руффини · Нервномышечное веретено · Свободное нервное окончание · Обонятельный нейрон · Фоторецепторные клетки · Волосковые клетки · Вкусовая луковица |
| Нейроглия | Астроциты (Радиальная глия) · Олигодендроглиоциты · Клетки эпендимы (Танициты) · Микроглия |
| Миелин (Белое вещество) |
CNS: Олигодендроцит PNS: Клетки Шванна · Невролемма · Перехват Ранвье/Межузловой сегмент · Насечка миелина |
| Соединительная ткань | Эпиневрий · Периневрий · Эндоневрий · Нервные пучки · Мозговые оболочки: твёрдая, паутинная, мягкая |
The axon is the output of the neuron, carrying information in the form of action potentials to be received by other neurons, muscles and many additional body organs, at distances up to meters away.
From: Pediatric Critical Care (Fourth Edition), 2011
Axon
Kathleen S. Rockland, in Encyclopedia of the Human Brain, 2002
III.A Subdivisions
Axon structure can be analyzed in several ways. One way is to distinguish between cytoskeletal and membranous components. The cytoskeleton is considered to comprise three domains linked in a microtrabecular meshwork: the microtubules, neurofilaments, and, adjoining the peripheral membrane, the actin microfilaments. Neurofilaments are a type of intermediate filament, about 10 nm in diameter, which consist of a species-specific ratio of three proteins (68, 150, and 200 kDa). Microtubules are somewhat larger (20–26 nm in diameter), and consist of two globular polypeptides, α and β tubulin, 50 kDa each. Microtubules have polarity, by conventional designated as “+” or “-”(respectively nearest the distal or proximal cell body region). Head-to-tail polymerization occurs, with subunits added to the plus end and released from the minus end (“treadmilling”). There are several microtubule-associated proteins (MAPS) that protrude as side arms and contribute to the microtrabecular meshwork.
Neurofilaments predominate in large axons, but microtubules predominate in small axons, and the total number of both structures is proportional to the caliber of the axon (Fig. 4). These structures play a role in skeletal support as well as in intracellular transport of ions, metabolites, and vesicles.
Figure 4. Electron micrographs of monkey cortical tissue. Two axons (AX) have been anterogradely filled with tracer transported from a distant injection site. Several other unlabeled axons occur in the same field (asterisks). M, myelin.
A major membranous component of the axon is the agranular ER, which is thought to consist of two subsystems: (i) clusters of tubules and flattened sacs at the outer wall of the axons and (ii) a complex of narrow tubules and sacs oriented parallel to the long axis of the axon, which is believed to extend the full length of the axon. The agranular ER has been thought to contribute to axonal transport, and it possibly contributes to the sequestration of Ca2+ ions and the provision of membrane for forming synaptic vesicles.
Many long, type I axons have an associated specialization, the myelin sheath of the plasmalemma, which is elaborated by glial processes. The myelin wrapping is interrupted by nodes of Ranvier, which are involved in the process of saltatory impulse conduction.
Axons can also be subdivided into several specialized portions along their proximal to distal length. The proximal portion, at the juncture with the cell body, is termed the axon hillock (Fig. 1). This region is characterized by fascicles of microtubules and a high density of sodium-dependent channels. The high density of channels accords with the importance of this region as a “trigger zone” for the initiation of axon impulses.
Adjoining the axon hillock distally is the initial segment (20–50 nm in length). This portion has clusters of microtubules and an undercoating of dense material below the plasmalemma. The initial segment leads into the body of the axon. This can range from <0.5 mm in the case of type II, local circuit axons to several centimeters or even meters in the case of axons projecting from motor cortex to the lower spinal cord of larger animals. Axons in some systems can send branches (“collaterals”) to different target structures. Finally, at the distalmost portion, axons form terminal arbors (Fig. 5). Arbors consist of preterminal and terminal portions. The preterminal portions are where the axon begins to branch repeatedly, and, if myelinated, loses the myelin sheath. Terminal portions are thin-caliber branches, decorated with synaptic terminal specializations.
Figure 5. Photomicrographs of two corticocortical axon arbors anterogradely filled with tracer (BDA) transported from a distant injection site. Both arbors are about the same size. One (A, B) has very large terminal specializations. The other (C, D) has delicate beaded and stalked endings and is more typical. B is higher magnification of A. D is higher magnification of C. Arrows point to corresponding features.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0122272102000510
Organization of Axons in Their Tracts
Austen A. Sitko, Carol A. Mason, in Axons and Brain Architecture, 2016
13.3.2.2 Heterotypic Axon–Axon Interactions
Axon cohorts in tracts can be either grossly or finely heterotypic (Figure 13.2D–E). This section will first consider grossly heterotypic axon–axon interactions, prime examples of which include TCAs and CTAs in the thalamocortical tract, or sensory and motor spinal axons in the periphery, where two cohorts from different sources run segregated from each other in a tract containing reciprocal projections (Figure 13.2D). Finely heterotypic axon–axon interactions are those occurring between subsets of axons arising from the same source but representing different molecularly defined neuronal subtypes; these cases will be considered at the end of this section. Common guidance molecules participate in both types of heterotypic axon–axon interactions, including the Eph:ephrin family, Semas, Plexins, and Neuropilins.
In the peripheral nerve tracts, motor axons extend before sensory axons, which in turn rely on motor axons to form correct patterns of connections (Wang and Marquardt, 2013). While these two heterotypic axon cohorts run closely together, sensorimotor function requires their appropriate segregation. In the axial nerves, this segregation has been found to depend on repulsive transaxonal signaling between motor axon EphA3/EphA4 receptors and sensory axon ephrin-A ligands. Perturbing ephrinA–EphA forward signaling accordingly results in severe wiring defects in the peripheral nerves (Gallarda et al., 2008). However, EphA3/4 and ephrin-As are also required for sensory axons to track along preformed motor axon pathways in the limb (Wang et al., 2011). This curious dual action of EphAs/ephrin-As relies on the forward and reverse signaling capabilities of the binding partners; namely, segregation of motor and sensory axons results from forward signaling and sensory axon tracking along motor axons utilizes reverse signaling (Wang et al., 2011). The reliance on motor axons for sensory axon pathfinding was further demonstrated by assessing the sensory axon routes taken in two mouse strains that display motor axon pathfinding errors (EphA4 and Ret mutants). In both cases, as well as in analogous zebrafish mutants, sensory axons mimicked the pathfinding errors made by motor axons (Wang et al., 2014).
The reciprocal projections comprising the thalamocortical pathway are the other prime example of grossly heterotypic axon–axon interactions in developing tracts. Recent work demonstrates a mutual reliance of TCAs and CTAs on each other for successful tract organization and navigation to their respective targets (e.g., Chen et al., 2012; Deck et al., 2013), and some of the molecules involved in these axon–axon interactions have been identified. The CTA waiting period, as discussed in Section 13.3.1.1 is governed by Sema3E/Plexin-D1. If Sema3E/Plexin-D1 signaling is perturbed, all corticofugal axons pass the PSPB prematurely, bypassing their encounter with TCAs. They subsequently take a corticosubcerebral trajectory, rather than dividing into the appropriate corticothalamic and corticosubcerebral paths (Deck et al., 2013). This finding highlights the necessity of the subpallial “handshake” between thalamic and cortical axons. In the converse scenario, when CTA outgrowth is prevented, TCAs are rendered incapable of navigating across the PSPB and into the cortex (Chen et al., 2012). This mutual reliance is suggestive of heterotypic axon–axon interactions or fasciculation occurring in the PSPB and along the tract. Curiously, TCAs and CTAs collapse upon contact with each other in vitro, and thus are not intrinsically inclined to cofasciculate (Bagnard et al., 2001). From this, the “handshake” between TCAs and CTAs is likely mediated by a combination of axon-extrinsic cues in the surrounding ventral telencephalon, which may in turn affect direct axon–axon interactions between the two axon populations. The intimate association between thalamic and cortical axons in the IC and along the tract (Molnar et al., 1998) implicates cofasciculation between these heterotypic axon cohorts. Likewise, their codependency on each other for guidance, and the fact that a subset of CTAs track along misrouted TCAs in EphB1/2 double knockout mice (Robichaux et al., 2014) provides further support to a model in which direct axon–axon interactions are involved in organization and guidance of these axonal cohorts.
The Eph:ephrin family may be involved in such an interaction. In the primary olfactory nerve of the moth Manduca sexta, Eph receptors and ephrins are differentially expressed among glomeruli and are candidates for mediating OSN axon sorting prior to glomerulus innervation (Kaneko and Nighorn, 2003). Importantly, there is no detectable Eph or ephrin expression intrinsic to the OSN axons’ target, the antennal lobe, signifying that Eph–ephrin repulsive signaling involved in sorting axons would necessarily occur via direct axon–axon interactions (Kaneko and Nighorn, 2003).
Eph–ephrin-mediated sorting of moth OSN axons involves a different kind of heterotypy than has been considered thus far. As opposed to the grossly heterotypic interactions of reciprocal projections in the spinal cord or thalamus, in finely heterotypic axon–axon interactions, axons originating from the same source must segregate into appropriate subfascicles representing different neuronal subtypes prior to target innervation. Sorting of axons into subfascicles in a tract is thought to occur by selective inhibition of fasciculation, such that individual cohorts can separate from a larger group and select the correct trajectory to the appropriate target (Figure 13.2E). An example comes from the chick spinal cord marginal zone, where intermediate and medial longitudinal commissural (ILc and MLc) axons run parallel in the lateral and ventral funiculi, respectively. ILc axons express Robo, which is thought to inhibit N-cadherin-driven fasciculation in order to separate ILc axons away from the MLc fascicle. Accordingly, loss of Robo function leads to ILc axons aberrantly coursing alongside MLc axons in the ventral funiculus and subsequently mistargeting in the brain (Sakai et al., 2012).
Semas and their Nrp and Plexin receptors are also involved in sorting axons within tracts. In the mouse OE, different populations of OSN axons express Sema3A and Nrp1 in a roughly regionally defined manner. These OSN axons are likewise segregated from each other in the olfactory nerve, and selectively deleting either Nrp1 or Sema3A in OSNs leads to a blurring of pretarget axon order and shifts in glomerular position in the OB (Imai et al., 2009). Because these effects are found in conditional mutants that only affect subsets of OSNs, they occur independently of Sema3A surround expression by OEG. Given this result, the authors conclude that axon–axon interactions are critical for establishing pretarget axon organization in the olfactory nerve (Imai et al., 2009).
Sema3A and Nrp1 are also implicated in establishing the dorsal–ventral segregation of axons in the CC (Zhou et al., 2013). This order reflects a medial-high to lateral-low gradient of Nrp1 expression in the cortex and a reciprocal, though broader expression of Sema3A, which is slightly higher in the lateral cortex. Disrupting these molecular gradients perturbs both axon position in the CC and the position of axon terminations in the contralateral cortex. The authors propose that both axon-extrinsic and axon–axon interactions are at play (Zhou et al., 2013). It is intriguing to speculate that Sema/Nrp interactions may be a conserved mechanism in mediating axon sorting across other systems as well.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012801393900013X
Action Potential Initiation and Conduction in Axons
J.H. Caldwell, in Encyclopedia of Neuroscience, 2009
Structural and Functional Differences of Vertebrate Axons
Axons fall into two major categories depending on the structure of the glial cells that envelop them. The first category is the unmyelinated axon, which describes all invertebrate axons and small axons of vertebrates, typically axons with a diameter below 1 μm. The unmyelinated axon is usually loosely surrounded by a glial cell or in some cases, such as parallel fibers in the cerebellar molecular layer, is not covered by a glial cell. The speed of conduction of an action potential in an unmyelinated axon is proportional to the square root of the axon diameter. Thus, invertebrates have large-diameter axons for signals that need to be propagated rapidly. The squid giant axon, which is part of a circuit used for rapid propulsion in the escape response, is as large as 1 mm in diameter, conducts at 25 m s−1 (at 25 °C), and is formed by the fusion of axons of many neurons.
Vertebrates have evolved an alternative strategy for increasing the speed of action potential conduction. Vertebrate axons larger than about 1 μm are tightly wrapped by many layers of the glial cell, creating the second category, the myelinated axon. Myelination occurs in a repeating pattern, with long wrapped regions (internodes that are up to 1–2 mm in length) interrupted by a very short bare region (the node of Ranvier, 1–2 μm in length). In the PNS the glial cell is a Schwann cell. Each Schwann cell can envelop many unmyelinated axons, but when myelination occurs, one Schwann cell is devoted to the formation of one myelinated internode. Myelin in the CNS is formed by oligodendrocytes, and one oligodendrocyte sends out tens of processes, each one forming an internode on a different axon. Functionally, the myelin acts as an insulator, by reducing the leak of current through the membrane in the internodal regions. The myelin also reduces the effective capacitance of the internodal region, which in turn reduces the capacitive current required to charge the internodal membrane. Consequently, current travels rapidly with little loss in the internodal regions to the node of Ranvier, where the current is boosted or regenerated by voltage-gated sodium channels concentrated at the node (described later). Conduction velocity in myelinated axons is proportional to the axon diameter, and the general rule of thumb is that for axons with an outside diameter greater than 11 μm, the speed of conduction, in meters per second, is about six times the axon diameter, in micrometers. For smaller axons the proportionality factor is 4.5. An axon 20 μm in diameter, which is one of the largest in the mammalian nervous system, conducts at 120 m s−1, about five times faster than the squid axon, even though it is 50 times smaller. Thus, myelination not only increases speed of conduction, but also does this with an economy of space. This concept of economizing the volume used for conduction is invoked to explain why we have many more unmyelinated axons than myelinated ones: more information can be carried in a given volume with small, unmyelinated axons. In the mammalian nervous system, pain and temperature information is carried by small, unmyelinated axons in the PNS, and the molecular layer of the cerebellum in the CNS is densely packed with parallel fibers that are unmyelinated axons of granule cells.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469016429
Olfactory Glomeruli: Structure and Circuitry
M.T. Shipley, A.C. Puche, in Encyclopedia of Neuroscience, 2009
The ON→ET→SA Interglomerular Circuit
SA cells lack monosynaptic ON input but do receive excitatory monosynaptic input from ET cells. Thus, the fourth principal glomerular circuit is the ON→ET→SA cell circuit. SA cells give rise to a rich axonal plexus that contacts multiple glomeruli up to a millimeter distant. The existence of this interglomerular network suggested that SA cells mediate interactions among glomeruli. Experiments using voltage-sensitive dyes showed these interglomerular connections to be excitatory. SA cells make glutamatergic synapses with neurons in distant glomeruli and stimulation of interglomerular axons produce EPSCs in PG and ET cells of target glomeruli. This raised the possibility that the interglomerular circuit could inhibit M/T cells via an SA→PG→M/T cell circuit. This was confirmed by showing that stimulation of interglomerular axons produced a compound inhibitory postsynaptic potential (IPSP) in mitral cells; the IPSP was blocked by the GABAA receptor antagonist gabazine. The inhibition produced by activating the interglomerular circuit was sufficient to terminate ON-evoked LLDs in mitral cells. Thus, there is a network composed, minimally, of an ON→ET→SA→(distal glomerulus)→PG→M circuit, which provides interglomerular lateral inhibition. Strong ON activation of a given glomerulus activates the ON→ET→SA→(distal glomerulus)→PG→M circuit, which inhibits mitral cells – and thus glomerular throughput – in weakly activated glomeruli. Such lateral inhibition could function to enhance contrast among differentially activated glomeruli.
The length of SA axons does not necessarily limit the spatial propagation of interglomerular activity. Since stimulation of the SA interglomerular axons excites ET cells of distant glomeruli, it is possible that ET cells excite additional local SA cells which further inhibit more distant glomeruli, via an ON→ET→SA→(distal glomerulus) ET→SA→(distal glomerulus) multisynaptic interglomerular circuit. Mathematical modeling of this propagating network suggests that the interglomerular circuit may provide input to all glomeruli that represents the average of glomerular activity over much of the bulb. A consequence of this is that an overall increase in glomerular activity, such as during high-concentration odor exposure, would result in a higher level of activity in the interglomerular network and a higher level of inhibition onto mitral cells. This putative averaging function could ‘normalize’ postsynaptic activity to changes in odor concentration.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469018131
Membrane Potential and Action Potential
David A. McCormick, in Fundamental Neuroscience (Fourth Edition), 2013
The Speed of Action Potential Propagation Is Affected by Myelination
Axons may be either myelinated or unmyelinated. Invertebrate axons or small vertebrate axons are typically unmyelinated, whereas larger vertebrate axons are often myelinated. As described in Chapter 3, sensory and motor axons of the peripheral nervous system are myelinated by specialized cells (Schwann cells) that form a spiral wrapping of multiple layers of myelin around the axon (Fig. 5.9). Several Schwann cells wrap around an axon along its length; between the ends of successive Schwann cells are small gaps (nodes of Ranvier). In the central nervous system, a single oligodendrocyte, a special type of glial cell, typically ensheaths several axonal processes.
Figure 5.9. Propagation of the action potential in unmyelinated and myelinated axons. (A) Action potentials propagate in unmyelinated axons through the depolarization of adjacent regions of membrane. In the illustrated axon, region 2 is undergoing depolarization during the generation of the action potential, whereas region 3 has already generated the action potential and is now hyperpolarized. The action potential will propagate further by depolarizing region 1. (B) Vertebrate myelinated axons have a specialized Schwann cell that wraps around them in many spiral turns. The axon is exposed to the external medium at the nodes of Ranvier (Node). (C) Action potentials in myelinated fibers are regenerated at the nodes of Ranvier, where there is a high density of Na+ channels. Action potentials are induced at each node through the depolarizing influence of the generation of an action potential at adjacent nodes, thereby increasing conduction velocity.
In unmyelinated axons, the Na+ and K+ channels taking part in action potential generation are distributed along the axon, and the action potential propagates along the length of the axon through local depolarization of each neighboring patch of membrane, causing that patch of membrane to also generate an action potential (Fig. 5.9). Myelination of the axon reduces its membrane capacitance by moving the electrical charge differences between the inside and outside of the axon further apart and thus reducing their influence on each other. This has the effect of significantly increasing the passive length constant (λ) of the axon. In myelinated axons, however, the Na+ channels are concentrated at the nodes of Ranvier. The generation of an action potential at each node results in depolarization of several adjacent nodes (owing to the long length constant of the myelinated axon) and subsequently generation of an action potential with an internode delay of only about 20 μs, referred to as saltatory conduction (from the Latin saltare, “to leap”). Interestingly, since action potentials are typically 1 msec or longer in duration, many adjacent nodes of Ranvier are in the process of generating action potentials at the same time (Popovic et al., 2011). Growing evidence indicates that, near the nodes of Ranvier and underneath the myelin covering, K+ channels may play a role in determining the resting membrane potential and repolarization of the action potential. A cause of some neurological disorders, such as multiple sclerosis and Guillain-Barre syndrome, is the demyelination of axons, resulting in a block of conduction of the action potentials.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123858702000056
Schwann Cells and Axon Relationship
R.D. Fields, in Encyclopedia of Neuroscience, 2009
Regeneration
Axon damage results in Schwann cell responses that reflect the close interdependence of these two cells. After axotomy, the portion of the axon distal to the damage degenerates, but the Schwann cells in the distal stump begin to proliferate and synthesize growth factors that sustain the survival of the Schwann cells and the axons. Survival of neurons and elongation of sprouting axons from the proximal stump of severed axons is sustained by factors secreted by the Schwann cells and the extracellular matrix that they form. These factors include NGF, BDNF, and LIF. These beneficial properties of Schwann cells have been exploited to promote regeneration of axons in the central nervous system in Schwann cell transplantation experiments.
Schwann cells that are chronically isolated from their axons, however, begin to lose the capacity to support axon survival and outgrowth. This is one of the major reasons for permanent paralysis and failure to restore function in patients with damage to long nerves. Axon regeneration proceeds relatively slowly, at a rate of approximately 1 mm per day, and the Schwann cells in the extreme regions of limbs lose their ability to sustain axon regeneration before the regenerating axons can reach them.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469006987
Hindbrain
Joel C. Glover, in Encyclopedia of the Human Brain, 2002
II.A.3 Axon Outgrowth and Tract Formation
Axon outgrowth is an early feature of neuronal differentiation and may be quite advanced even as neurons are migrating. Many axons are commissural, crossing the midline to course in axon tracts and innervate synaptic targets on the opposite side of the neuraxis. Once axons begin to project longitudinally, they tend to fasciculate into bundles that are located predominantly either near the pial surface or adjacent to the raphe. Two major axon bundles are present at early stages of hindbrain development: a medial longitudinal fascicle (mlf) and a lateral longitudinal fascicle (llf) (Fig. 5). Each contains ascending and descending axons, which tend to be segregated into subfascicles containing axons of a given type. As the transversal area of the hindbrain expands, the mlf maintains its coherence alongside the raphe and remains as the tract of the same name in the mature brain. The llf, on the other hand, splits into several tracts, including various ascending sensory tracts, the spinal trigeminal tract, and the lateral vestibulospinal tract. This splitting is accompanied by intercalation of increasing numbers of neurons and other axons. Thus, the early formation of longitudinal axon tracts occurs on a simple scaffold that increases in complexity by a process of fission. Later formed tracts, such as the corticospinal tract and the pontocerebellar projection, are layered externally to the early formed tracts.
Figure 5. Transverse sections through the developing medulla oblongata of a chicken embryo illustrating the initial two longitudinal fiber bundles [A; medial longitudinal fascicle (mlf) and lateral longitudinal fascicle (lat)] and the splitting of the lateral longitudinal fascicle into separate tracts (B; 1, spinocerebellar tract; 2, spinal trigeminal tract; 3, lateral vestibulospinal tract) (modified from Glover and Petursdottir, 1991).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0122272102001631
Membrane Potential and Action Potential
David A. McCormick, in From Molecules to Networks (Third Edition), 2014
The Speed of Action Potential Propagation is Affected by Myelination
Axons may be either myelinated or unmyelinated. Invertebrate axons or small vertebrate axons are typically unmyelinated, whereas larger vertebrate axons are often myelinated. As described in Chapter 1, sensory and motor axons of the peripheral nervous system are myelinated by specialized cells (Schwann cells) that form a spiral wrapping of multiple layers of myelin around the axon (Fig. 12.8). Several Schwann cells wrap around an axon along its length; between the ends of successive Schwann cells are small gaps (nodes of Ranvier). In the central nervous system, a single oligodendrocyte, a special type of glial cell, typically ensheathes several axonal processes (Bunge, 1968).
Figure 12.8. Propagation of the action potential in unmyelinated and myelinated axons.
(A) Action potentials propagate in unmyelinated axons through the depolarization of adjacent regions of membrane. In the illustrated axon, region 2 is undergoing depolarization during the generation of the action potential, while region 3 has already generated the action potential and is now hyperpolarized. The action potential will propagate further by depolarizing region 1. (B) Vertebrate myelinated axons have a specialized Schwann cell that wraps around them in many spiral turns. The axon is exposed to the external medium at the nodes of Ranvier (Node). (C) Action potentials in myelinated fibers are regenerated at the nodes of Ranvier, where there is a high density of Na+ channels. Action potentials are induced at each node through the depolarizing influence of the generation of an action potential at adjacent nodes, thereby increasing the conduction velocity.
In unmyelinated axons, the Na+ and K+ channels taking part in action potential generation are distributed along the axon, and the action potential propagates along the length of the axon through local depolarization of each neighboring patch of membrane (see Chapter 17), causing that patch of membrane also to generate an action potential (Fig. 12.8). In myelinated axons, on the other hand, the Na+ channels are concentrated at the nodes of Ranvier (Ritchie and Rogart, 1977). The generation of an action potential at each node results in the depolarization of the next node and subsequently the generation of an action potential with an internode delay of only about 20 μs, referred to as saltatory conduction (from the Latin saltare, “to dance”). Growing evidence indicates that, near the nodes of Ranvier and underneath the myelin covering, K+ channels may play a role in determining the resting membrane potential and the repolarization of the action potential. A cause of some neurological disorders, such as multiple sclerosis and Guillain–Barré syndrome, is the demyelination of axons, resulting in a block of conduction of action potentials (see Chapter 1).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123971791000129
Neuron–glial cell cooperation
Constance Hammond, … Elena Avignone, in Cellular and Molecular Neurophysiology (Fourth Edition), 2015
The myelin sheath is a compact roll of the plasmalemma of an oligodendrocyte process: this glial membrane is rich in lipids
Myelinated axons are surrounded by a succession of myelin segments, each about 1 mm long. The covered regions of axons alternate with short exposed lengths where the axonal membrane (axolemma) is not covered. These unmyelinated regions (of the order of a micron) are called nodes of Ranvier (Figures 2.4 and 2.5a).
Figure 2.4. Diagram and photomicrographs of myelinating oligodendrocytes and their numerous processes.
(a) Each oligodendrocyte process forms a segment of myelin around a different axon in the central nervous system. Two myelin segments are represented, one partially unrolled, the other completely unrolled. (b) Maturation of oligodendrocytes grown on axons of dorsal root ganglionic (DRG) neurons in culture. DRG axons are immunostained for neurofilament (red), and cell nuclei are labeled with DAPI (blue). Upper part: oligodendrocyte progenitor cells (revealed by NG2 labeling in green) plated onto DRG axons (red) after 2 days in co-culture. They extend many processes which contact multiple axons. Lower part: after 7 days in co-culture, oligodendrocyte precursor cells have differentiated into myelinating oligodendrocytes which form multiple segments of compact myelin associated with the axons (myelin is shown in green by myelin basic protein, a component of the myelin sheath, immunolabeling). Scale bar = 15 μm.
Part (a) drawing by Tom Prentiss. In Morell P, Norton W (1980) La myéline et la sclérose en plaques. Pour la Science 33, with permission. Part (b) from Lee PR, Fields RD. (2009) Regulation of myelin genes implicated in psychiatric disorders by functional activity in axons. Front. Neuroanat. 3, 4, with permission.
Figure 2.5. Myelin sheath of central axons.
(a) Three-dimensional diagram of the myelin sheath of an axon in the central nervous system (CNS). The sheath is formed by a succession of compact rolls of glial processes from different oligodendrocytes. (b) Cross-section through a myelin sheath. The dark lines, or major dense lines, and clear bands (in the middle of which are found the interperiod lines) visible with electron microscopy are accounted for by the manner in which the myelin membrane surrounds the axon, and by the composition of the membrane. The dark lines represent the adhesion of the internal leaflets of the myelin membrane while the interperiod lines represent the adhesion of the external leaflets. The lines are formed by membrane proteins while the clear bands are formed by the lipid bilayer. (c,d) Electron micrographs of myelinated axons in sciatic (c) and optic (d) nerves. Structural details of myelin ensheathment at the paranodal level (longitudinal section, c). Cross-section of myelinated axons (d). Numerous microtubules and mitochondria are present in the axons. The innermost layer of myelin sheath is often non-compacted. MVBs: multivesicular bodies. PNJ: paranodal junction.
Part (a) drawing from Bunge MB, Bunge RP, Ris H (1961) Ultrastructural study of remyelination in an experimental lesion in adult cat spinal cord. J. Biophys. Biochem. Cytol. 10, 67–94, with permission of Rockerfeller University Press. Part (b) drawing by Tom Prentiss. In Morell P, Norton W (1980) La myéline et la sclérose en plaques. Pour la Science 33, with permission. Parts (c,d) from Nave KA (2010) Myelination and the trophic support of long axons. Nat. Rev. Neurosci. 11, 275–283, with permission.
A myelinated segment comprises the length of axon covered by an oligodendrocyte. One oligodendrocyte can form 20–70 myelin segments around different axons (Figure 2.4b). Thus the degeneration or dysfunction of a single oligodendrocyte leads to the disappearance of myelin segments on several different axons.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123970329000029
Pain, Basic Neurobiology of
Anne Louise Oaklander, in Encyclopedia of the Neurological Sciences, 2003
Central Axons of Primary Nociceptive Neurons
These axons are vulnerable to compression at the neural foramen from herniated intravertebral disks, bony osteophytes, or thickened ligaments. Some central axons travel for long distances within the CNS, where they are vulnerable to diseases that affect the spinal cord. Central primary afferent axons are probably more involved in neuropathic pain than is realized because most conditions that affect the peripheral axon (e.g., distal axonopathy) affect the central axon as well. Many discussions of the effects of injury to the peripheral nociceptive axon do not consider the fact that injured primary afferent sensory neurons may be disconnected from their central target by the same disease process that affects the peripheral axon. This central–distal peripheral axonopathy has been demonstrated in autopsy studies of patients with painful diabetic polyneuropathy.
A clinically important feature of nociceptive neuroanatomy is that incoming central afferent axons trifurcate and send collateral axons several segments up and down the spinal cord in Lissauer’s tract. This oft-forgotten fact explains why so many patients with lesions of peripheral nerves or roots also develop pain in adjacent, seemingly uninvolved areas. Also note that some primary afferents enter the spinal cord through the ventral, rather than dorsal, roots.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0122268709018268