Нервная ткань — основная ткань, формирующая нервную систему и создающая условия для реализации ее многочисленных функций. Нервная ткань имеет эктодермальное происхождение, не принято делить нервную ткань на какие-либо виды тканей. Обладает двумя основными свойствами: возбудимостью и проводимостью.
Нейрон
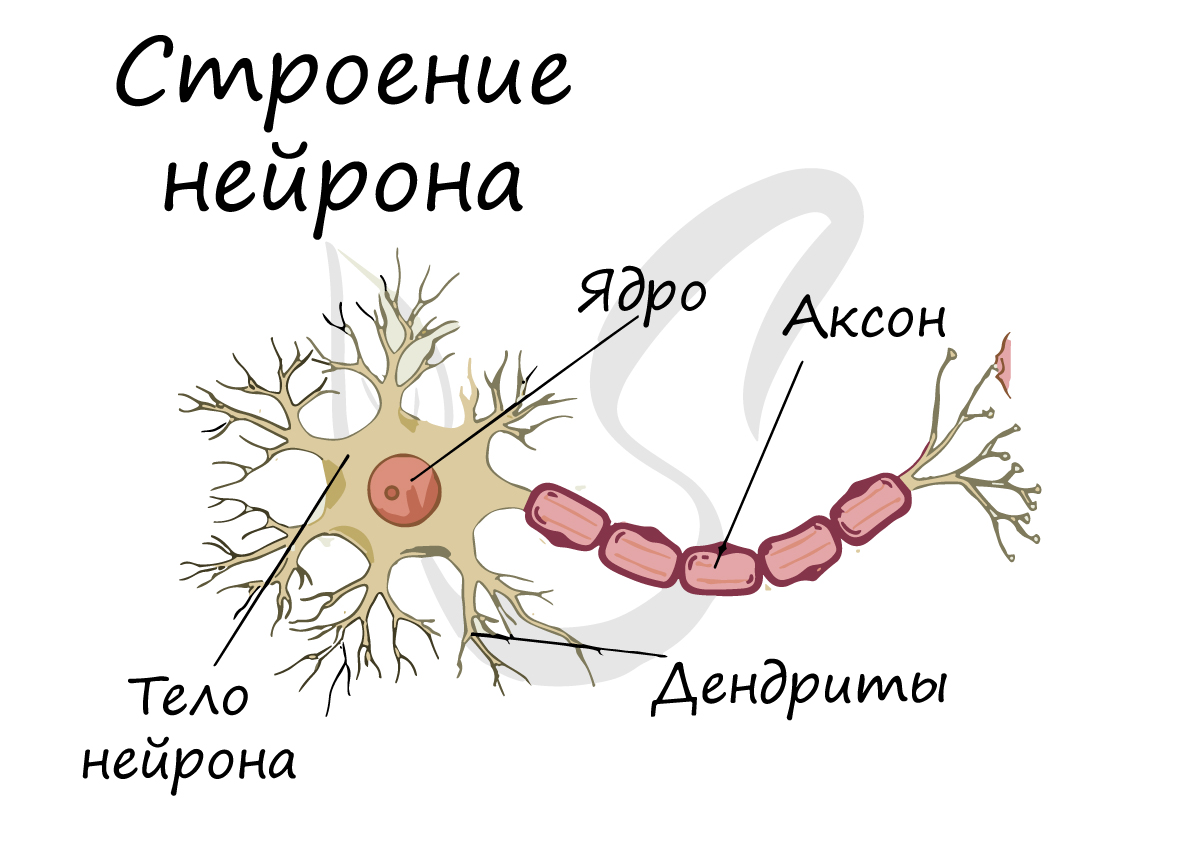
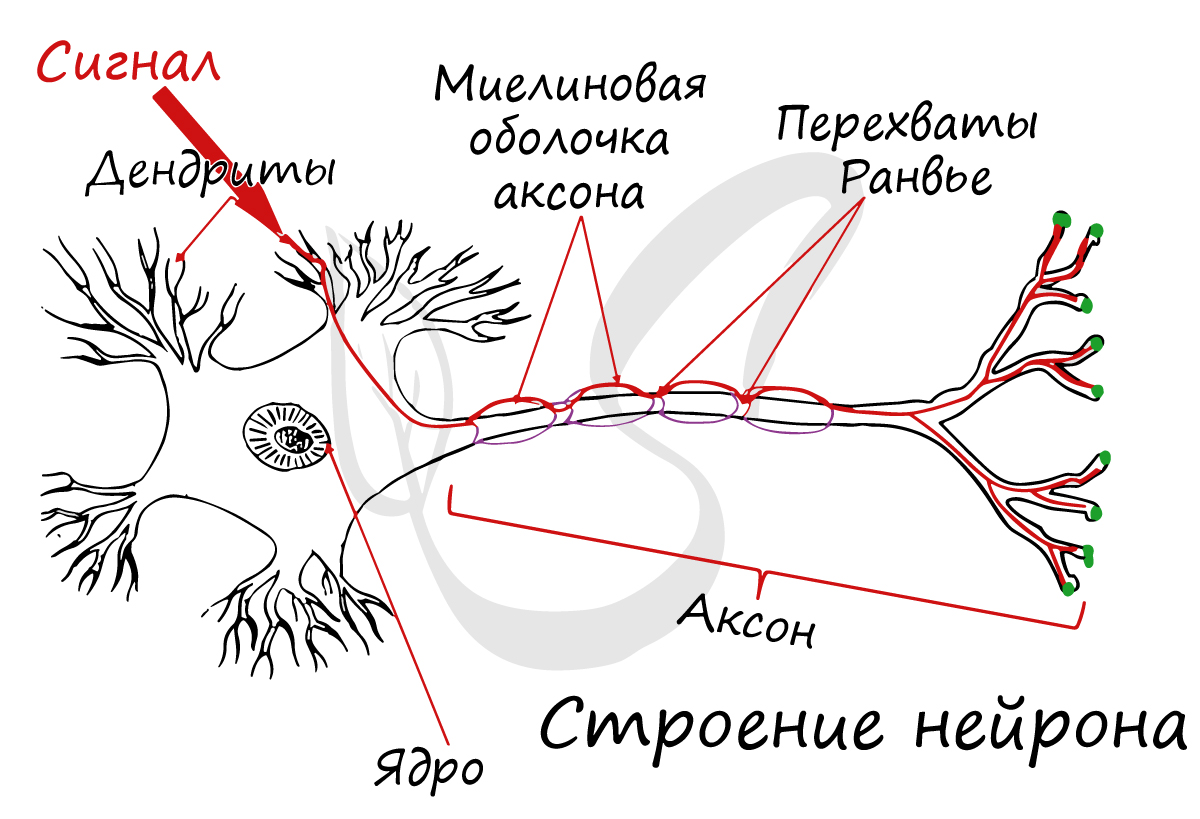
Структурно-функциональной единицей нервной ткани является нейрон (от др.-греч. νεῦρον — волокно, нерв) — клетка с одним
длинным отростком — аксоном (греч. axis — ось), и одним/несколькими короткими — дендритами (греч. dendros — дерево).
Спешу сообщить, что представление, будто короткий отросток нейрона — всегда дендрит, а длинный — всегда аксон, в корне неверно. С точки
зрения физиологии правильнее дать следующие определения: дендрит — отросток нейрона, по которому нервный импульс перемещается к телу нейрона, аксон — отросток нейрона, по которому импульс перемещается от тела нейрона.
Нейроны обладают 4 свойствами:
- Рецепция (лат. receptio — принятие) — способны воспринимать поступающие сигналы (дендриты)
- В ответ на сигналы способны переходить в состояние возбуждения или торможения
- Проведение возбуждения (от дендрита к телу нейрона, затем — к концу аксона)
- Передача сигнала другим объектам — нейрону или эффекторному органу
В физиологии эффекторным (от лат. efferes — выносящий) органом часто называют исполнительный орган или орган-мишень воздействия (мышцы, железы). Орган-эффектор выполняет те или иные «приказы» ЦНС (центральной нервной системы) или эндокринных желёз
Отростки нейронов проводят нервные импульсы и передают их другим нейронам, эффекторам, благодаря чему
мышцы сокращаются или расслабляются, а секреция желез усиливается или уменьшается.
Миелиновая оболочка
Нервные волокна подразделяются на миелиновые и безмиелиновые. Нервное волокно — это один или несколько отростков нейронов (могут быть как аксоны, так и дендриты) с окружающей оболочкой.
Безмиелиновые нервные волокна находятся преимущественно в составе вегетативной нервной системы (скорость проведения 1-2 м/c). Миелиновые — образуют белое вещество головного и спинного мозга, нервные волокна соматической нервной системы (5-120 м/с).
В миелиновых нервных волокнах отростки нейронов покрыты миелиновой оболочкой (на 70-75% состоит из липидов (жиров)), которая обеспечивает изолированное проведение нервного
импульса по нерву. Если бы не было миелиновой оболочки (вообразите!) нервные импульсы распространялись бы хаотично, и,
когда мы хотели сделать движение рукой, то вместе с рукой двигалась бы нога.
Существует болезнь при которой собственные антитела уничтожают миелиновую оболочку нервных волокон головного и спинного мозга (случаются и такие сбои в работе организма). Эта
болезнь — рассеянный склероз, по мере прогрессирования приводит к разрушению не только миелиновой оболочки, но и нервов — а значит,
происходит атрофия мышц и человек постепенно становится обездвиженным.

Миелиновый слой представлен несколькими слоями мембраны глиальной клетки (леммоцит, шванновская клетка), которые закручиваются вокруг осевого цилиндра (отростка нейрона). Это закручивание хорошо видно на картинке, где изображен здоровый нерв, чуть выше 
Миелиновый слой оболочки волокна регулярно прерывается в местах стыка соседних леммоцитов — перехваты Ранвье. Миелиновая оболочка обеспечивает изолированное и более быстрое проведение возбуждения (сальтаторный тип, лат. salto — скачу, прыгаю).

Нейроглия (греч. νεῦρον — волокно, нерв + γλία — клей)
Вы уже убедились, насколько значимы нейроны, их высокая специализация приводит к возникновению особого окружения — нейроглии.
Нейроглия (глиальные клетки, глиоциты) — вспомогательная часть нервной системы, которая выполняет ряд важных функций:
- Опорная — поддерживает нейроны в определенном положении
- Регенераторная (лат. regeneratio — возрождение) — в случае повреждения нервных структур нейроглия способствует регенерации
- Трофическая (греч. trophe — питание) — с помощью нейроглии осуществляется питание нейронов: напрямую с кровью нейроны не контактируют
- Электроизоляционная — леммоциты (шванновские клетки) закручиваются вокруг отростков нейронов и формируют миелиновую оболочку
- Барьерная и защитная — изолируют нейроны от тканей внутренней среды организма
- Некоторые глиоциты секретируют цереброспинальную (спинномозговую) жидкость — ликвор (от лат. liquor — жидкость)
В состав нейроглии входят разные клетки, их в десятки раз больше чем самих нейронов. В периферическом отделе нервной
системы миелиновая оболочка, изученная нами, образуется именно из нейроглии — шванновских клеток (леммоцитов). Между ними хорошо
заметны перехваты Ранвье — участки, лишенные миелиновой оболочки, между двумя смежными шванновскими клетками.
Классификация нейронов
Нейроны функционально подразделяются на чувствительные, двигательные и вставочные.
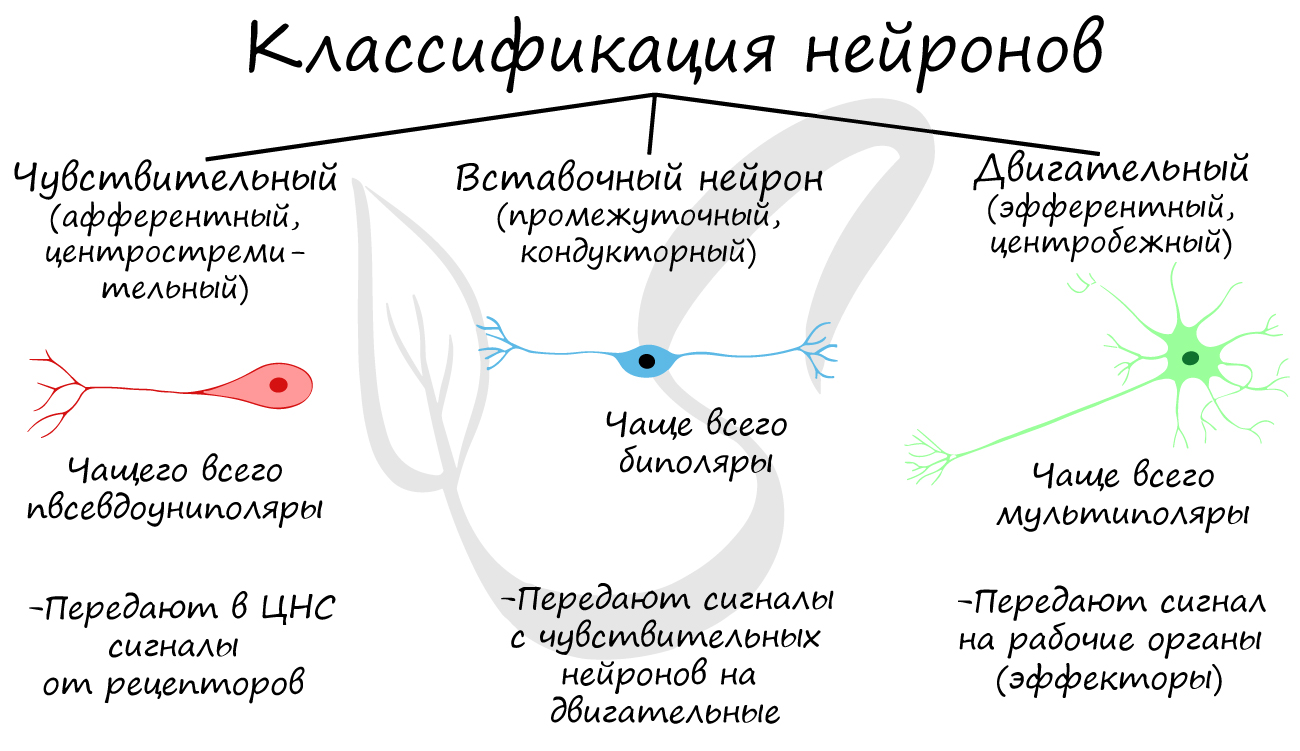
Чувствительные нейроны также называются афферентные, центростремительные, сенсорные, воспринимающие — они воспринимают раздражения, преобразуют их в нервные импульсы и передают в ЦНС. Рецептором называют концевое окончание чувствительных нервных
волокон, воспринимающих раздражитель.
Вставочные нейроны также называются промежуточные, ассоциативные — они обеспечивают связь между чувствительными и двигательными
нейронами, передают возбуждение в различные отделы ЦНС, участвуют в обработке информации и выработке команд.
Двигательные нейроны по-другому называются эфферентные, центробежные, мотонейроны — они передают нервный импульс (возбуждение) на
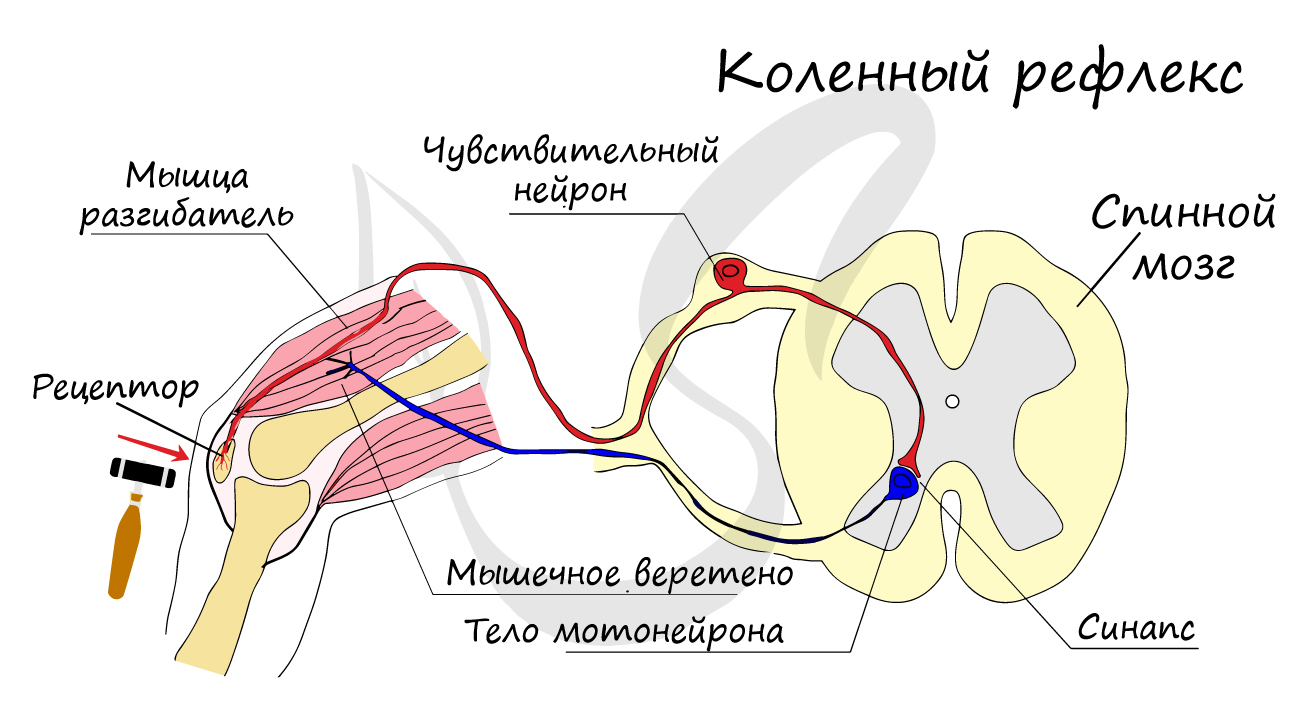
эффектор (рабочий орган). Наиболее простой пример взаимодействия нейронов — коленный рефлекс (однако вставочного нейрона
на данной схеме нет). Более подробно рефлекторные дуги и их виды мы изучим в разделе, посвященном нервной системе.
Синапс
На схеме выше вы наверняка заметили новый термин — синапс (греч. sýnapsis — соединение). Синапсом называют место контакта между двумя нейронами или между
нейроном и эффектором (органом-мишенью). В синапсе нервный импульс «преобразуется» в химический: происходит выброс особых
веществ — нейромедиаторов (наиболее известный — ацетилхолин) в синаптическую щель.
Разберем строение синапса на схеме. Его составляют пресинаптическая мембрана аксона, рядом с которой расположены везикулы (лат. vesicula — пузырек) с
нейромедиатором внутри (ацетилхолином). Если нервный импульс достигает терминали (окончания) аксона, то везикулы начинают
сливаться с пресинаптической мембраной: ацетилхолин поступает наружу, в синаптическую щель.
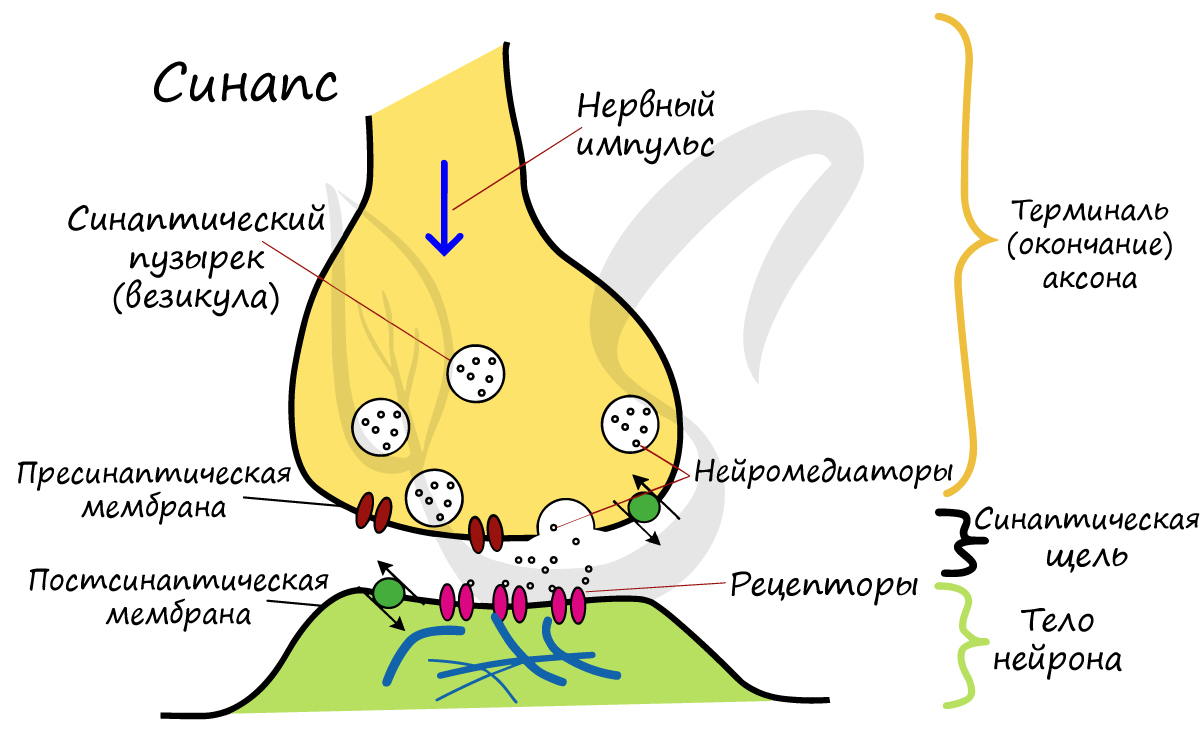
Попав в синаптическую щель, ацетилхолин связывается с рецепторами на постсинаптической мембране, таким образом, возбуждение (нервный импульс)
передается другому нейрону. Так устроена нервная система: электрический путь передачи сменяется
химическим (в синапсе).
Яд кураре
Гораздо интереснее изучать любой предмет на примерах, поэтому я постараюсь как можно чаще радовать вас ими 
историю о яде кураре, который используют индейцы для охоты с древних времен.
Этот яд блокирует ацетилхолиновые рецепторы на постсинаптической мембране, и, как следствие, химическая передача возбуждения с
одного нейрона на другой становится невозможна. Это приводит к тому, что нервные импульсы перестают поступать к эффекторам,
в том числе к дыхательным мышцам (межреберным, диафрагме), вследствие чего дыхание останавливается и наступает смерть животного.

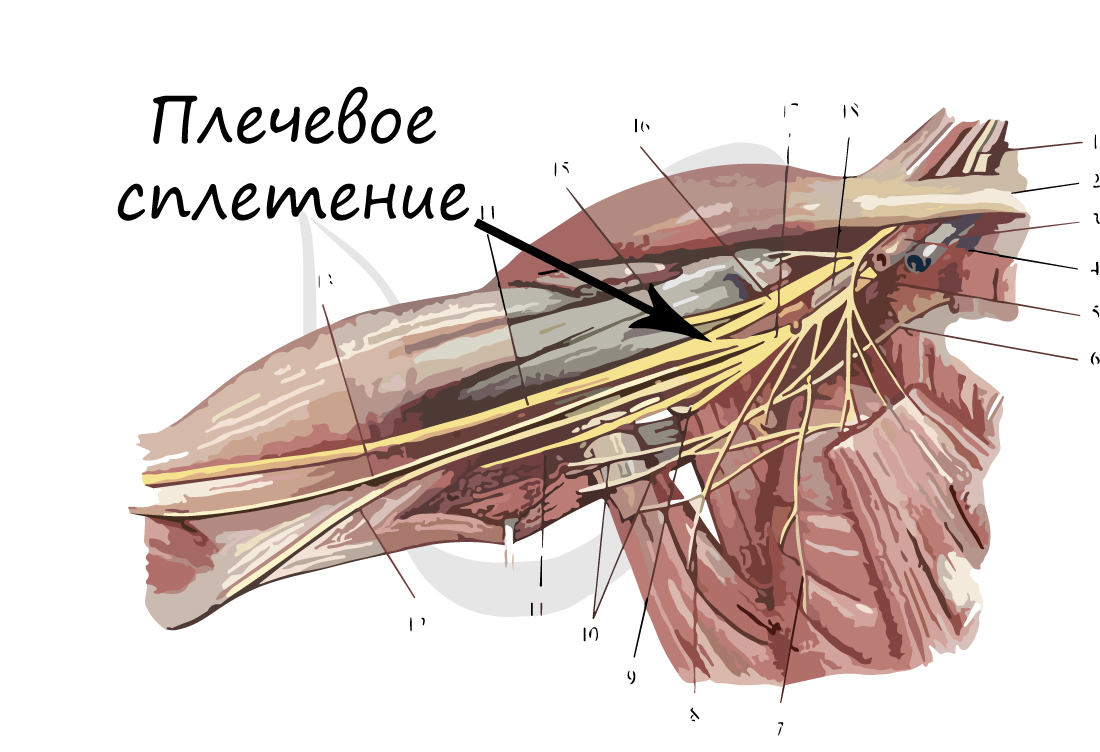
Нервы и нервные узлы
Собираясь вместе, отростки нейронов (нервные волокна) образуют пучки нервных волокон. Нервные пучки объединяются в нервы, которые покрыты соединительнотканной оболочкой.
В случае, если тела нейронов концентрируются в одном месте за пределами центральной нервной системы, их скопления
называют нервным узлом — или ганглием (от др.-греч. γάγγλιον — узел).
В случае сложных соединений между нервными волокнами говорят о нервных сплетениях. Одно из наиболее известных —
плечевое сплетение.
Болезни нервной системы
Неврологические болезни могут развиваться в любой точке нервной системы: от этого будет зависеть клиническая картина. В случае повреждения
чувствительного пути пациент перестает чувствовать боль, холод, тепло и другие раздражители в зоне иннервации пораженного нерва, при этом
движения сохранены в полном объеме.
Если повреждено двигательное звено, движение в пораженной конечности будет
невозможно: возникает паралич, но чувствительность может сохраняться.
Существует тяжелое мышечное заболеванием — миастения (от др.-греч. μῦς — «мышца» и ἀσθένεια — «бессилие, слабость»), при
котором собственные антитела разрушают мотонейроны (двигательные нейроны).

Постепенно любые движения мышцами становятся для пациента все труднее,
становится тяжело долго говорить, повышается утомляемость. Наблюдается характерный симптом — опущение верхнего века.
Болезнь может привести к слабости диафрагмы и дыхательных мышц, вследствие чего дыхание становится невозможным.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
В последнее десятилетие ХХ века в науке о запахах произошла подлинная революция. Решающую роль сыграло открытие 1000 видов обонятельных рецепторов, связывающих молекулы пахучих веществ. Однако механизм передачи обонятельного сигнала в центральную нервную систему таит в себе еще много загадок.
Наука и жизнь // Иллюстрации
Пути передачи информации о запахах в головной мозг.
Схематическое изображение обонятельного эпителия. Базальные клетки являются клетками-предшественниками обонятельных рецепторных нейронов.
Изображение реснички обонятельного нейрона, сделанное с помощью флуоресцентного красителя. На мембране ресничек расположены рецепторные белки, взаимодействующие с молекулами одорантов.
Модель молекулы обонятельного рецепторного белка мыши, к которому присоединена молекула одоранта — гексанола (пурпурного цвета).
Одна из моделей процесса преобразования сигнала внутри реснички обонятельного нейрона.
Схематическое изображение комбинаторных рецепторных кодов одорантов.
Электроольфактограмма (ЭОГ) — электрический колебательный сигнал, регистрируемый специальным электродом с участка внешней поверхности обонятельного эпителия крысы.
‹
›
Чуть более четверти века назад в журнале «Наука и жизнь» (№ 1, 1978 г.) была опубликована статья «Загадка запаха». Ее автор, кандидат химических наук Г. Шульпин, справедливо отмечал, что современное ему состояние науки о запахах примерно такое же, как состояние органической химии в 1835 году. Тогда один из зачинателей этой науки, Ф. Велер, писал, что органическая химия представляется ему дремучим лесом, из которого невозможно выбраться. Но уже через четверть века А. М. Бутлеров, создав теорию химического строения вещества, сумел «выбраться из чащи». Шульпин выражал уверенность, что загадка запаха будет решена едва ли не быстрее, чем в случае органической химии.
И он оказался прав на все 100%! В последнее время произошел настоящий прорыв в понимании молекулярных основ обоняния. Разберем основные стадии восприятия запахов в свете современных представлений.
КАК ВОСПРИНИМАЕТСЯ ЗАПАХ
Проделаем простой опыт. Возьмем флакон с пахучей жидкостью, например духами, откроем пробку и понюхаем содержимое в спокойном ритме дыхания. Легко обнаружить, что мы ощущаем запах только во время вдоха; начинается выдох — запах исчезает.
При вдохе через нос воздух вместе с молекулами пахучего вещества (называемого обонятельным стимулом или одорантом) проходит в каждой из двух носовых полостей по щелевидному каналу сложной конфигурации, который образован продольной носовой перегородкой и тремя носовыми раковинами. Здесь воздух очищается от пыли, увлажняется и нагревается. Затем часть воздуха поступает в расположенную в верхней задней зоне канала обонятельную область, имеющую вид щели, покрытой обонятельным эпителием.
Общая поверхность, занимаемая эпителием в обеих половинках носа взрослого человека, невелика — 2 — 4 см2 (у кролика эта величина равна 7-10 см2, у собак — 27 — 200 см2). Эпителий покрыт слоем обонятельной слизи и содержит три типа первичных клеток: обонятельные рецепторы, опорные и базальные клетки. Влекомые воздухом пахучие молекулы проникают в носовую полость и переносятся над поверхностью эпителия. При нормальном спокойном дыхании вблизи обонятельного эпителия проходит 7 -10% вдыхаемого воздуха. Обонятельный эпителий имеет толщину приблизительно 150-300 мкм. Он покрыт слоем слизи (10-50 мкм), который молекулам одоранта предстоит преодолеть, прежде чем они провзаимодействуют со специальными сенсорными нейронами — обонятельными рецепторами.
Основная функция обонятельного рецептора состоит в выделении, кодировании и передаче информации об интенсивности, качестве и продолжительности запаха в обонятельную луковицу и специальным центрам в головном мозге. Эпителий в обеих носовых полостях у человека содержит приблизительно 10 млн обонятельных нейронов ( у кролика — около 100 млн, а у немецкой овчарки — до 225 млн).
Как известно, нейрон состоит из тела и отростков: аксонов и дендритов. Нервный импульс с одной нервной клетки на другую передается с аксона на дендрит. Диаметр утолщенной центральной части обонятельного нейрона (сомы) 5-10 мкм. Дендритная часть в виде волокнистых отростков диаметром 1-2 мкм выходит к внешней поверхности эпителия. Здесь дендриты заканчиваются утолщением, от которого отходит пучок из 6-12 ресничек (цилий) диаметром 0,2-0,3 мкм и длиной до 200 мкм, погруженный внутрь слоя слизи (у кролика число ресничек в одном рецепторном нейроне составляет 30-60, а у собак достигает 100-150). Отходящее от сомы нервное волокно (аксон) имеет диаметр около 0,2 мкм и выходит к внутренней поверхности эпителия. Здесь аксоны от соседних нейронов объединяются в жгуты (филы), доходящие до обонятельной луковицы.
СЕМИОТИКА ОБОНЯНИЯ
Для того чтобы обонятельный сигнал был воспринят нейроном, молекула одоранта связывается со специальной белковой структурой, расположен ной в нейрональной клеточной мембране. Такая структура называется рецепторным белком. Используя методы молекулярной биологии, американские ученые Линда Бак и Ричард Аксель в 1991 году установили, что обонятельные нейроны у млекопитающих содержат около 1000 различных видов рецепторных белков (у человека их меньше — около 350). Признанием важности этого открытия стало присуждение им в 2004 году Нобелевской премии за исследования в области физиологии и медицины (см. «Наука и жизнь» № 12, 2004 г).
Каким образом рецепторы распределяются по нейронам: имеются ли отдельные представители этого семейства во всех обонятельных нейронах или каждый нейрон несет на своей мембране только один вид рецепторного белка? Как может мозг определить, какой из 1000 типов рецепторов подал сигнал? Имеющиеся данные позволяют сделать заключение о том, что на одном нейроне присутствует только обонятельный рецепторный белок одного вида. Нейроны с разными рецепторами обладают различной функциональностью, то есть в эпителии имеются тысячи различных типов нейронов. В этом случае проблема идентификации активированного запахом отдельного рецептора сводится к задаче выявления подавшего сигнал нейрона.
Принимая во внимание, что общее число обонятельных нейронов у человека около 10 млн, число обонятельных рецепторов одного типа исчисляется в среднем десятками тысяч.
Обонятельная система использует комбинаторную схему для идентификации одорантов и кодирования сигнала. Согласно ей один тип обонятельных рецепторов активируется множеством одорантов и один одорант активирует множество типов рецепторов. Различные одоранты кодируются различными комбинациями обонятельных рецепторов, причем увеличение концентрации стимула приводит к возрастанию числа активируемых рецепторов и к усложнению его рецепторного кода. В этой схеме каждый рецептор выступает в качестве одного из компонентов комбинаторного рецепторного кода для многих одорантов и как бы выполняет роль буквы своеобразного алфавита, из совокупности которых составляются соответствующие слова-запахи.
Минимальные структурные отличия молекул одорантов, например, по функциональной группе, по длине углеродной цепи, по пространственной структуре приводят к различному рецепторному коду. Для отличительного признака молекулы одоранта, способного изменить кодировку запаха, был предложен термин «одотоп» (odotope), или детерминант запаха. Различные обонятельные рецепторы, которые распознают один и тот же одорант, могут идентифицировать различные его признаки-одотопы. Одиночный обонятельный рецептор способен «различать» молекулы, отличающиеся длиной углеродной цепочки всего лишь на один атом углерода, или молекулы, имеющие одинаковую длину углеродной цепочки, но отличающиеся функциональной группой. Учитывая, что в эпителии млекопитающих имеется приблизительно 1000 видов обонятельных рецепторов, можно полагать, что такая комбинаторная схема позволяет различить громадное число одорантов (даже человек различает до 10 000 запахов).
Полученные в последнее время результаты экспериментальных исследований свойств обонятельных рецепторных белков позволили создать на молекулярном уровне структурную модель спиральной молекулы обонятельного белка. Обонятельные рецепторные белки принадлежат к суперсемейству мембранносвязанных рецепторов. Они пересекают двухслойную липидную мембрану реснички семь раз. У содержащей 300-350 аминокислот молекулы рецепторного белка три наружные петли соединяются с тремя внутриклеточными петлями семью пересекающими мембрану трансмембранными участками.
НЕОБХОДИМАЯ СЛИЗЬ
Находящиеся в потоке воздуха молекулы одоранта, перед тем как достичь обонятельных рецепторных нейронов, должны пересечь обволакива ющий поверхность обонятельного эпителия слой слизи. Физиологические функции слоя слизи полностью до сих пор не выяснены. Не вызывает сомнения, что она создает гидрофильную оболочку для чувствительных и хрупких обонятельных рецепторов, выполняя защитную функцию. Ведь систему восприятия сигнала нужно защитить от воздействия внешней среды, то есть от молекул одорантов, среди которых могут быть достаточно опасные и химически активные вещества.
Слой слизи состоит из двух подслоев. Внешний, водный, имеет толщину примерно 5 мкм, а внутренний, более вязкий, — около 30 мкм. Реснички-цилии направлены наклонно к внешней поверхности слоя слизи. Они образуют своего рода сетку с нерегулярными ячейками, причем эта сетка размещена у поверхности раздела подслоев так, что основная часть поверхности ресничек (около 85%) оказывается расположен ной вблизи границы раздела.
Слой слизи содержит разнообразные растворимые в воде белки, значительную часть которых составляют так называемые гликопротеины. Благодаря разветвленной молекулярной структуре эти белки способны связывать и удерживать молекулы воды, образуя гель.
Другие виды белков, содержащихся в слизи, взаимодействуют с молекулами одорантов и тем самым могут оказывать влияние на восприятие и распознавание запахов. Эти белки подразделяются на два основных класса — одорант-связующие белки (OBP) и одорант-разрушающие ферменты.
ОВР относятся к семейству белков, имеющих складчатую бочкообразную структуру с внутренней глубокой полостью, в которую попадают маленькие молекулы гидрофильных (жирорастворимых) одорантов. Разные подвиды этих белков отличаются высокой избирательностью взаимодействия с одорантами различных химических классов.
Полагают, что OBP способствуют растворению одоранта и транспортируют его молекулы сквозь слой слизи, действуют как фильтр для разделения одорантов, могут облегчать связывание одоранта с рецепторным белком и даже очищать околорецепторное пространство от ненужных компонентов.
Кроме одорант-связующих белков в слизи обонятельного эпителия вблизи рецепторных нейронов обнаружены несколько видов одорант-разрушающих ферментов. Все эти ферменты запускают реакции превращения молекул одорантов в другие соединения. Образующиеся в результате этих реакций продукты также вносят свой вклад в восприятие запаха. В конечном итоге все поступающие в слой слизи молекулы одорантов быстро, практически одновременно с завершением вдоха, теряют свою «запаховую» активность. Так что обонятельная система при каждом вдохе получает новую информацию от свежих порций одоранта.
ОБОНЯНИЕ НА УРОВНЕ МОЛЕКУЛ
Многие свойства системы восприятия запахов можно объяснить на молекулярном уровне. Молекула одоранта встречает на поверхности слизи, покрывающей обонятельный эпителий, молекулу одорант-связующего белка, которая связывает и переносит молекулу одоранта через слой слизи к поверхности реснички обонятельного нейрона. В ресничках осуществляется основной процесс передачи обонятельного сигнала. Его механизм достаточно типичен для многих видов взаимодействий физиологически активных веществ с рецепторами нервных клеток.
Молекула одоранта прикрепляется к определенному обонятельному рецептору (R). Между
процессом связывания молекулы одоранта с рецептором и передачей обонятельного
сигнала в нервную систему лежит сложный каскад биохимических реакций, проходящих
в нейроне. Связывание молекулы одоранта с рецепторным белком активирует так называемый
G-белок, расположенный на внутренней стороне клеточной мембраны. G-белок в свою
очередь активирует аденилатциклазу (AC) — фермент, преобразующий внутриклеточный
аденозинтрифосфат (ATP) в циклический аденозинмонофосфат (cAMP). А уже cAMP активирует
другой мембранносвязанный белок, который называется ионным каналом, поскольку
открывает и закрывает вход заряженным частицам внутрь клетки. Когда ионный канал
открыт, в клетку проникают катионы металлов. Таким способом меняется электрический
потенциал клеточной мембраны и генерируется электрический импульс, передающий
сигнал с одного нейрона на другой.
Несколько молекулярных стадий передачи внутриклеточного сигнала обеспечивают его усиление, в результате чего небольшого числа молекул одоранта становится достаточно для генерирования нейроном электрического импульса. Такие усилительные каскады обеспечивают большую чувствительность системы восприятия запахов.
Итак, активация рецепторного белка молекулой одоранта в конечном счете приводит к генерированию электрического тока в обонятельном рецепторном нейроне. Ток распространяется по дендриту нейрона в его соматическую часть, где возбуждает выходной электрический импульс. Этот импульс передается по нейрональному аксону в обонятельную луковицу.
Одиночный электрический сигнал-импульс на выходе имеет длительность не более 5 мс и пиковую амплитуду около 100 мкВ. Почти все нейроны генерируют импульсы и при отсутствии воздействия одоранта, то есть обладают спонтанной активностью, называемой биологическим шумом. Частота этих импульсов меняется в диапазоне от 0,07 до 1,8 импульса в секунду.
ЛУКОВИЧНАЯ НЕЙРОСЕТЬ
Обонятельные рецепторные нейроны распознают громадное число разнообразных молекул пахучих веществ и посылают информацию о них через аксоны в обонятельную луковицу, служащую первым центром обработки обонятельной информации в головном мозге. Парные обонятельные луковицы представляют собой продолговатые образования «на ножках». Отсюда начинается путь обонятельного сигнала к полушариям мозга. Аксоны обонятельных нейронов оканчиваются в обонятельной луковице разветвлениями в сферических концентраторах (диаметром 100-200 мкм), называемых гломерулами. В гломерулах осуществляется контакт между окончаниями аксонов обонятельных нейронов и дендритами нейронов второго порядка, которыми являются митральные и пучковые клетки.
Митральные клетки — самые крупные нервные клетки, выходящие из обонятельной луковицы. Пучковые клетки меньше митральных, но функционально с ними схожи. Представление о количестве нервных клеток у млекопитающих могут дать характеристики обонятельной системы кролика. В ней имеется по 50 миллионов обонятельных рецепторных нейронов справа и слева (ровно в десять раз больше, чем у человека). Аксоны обонятельных рецепторов распределены между 1900 гломерулами обонятельной луковицы — примерно по 26 000 аксонов на гломерулу. Дендритные окончания 45 000 митральных и 130 000 пучковых клеток получают сигналы от аксонов в гломерулах и передают их из обонятельной луковицы в центры обоняния в головном мозге. Около 24 митральных и 70 пучковых клеток получают информацию от аксонов в каждой гломеруле. У человека около 10 млн аксонов обонятельных нейронов распределяются по 2000 гломерул обонятельной луковицы.
Все аксоны одной популяции обонятельных нейронов сходятся на две гломерулы, зеркально расположенные по разные стороны двумерного поверхностного слоя обонятельной луковицы. В зависимости от содержания передаваемого сигнала гломерулы активируются различным образом. Совокупность активированных гломерул называется картой запаха и представляет своего рода «слепок» запаха, то есть она показывает, из каких пахучих веществ состоит воспринимаемый обонятельный объект.
Механизм активации гломерул до сих пор не выяснен. Усилия исследователей направлены на то, чтобы выяснить, каким образом многообразие одорантов воспроизводится в двумерном слое гломерул на поверхности обонятельной луковицы. Кстати, эти отображения имеют динамический характер — они постоянно меняются в ходе восприятия запаха, усложняя научную задачу.
Обонятельная луковица — это большая многослойная нейросеть для пространственно-временнoй обработки отображения запаха в гломерулах. Ее можно рассматривать как совокупность множества микросхем с большим количеством связей, со взаимной активацией и ингибированием активности нейронов. Выполняемые нейронами операции выделяют характерные свойства карты запаха.
От обонятельной луковицы аксоны митральных и пучковых клеток передают информацию в первичные обонятельные участки коры головного мозга, а затем в высшие ее участки, где формируется осознанное ощущение запаха, и в лимбическую систему, которая порождает эмоциональную и мотивационную реакцию на обонятельный сигнал.
Свойства обонятельных зон коры головного мозга позволяют формировать ассоциативную память, которая устанавливает связь нового аромата с отпечатками воспринятых ранее обонятельных стимулов. Полагают, что процесс идентификации одоранта включает сравнение получающегося отображения с его описанием в семантической памяти. В случае совпадения отпечатка и памяти о запахе происходит какой-либо ответ (эмоциональный, двигательный) организма. Процесс этот осуществляется очень быстро, в течение секунды, и информация о совпадении после ответа сразу сбрасывается, поскольку мозг готовит себя к решению следующей задачи восприятия запаха.
ЗАГАДКИ ЗАПАХОВ
То, о чем говорилось в предыдущих разделах, относится пусть к самому сложному,
основополагающему, но начальному разделу науки о запахах — к их восприятию. Не
раскрыт механизм взаимодействия обоняния с другими системами восприятия, например
со вкусом (см. «Наука и жизнь» № 8, 2003 г., с. 16-20). Ведь известно, что если
человеку зажать ноздри, то при дегустации даже хорошо известных вкусовых пищевых
продуктов (например — кофе) он не в состоянии точно определить, что он пробовал.
Достаточно разжать ноздри — и вкусовые ощущения восстанавливаются.
С молекулярной точки зрения пока непонятно, в каких единицах измерять интенсивность запаха и от чего она зависит, что такое качество запаха, его «букет», чем отличается один запах от другого и как охарактеризовать это отличие, что происходит с запахом при смешивании различных одорантов. Оказывается, что независимо от вида одорантов и уровня подготовленности даже опытный эксперт не может определить все составляющие смесь компоненты, если их больше трех. Если же смесь содержит более десяти одорантов, то человек не в состоянии идентифицировать ни одного из них.
Остается еще множество вопросов, касающихся механизмов и видов воздействия запахов на эмоциональное, психическое и физическое состояния человека. В последнее время на эту тему появилось немало спекуляций, чему поспособствовал вышедший в 1985 году роман П. Зюскинда «Парфюмер», более восьми лет прочно занимавший место в первой десятке бестселлеров на западном книжном рынке. Фантазии на тему чрезвычайной силы подсознательного воздействия ароматов на эмоциональное состояние человека обеспечили этому произведению огромный успех.
Однако художественный вымысел постепенно получает обоснование. Недавно в периодической печати появились сообщения о том, что американские военные «парфюмеры» разработали на редкость дурно пахнущую бомбу, способную не только вызвать отвращение, но и разогнать солдат противника или агрессивно настроенную толпу.
Общественные аллюзии на парфюмерные темы подстегнули всеобщий интерес к искусству ароматерапии. Расширилось использование ароматов в общественных местах, таких, как офисы, торговые залы, холлы гостиниц. Появились даже специальным образом ароматизированные товары, улучшающие настроение. Возникла такая отрасль рыночной экономики, как аромамаркетинг — «наука» о привлечении клиентов с помощью приятных запахов. Так, запах кожи навевает покупателю мысли о дорогом качественном товаре, аромат кофе побуждает к покупкам для домашнего ужина и т.д. Каким образом запахи формируют в головном мозге сигналы, побуждающие человека совершать покупки? Ученым предстоит совершить еще немало открытий, прежде чем ответить на этот и многие другие вопросы и отделить мифы о запахах от реальности.
Литература
Лозовская Е., канд. физ.-мат. наук. Штрих-код запаха // Наука и жизнь, 2004, № 12.
Майоров В. А. Запахи: их восприятие, воздействие, устранение. — М.: Мир, 2006.
Марголина А., канд. биол. наук. Сладкая власть феромонов // Наука и жизнь, 2005, № 7.
Шульпин Г., канд. хим. наук. Загадка запаха // Наука и жизнь, 1978, № 1.
Статья на конкурс «био/мол/текст»: Клеточные процессы, обеспечивающие обмен информацией между нейронами, требуют много энергии. Высокое энергопотребление способствовало в ходе эволюции отбору наиболее эффективных механизмов кодирования и передачи информации. В этой статье вы узнаете о теоретическом подходе к изучению энергетики мозга, о его роли в исследованиях патологий, о том, какие нейроны более продвинуты, почему синапсам иногда выгодно не «срабатывать», а также, как они отбирают только нужную нейрону информацию.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (~10 имп./с) и быстрые (~40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (~4—9 имп./с) в несколько раз больше, чем быстрых ингибиторных интернейронов (>100 имп./с) [8], [9]. Так, видимо, мозг «предпочитает» использовать поменьше быстрых и энергозатратных нейронов, чтобы те не израсходовали все ресурсы [6], [9–11].
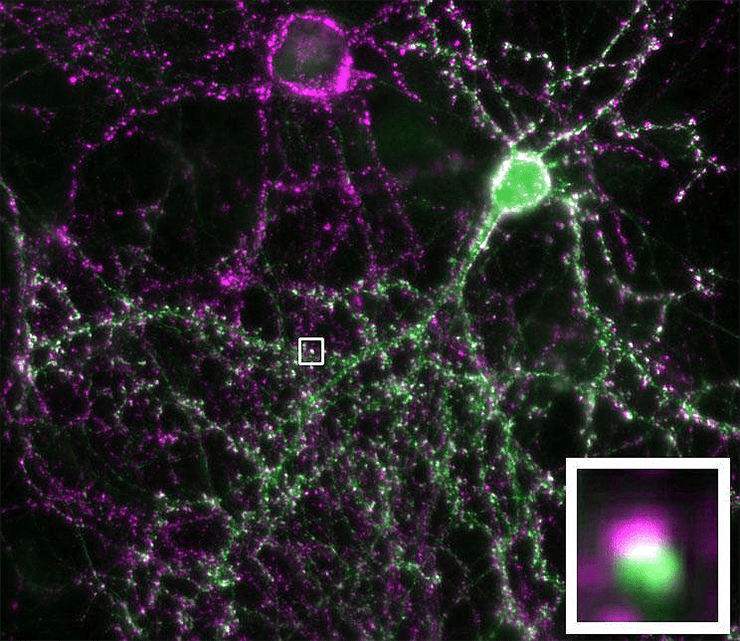
Рисунок 1. Представлены два нейрона. В одном из них фиолетовым цветом окрашен пресинаптический белок синаптофизин. Другой нейрон полностью окрашен зеленым флуоресцентным белком. Мелкие светлые крапинки — синаптические контакты между нейронами [12]. Во вставке одна «крапинка» представлена ближе.
Группы нейронов, связанных между собой синапсами, называются нейронными сетями [13], [14]. Например, в коре больших полушарий пирамидальные нейроны и интернейроны образуют обширные сети. Слаженная «концертная» работа этих клеток обусловливает наши высшие когнитивные и другие способности. Аналогичные сети, только из других типов нейронов, распределены по всему мозгу, определенным образом связаны между собой и организуют работу всего органа.
Работа Леви и Бакстера [6] развивает концепцию «экономии импульсов» Горация Барлоу из Университета Калифорнии (США), который, кстати, является потомком Чарльза Дарвина [17]. Согласно ей, при развитии организма нейроны стремятся работать только с наиболее полезной информацией, фильтруя «лишние» импульсы, ненужную и избыточную информацию. Однако эта концепция не дает удовлетворительных результатов, так как не учитывает метаболические затраты, связанные с нейрональной активностью [6]. Расширенный подход Леви и Бакстера, в котором внимание уделено обоим факторам, оказался более плодотворным [6], [18–20]. И энергозатраты нейронов, и потребность в кодировании только полезной информации являются важными факторами, направляющими эволюцию мозга [6], [21–24]. Поэтому, чтобы лучше разобраться в том, как устроен мозг, стоит рассматривать обе эти характеристики: сколько нейрон передает полезной информации и сколько энергии при этом тратит.
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Как же работает этот подход?
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Эти «оптимальные» значения параметров затем нужно сравнить с измеренными экспериментально и определить, насколько они отличаются. Общая картина отличий укажет на степень оптимизации данного нейрона в целом: насколько реальные, измеренные экспериментально, значения параметров совпадают с рассчитанными. Чем слабее выражены отличия, тем нейрон более близок к оптимуму и работает энергетически более эффективно, оптимально. С другой стороны, сопоставление конкретных параметров покажет, в каком конкретно качестве этот нейрон близок к «идеалу».
Далее, в контексте энергетической эффективности нейронов рассмотрены два процесса, на которых основано кодирование и передача информации в мозге. Это нервный импульс, или потенциал действия, благодаря которому информация может быть отправлена «адресату» на определенное расстояние (от микрометров до полутора метров) и синаптическая передача, лежащая в основе собственно передачи сигнала от одного нейрона на другой.
Потенциал действия
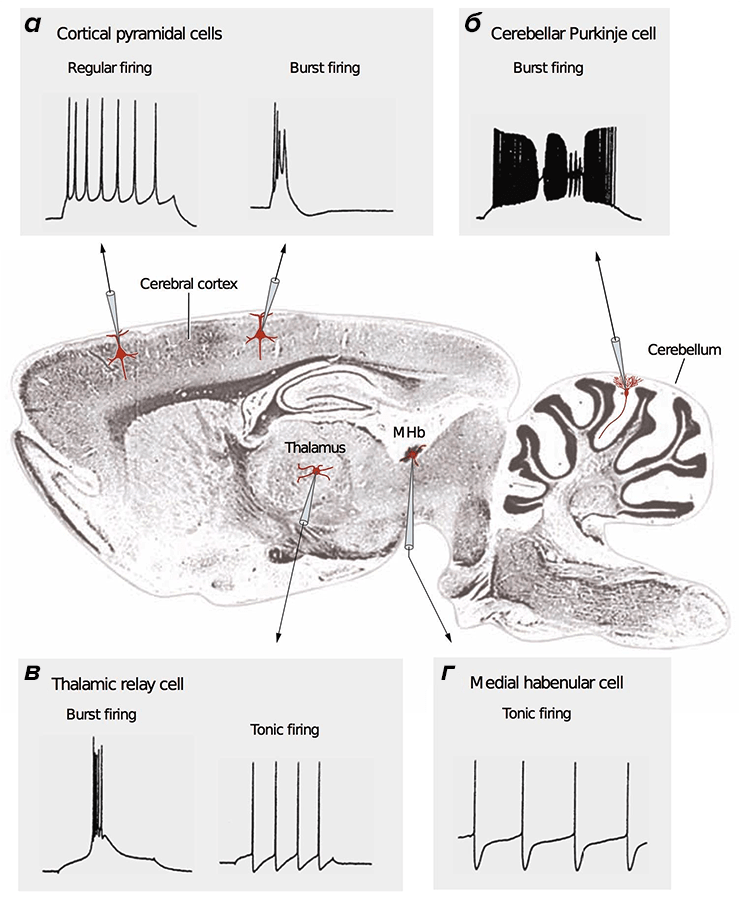
Потенциал действия (ПД) — сигнал, которые отправляют друг другу нейроны. ПД бывают разные: быстрые и медленные, малые и большие [28]. Зачастую они организованы в длинные последовательности (как буквы в слова), либо в короткие высокочастотные «пачки» (рис. 2).
Рисунок 2. Разные типы нейронов генерируют различные сигналы. В центре — продольный срез мозга млекопитающего. Во вставках представлены разные типы сигналов, зарегистрированные методами электрофизиологии [15], [38]. а — Кортикальные (Cerebral cortex) пирамидальные нейроны могут передавать как низкочастотные сигналы (Regular firing), так и короткие взрывные, или пачечные, сигналы (Burst firing). б — Для клеток Пуркинье мозжечка (Cerebellum) характерна только пачечная активность на очень высокой частоте. в — Релейные нейроны таламуса (Thalamus) имеют два режима активности: пачечный и тонический (Tonic firing). г — Нейроны средней части поводка (MHb, Medial habenula) эпиталамуса генерируют тонические сигналы низкой частоты.
[14], рисунок адаптирован
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
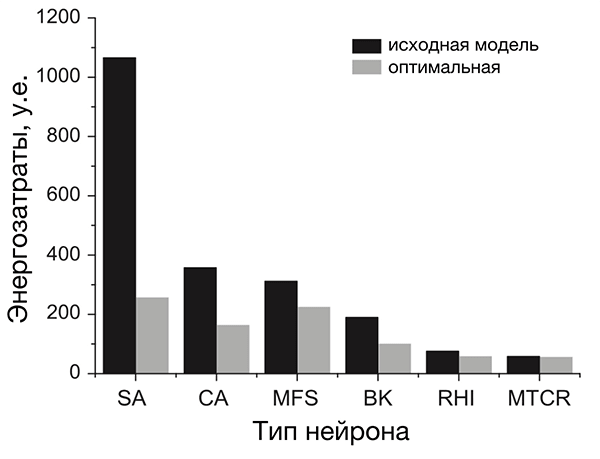
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
[20], рисунок адаптирован
Почему они более эффективны? Потому что у них малó перекрывание Na- и К-токов. Во время генерации ПД всегда есть промежуток времени, когда эти токи присутствуют одновременно (рис. 3в). При этом переноса заряда практически не происходит, и изменение мембранного потенциала минимально. Но «платить» за эти токи в любом случае приходится, несмотря на их «бесполезность» в этот период. Поэтому его продолжительность определяет, сколько энергетических ресурсов растрачивается впустую. Чем он короче, тем более эффективно использование энергии [20], [26], [30], [43]. Чем длиннее — тем менее эффективно. Как раз в двух вышеупомянутых типах нейронов, благодаря быстрым ионным каналам, этот период очень короткий, а ПД — самые эффективные [20].
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Чаще всего, химический синапс образован между окончанием аксона одного нейрона и дендритом другого. Его работа напоминает… «переброс» эстафетной палочки, роль которой и играет нейромедиатор — химический посредник передачи сигнала [12], [42], [44–48].
На пресинаптическом окончании аксона ПД вызывает выброс нейромедиатора во внеклеточную среду — к принимающему нейрону. Последний только этого и ждет с нетерпением: в мембране дендритов рецепторы — ионные каналы определенного типа — связывают нейромедиатор, открываются и пропускают через себя разные ионы. Это приводит к генерации маленького постсинаптического потенциала (ПСП) на мембране дендрита. Он напоминает ПД, но значительно меньше по амплитуде и происходит за счет открывания других каналов. Множество этих маленьких ПСП, каждый от своего синапса, «сбегаются» по мембране дендритов к телу нейрона (зеленые стрелки на рис. 3а) и достигают начального сегмента аксона, где вызывают открывание Na-каналов и «провоцируют» его на генерацию ПД.
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Как это ни странно, выброс нейромедиатора в синапсе может и не произойти вовсе — это процесс вероятностный [18], [19]. Нейроны так экономят энергию: синаптическая передача и так обусловливает около половины всех энергозатрат нейронов [25]. Если бы синапсы всегда срабатывали, вся энергия пошла бы на обеспечение их работы, и не осталось бы ресурсов для других процессов. Более того, именно низкая вероятность (20–40%) выброса нейромедиатора соответствует наибольшей энергетической эффективности синапсов. Отношение количества полезной информации к затрачиваемой энергии в этом случае максимально [18], [19]. Так, выходит, что «неудачи» играют важную роль в работе синапсов и, соответственно, всего мозга. А за передачу сигнала при иногда «не срабатывающих» синапсах можно не беспокоиться, так как между нейронами обычно много синапсов, и хоть один из них да сработает.
Еще одна особенность синаптической передачи состоит в разделении общего потока информации на отдельные компоненты по частоте модуляции приходящего сигнала (грубо говоря, частоте приходящих ПД) [50]. Это происходит благодаря комбинированию разных рецепторов на постсинаптической мембране [38], [50]. Некоторые рецепторы активируются очень быстро: например, AMPA-рецепторы (AMPA происходит от α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid). Если на постсинаптическом нейроне представлены только такие рецепторы, он может четко воспринимать высокочастотный сигнал (такой, как, например, на рис. 2в). Ярчайший пример — нейроны слуховой системы, участвующие в определении местоположения источника звука и точном распознавании коротких звуков типа щелчка, широко представленных в речи [12], [38], [51]. NMDA-рецепторы (NMDA — от N—methyl-D—aspartate) более медлительны. Они позволяют нейронам отбирать сигналы более низкой частоты (рис. 2г), а также воспринимать высокочастотную серию ПД как нечто единое — так называемое интегрирование синаптических сигналов [14]. Есть еще более медленные метаботропные рецепторы, которые при связывании нейромедиатора, передают сигнал на цепочку внутриклеточных «вторичных посредников» для подстройки самых разных клеточных процессов. К примеру, широко распространены рецепторы, ассоциированные с G-белками. В зависимости от типа они, например, регулируют количество каналов в мембране или напрямую модулируют их работу [14].
Различные комбинации быстрых AMPA-, более медленных NMDA- и метаботропных рецепторов позволяют нейронам отбирать и использовать наиболее полезную для них информацию, важную для их функционирования [50]. А «бесполезная» информация отсеивается, она не «воспринимается» нейроном. В таком случае не приходится тратить энергию на обработку ненужной информации. В этом и состоит еще одна сторона оптимизации синаптической передачи между нейронами.
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
При изучении патологий внимание уделяют и синаптической передаче как наиболее энергозатратному процессу [19]. Например, при болезнях Паркинсона [56], Хантингтона [57], Альцгеймера [58–61] происходит нарушение работы или транспорта к синапсам митохондрий, играющих основную роль в синтезе АТФ [62], [63]. В случае болезни Паркинсона, это может быть связано с нарушением работы и гибелью высоко энергозатратных нейронов черной субстанции, важной для регуляции моторных функций, тонуса мышц. При болезни Хантингтона, мутантный белок хангтингтин нарушает механизмы доставки новых митохондрий к синапсам, что приводит к «энергетическому голоданию» последних, повышенной уязвимости нейронов и избыточной активации. Все это может вызвать дальнейшие нарушения работы нейронов с последующей атрофией полосатого тела и коры головного мозга. При болезни Альцгеймера нарушение работы митохондрий (параллельно со снижением количества синапсов) происходит из-за отложения амилоидных бляшек. Действие последних на митохондрии приводит к окислительному стрессу, а также к апоптозу — клеточной гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Искренне благодарен моим родителям Ольге Наталевич и Александру Жукову, сестрам Любе и Алене, моему научному руководителю Алексею Браже и замечательным друзьям по лаборатории Эвелине Никельшпарг и Ольге Слатинской за поддержку и вдохновение, ценные замечания, сделанные при прочтении статьи. Я также очень благодарен редактору статьи Анне Петренко и главреду «Биомолекулы» Антону Чугунову за пометки, предложения и замечания.
Литература
- Прожорливый мозг;
- SEYMOUR S. KETY. (1957). THE GENERAL METABOLISM OF THE BRAIN IN VIVO. Metabolism of the Nervous System. 221-237;
- L. Sokoloff, M. Reivich, C. Kennedy, M. H. Des Rosiers, C. S. Patlak, et. al.. (1977). THE [14C]DEOXYGLUCOSE METHOD FOR THE MEASUREMENT OF LOCAL CEREBRAL GLUCOSE UTILIZATION: THEORY, PROCEDURE, AND NORMAL VALUES IN THE CONSCIOUS AND ANESTHETIZED ALBINO RAT. J Neurochem. 28, 897-916;
- Magistretti P.J. (2008). Brain energy metabolism. In Fundamental neuroscience // Ed by. Squire L.R., Berg D., Bloom F.E., du Lac S., Ghosh A., Spitzer N. San Diego: Academic Press, 2008. P. 271–297;
- Pierre J. Magistretti, Igor Allaman. (2015). A Cellular Perspective on Brain Energy Metabolism and Functional Imaging. Neuron. 86, 883-901;
- William B Levy, Robert A. Baxter. (1996). Energy Efficient Neural Codes. Neural Computation. 8, 531-543;
- Sharp P.E. and Green C. (1994). Spatial correlates of firing patterns of single cells in the subiculum of the freely moving rat. J. Neurosci. 14, 2339–2356;
- H. Hu, J. Gan, P. Jonas. (2014). Fast-spiking, parvalbumin+ GABAergic interneurons: From cellular design to microcircuit function. Science. 345, 1255263-1255263;
- Oliver Kann, Ismini E Papageorgiou, Andreas Draguhn. (2014). Highly Energized Inhibitory Interneurons are a Central Element for Information Processing in Cortical Networks. J Cereb Blood Flow Metab. 34, 1270-1282;
- David Attwell, Simon B. Laughlin. (2001). An Energy Budget for Signaling in the Grey Matter of the Brain. J Cereb Blood Flow Metab. 21, 1133-1145;
- Henry Markram, Maria Toledo-Rodriguez, Yun Wang, Anirudh Gupta, Gilad Silberberg, Caizhi Wu. (2004). Interneurons of the neocortical inhibitory system. Nat Rev Neurosci. 5, 793-807;
- Как происходит выделение нейромедиатора;
- От живого мозга к искусственному интеллекту;
- Kandel E.R., Schwartz J.H., Jessell T.M., Siegelbaum S.A., Hudspeth A.J. Principles of neural science (5th Edition). NY: McGraw-Hill Education / Medical, 2012. — 1760 p.;
- 12 методов в картинках: нейробиология;
- Oliver Kann. (2016). The interneuron energy hypothesis: Implications for brain disease. Neurobiology of Disease. 90, 75-85;
- H. B. Barlow. (1969). Trigger Features, Adaptation and Economy of Impulses. Information Processing in The Nervous System. 209-230;
- Levy W.B. and Baxter R.A. (2002). Energy-efficient neuronal computation via quantal synaptic failures. J. Neurosci. 22, 4746–4755;
- Julia J. Harris, Renaud Jolivet, David Attwell. (2012). Synaptic Energy Use and Supply. Neuron. 75, 762-777;
- Biswa Sengupta, Martin Stemmler, Simon B. Laughlin, Jeremy E. Niven. (2010). Action Potential Energy Efficiency Varies Among Neuron Types in Vertebrates and Invertebrates. PLoS Comput Biol. 6, e1000840;
- Simon B. Laughlin, Rob R. de Ruyter van Steveninck, John C. Anderson. (1998). Unknown title.. Nat. Neurosci.. 1, 36-41;
- S Laughlin. (2001). Energy as a constraint on the coding and processing of sensory information. Current Opinion in Neurobiology. 11, 475-480;
- J. E. Niven, S. B. Laughlin. (2008). Energy limitation as a selective pressure on the evolution of sensory systems. Journal of Experimental Biology. 211, 1792-1804;
- Jeremy E Niven. (2016). Neuronal energy consumption: biophysics, efficiency and evolution. Current Opinion in Neurobiology. 41, 129-135;
- Clare Howarth, Padraig Gleeson, David Attwell. (2012). Updated Energy Budgets for Neural Computation in the Neocortex and Cerebellum. J Cereb Blood Flow Metab. 32, 1222-1232;
- A. Hasenstaub, S. Otte, E. Callaway, T. J. Sejnowski. (2010). Metabolic cost as a unifying principle governing neuronal biophysics. Proceedings of the National Academy of Sciences. 107, 12329-12334;
- Abdelmalik Moujahid, Alicia D’Anjou, Manuel Graña. (2014). Energy demands of diverse spiking cells from the neocortex, hippocampus, and thalamus. Front. Comput. Neurosci.. 8;
- Bruce P. Bean. (2007). The action potential in mammalian central neurons. Nat Rev Neurosci. 8, 451-465;
- Izhikevich E.M. Dynamical systems in neuroscience: the geometry of excitability and bursting (computational neuroscience). The MIT Press, 2007. — 457 p.;
- Brett C. Carter, Bruce P. Bean. (2009). Sodium Entry during Action Potentials of Mammalian Neurons: Incomplete Inactivation and Reduced Metabolic Efficiency in Fast-Spiking Neurons. Neuron. 64, 898-909;
- Формирование мембранного потенциала покоя;
- Появление и эволюция клеточной мембраны;
- Липидный фундамент жизни;
- Alan Woodruff, Rafael Yuste. (2008). Of Mice and Men, and Chandeliers. PLoS Biol. 6, e243;
- György Buzsáki, Caroline Geisler, Darrell A. Henze, Xiao-Jing Wang. (2004). Interneuron Diversity series: Circuit complexity and axon wiring economy of cortical interneurons. Trends in Neurosciences. 27, 186-193;
- David Sterratt, Bruce Graham, Andrew Gillies, David Willshaw. (Unknown published date.). Introduction. Principles of Computational Modelling in Neuroscience. 1-12;
- B. C. Carter, B. P. Bean. (2011). Incomplete Inactivation and Rapid Recovery of Voltage-Dependent Sodium Channels During High-Frequency Firing in Cerebellar Purkinje Neurons. Journal of Neurophysiology. 105, 860-871;
- Камкин А.Г. и Каменский А.А. (2004). Фундаментальная и клиническая физиология. М.: «Академия», 2004. — 1073 с.;
- Hille B. (2001). Ion channels of excitable membranes. Sunderland: Sinauer Associates, 2001. — 814 p.;
- Brian D. Clark, Ethan M. Goldberg, Bernardo Rudy. (2009). Electrogenic Tuning of the Axon Initial Segment. Neuroscientist. 15, 651-668;
- Джаксон М.Б. Молекулярная и клеточная биофизика. М.: «БИНОМ», 2013. — 552 с.;
- Спокоен как GABA;
- P. Crotty. (2006). Metabolic Energy Cost of Action Potential Velocity. Journal of Neurophysiology. 96, 1237-1246;
- Дофаминовые болезни;
- Серотониновые сети;
- Тайны голубого пятна;
- Молекула здравого ума;
- Очень нервное возбуждение;
- György Buzsáki, Kai Kaila, Marcus Raichle. (2007). Inhibition and Brain Work. Neuron. 56, 771-783;
- David Attwell, Alasdair Gibb. (2005). Neuroenergetics and the kinetic design of excitatory synapses. Nat Rev Neurosci. 6, 841-849;
- Nace L. Golding, Donata Oertel. (2012). Synaptic integration in dendrites: exceptional need for speed. The Journal of Physiology. 590, 5563-5569;
- Ashish Raj, Yu-hsien Chen. (2011). The Wiring Economy Principle: Connectivity Determines Anatomy in the Human Brain. PLoS ONE. 6, e14832;
- B. L. Chen, D. H. Hall, D. B. Chklovskii. (2006). Wiring optimization can relate neuronal structure and function. Proceedings of the National Academy of Sciences. 103, 4723-4728;
- Dmitri B. Chklovskii, Thomas Schikorski, Charles F. Stevens. (2002). Wiring Optimization in Cortical Circuits. Neuron. 34, 341-347;
- Biswa Sengupta, Simon B. Laughlin, Jeremy E. Niven. (2013). Balanced Excitatory and Inhibitory Synaptic Currents Promote Efficient Coding and Metabolic Efficiency. PLoS Comput Biol. 9, e1003263;
- Болезнь Паркинсона: что изучать? как изучать?;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Болезнь Альцгеймера: ген, от которого я без ума;
- Альцгеймеровский нейротоксин: ядовиты не только фибриллы;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска;
- Болезни и изменения клеточного метаболизма;
- Сон и старение II: Чем отличается сон пожилых и больных от сна молодых и здоровых?;
- Adelbert Ames. (2000). CNS energy metabolism as related to function. Brain Research Reviews. 34, 42-68.