From Wikipedia, the free encyclopedia
In neuroscience, nerve conduction velocity (CV) is the speed at which an electrochemical impulse propagates down a neural pathway. Conduction velocities are affected by a wide array of factors, which include age, sex, and various medical conditions. Studies allow for better diagnoses of various neuropathies, especially demyelinating diseases as these conditions result in reduced or non-existent conduction velocities. CV is an important aspect of nerve conduction studies.
Normal conduction velocities[edit]
Ultimately, conduction velocities are specific to each individual and depend largely on an axon’s diameter and the degree to which that axon is myelinated, but the majority of ‘normal’ individuals fall within defined ranges.[1]
Nerve impulses are extremely slow compared to the speed of electricity, where the electric field can propagate with a speed on the order of 50–99% of the speed of light; however, it is very fast compared to the speed of blood flow, with some myelinated neurons conducting at speeds up to 120 m/s (432 km/h or 275 mph).
| Type | Erlanger–Gasser classification |
Diameter | Myelin | Conduction velocity | Associated muscle fibers |
|---|---|---|---|---|---|
| α | Aα | 13–20 μm | Yes | 50-60 m/s[2][3] | Extrafusal muscle fibers |
| γ | Aγ | 5–8 μm | Yes | 4–24 m/s [4][5] | Intrafusal muscle fibers |
Different sensory receptors are innervated by different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers, and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger–Gasser classification |
Diameter | Myelin | Conduction velocity | Associated sensory receptors |
|---|---|---|---|---|---|
| Ia | Aα | 13–20 μm | Yes | 80–120 m/s[6] | Responsible for proprioception |
| Ib | Aα | 13–20 μm | Yes | 80–120 m/s | Golgi tendon organ |
| II | Aβ | 6–12 μm | Yes | 33–75 m/s | Secondary receptors of muscle spindle All cutaneous mechanoreceptors |
| III | Aδ | 1–5 μm | Thin | 3–30 m/s | Free nerve endings of touch and pressure Nociceptors of neospinothalamic tract Cold thermoreceptors |
| IV | C | 0.2–1.5 μm | No | 0.5–2.0 m/s | Nociceptors of paleospinothalamic tract Warmth receptors |
| Type | Erlanger–Gasser classification |
Diameter | Myelin | Conduction velocity |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 μm | Yes | 3–15 m/s |
| postganglionic fibers | C | 0.2–1.5 μm | No | 0.5–2.0 m/s |
| Nerve | Conduction velocity[2][3] |
|---|---|
| Median sensory | 45–70 m/s |
| Median motor | 49–64 m/s |
| Ulnar sensory | 48–74 m/s |
| Ulnar motor | 49+ m/s |
| Peroneal motor | 44+ m/s |
| Tibial motor | 41+ m/s |
| Sural sensory | 46–64 m/s |
Normal impulses in peripheral nerves of the legs travel at 40–45 m/s, and those in peripheral nerves of the arms at 50–65 m/s.[7]
Largely generalized, normal conduction velocities for any given nerve will be in the range of 50–60 m/s.[8]
Testing methods[edit]
Nerve conduction studies[edit]
Nerve conduction velocity is just one of many measurements commonly made during a nerve conduction study (NCS). The purpose of these studies is to determine whether nerve damage is present and how severe that damage may be.
Nerve conduction studies are performed as follows:[8]
- Two electrodes are attached to the subject’s skin over the nerve being tested.
- Electrical impulses are sent through one electrode to stimulate the nerve.
- The second electrode records the impulse sent through the nerve as a result of stimulation.
- The time difference between stimulation from the first electrode and pick-up by the downstream electrode is known as the latency. Nerve conduction latencies are typically on the order of milliseconds.
Although conduction velocity itself is not directly measured, calculating conduction velocities from NCS measurements is trivial. The distance between the stimulating and receiving electrodes is divided by the impulse latency, resulting in conduction velocity.
NCV = conduction distance / (proximal latency-distal latency)
Many times, Needle EMG is also performed on subjects at the same time as other NCS procedures because they aid in detecting whether muscles are functioning properly in response to stimuli sent via their connecting nerves.[8] EMG is the most important component of electrodiagnosis of motor neuron diseases as it often leads to the identification of motor neuron involvement before clinical evidence can be seen.[9]
Micromachined 3D electrode arrays[edit]
Typically, the electrodes used in an EMG are stuck to the skin over a thin layer of gel/paste.[8] This allows for better conduction between electrode and skin. However, as these electrodes do not pierce the skin, there are impedances that result in erroneous readings, high noise levels, and low spatial resolution in readings.[10]
To address these problems, new devices are being developed, such as 3-dimensional electrode arrays. These are MEMS devices that consist of arrays of metal micro-towers capable of penetrating the outer layers of skin, thus reducing impedance.[10]
Compared with traditional wet electrodes, multi-electrode arrays offer the following:[10]
- Electrodes are about 1/10 the size of standard wet surface electrodes
- Arrays of electrodes can be created and scaled to cover areas of almost any size
- Reduced impedance
- Improved signal power
- Higher amplitude signals
- Allow better real-time nerve impulse tracking
Causes of conduction velocity deviations[edit]
Anthropometric and other individualized factors[edit]
Baseline nerve conduction measurements are different for everyone, as they are dependent upon the individual’s age, sex, local temperatures, and other anthropometric factors such as hand size and height.[2][11] It is important to understand the effect of these various factors on the normal values for nerve conduction measurements to aid in identifying abnormal nerve conduction study results. The ability to predict normal values in the context of an individual’s anthropometric characteristics increases the sensitivities and specificities of electrodiagnostic procedures.[2]
Age[edit]
Normal ‘adult’ values for conduction velocities are typically reached by age 4. Conduction velocities in newborns and toddlers tend to be about half the adult values.[1]
Nerve conduction studies performed on healthy adults revealed that age is negatively associated with the sensory amplitude measures of the Median, Ulnar, and Sural nerves. Negative associations were also found between age and the conduction velocities and latencies in the Median sensory, Median motor, and Ulnar sensory nerves. However, conduction velocity of the Sural nerve is not associated with age. In general, conduction velocities in the upper extremities decrease by about 1 m/s for every 10 years of age.[2]
Sex[edit]
Sural nerve conduction amplitude is significantly smaller in females than males, and the latency of impulses is longer in females, thus a slower conduction velocity.[2]
Other nerves have not been shown to exhibit any gender biases.[citation needed]
Temperature[edit]
In general, the conduction velocities of most motor and sensory nerves are positively and linearly associated with body temperature (low temperatures slow nerve conduction velocity and higher temperatures increase conduction velocity).[1]
Conduction velocities in the Sural nerve seem to exhibit an especially strong correlation with the local temperature of the nerve.[2]
Height[edit]
Conduction velocities in both the Median sensory and Ulnar sensory nerves are negatively related to an individual’s height, which likely accounts for the fact that, among most of the adult population, conduction velocities between the wrist and digits of an individual’s hand decrease by 0.5 m/s for each inch increase in height.[2] As a direct consequence, impulse latencies within the Median, Ulnar, and Sural nerves increases with height.[2]
The correlation between height and the amplitude of impulses in the sensory nerves is negative.[2]
Hand factors[edit]
Circumference of the index finger appears to be negatively associated with conduction amplitudes in the Median and Ulnar nerves. In addition, people with larger wrist ratios (anterior-posterior diameter : medial-lateral diameter) have lower Median nerve latencies and faster conduction velocities.[2]
Medical conditions[edit]
Myasthenia gravis[edit]
Amyotrophic lateral sclerosis (ALS)[edit]
Amyotrophic lateral sclerosis is a progressive and inevitably fatal neurodegenerative disease affecting the motor neurons.[9] Because ALS shares many symptoms with other neurodegenerative diseases, it can be difficult to diagnose properly. The best method of establishing a confident diagnosis is via electrodiagnostic evaluation. To be specific, motor nerve conduction studies of the Median, Ulnar, and peroneal muscles should be performed, as well as sensory nerve conduction studies of the Ulnar and Sural nerves.[9]
In patients with ALS, it has been shown that distal motor latencies and slowing of conduction velocity worsened as the severity of their muscle weakness increased. Both symptoms are consistent with the axonal degeneration occurring in ALS patients.[9]
Carpal tunnel syndrome[edit]
Carpal tunnel syndrome (CTS) is a form of nerve compression syndrome caused by the compression of the median nerve at the wrist. Typical symptoms include numbness, tingling, burning pains, or weakness in the hand.[12][13] CTS is another condition for which electrodiagnostic testing is valuable.[12][14] However, before subjecting a patient to nerve conduction studies, both Tinel’s test and Phalen’s test should be performed. If both results are negative, it is very unlikely that the patient has CTS, and further testing is unnecessary.[13]
Carpal tunnel syndrome presents in each individual to different extents. Measurements of nerve conduction velocity are critical to determining the degree of severity.[14][15]
These levels of severity are categorized as:[12][13]
- Mild CTS: Prolonged sensory latencies, very slight decrease in conduction velocity. No suspected axonal degeneration.
- Moderate CTS: Abnormal sensory conduction velocities and reduced motor conduction velocities. No suspected axonal degeneration.
- Severe CTS: Absence of sensory responses and prolonged motor latencies (reduced motor conduction velocities).
- Extreme CTS: Absence of both sensory and motor responses.
One common electrodiagnostic measurement includes the difference between sensory nerve conduction velocities in the pinkie finger and index finger. In most instances of CTS, symptoms will not present until this difference is greater than 8 m/s.[12][13]
Guillain–Barré syndrome[edit]
Guillain–Barré syndrome (GBS) is a peripheral neuropathy involving the degeneration of myelin sheathing and/or nerves that innervate the head, body, and limbs.[7] This degeneration is due to an autoimmune response typically initiated by various infections.
Two primary classifications exist: demyelinating (Schwann cell damage) and axonal (direct nerve fiber damage).[7][16] Each of these then branches into additional sub-classifications depending on the exact manifestation. In all cases, however, the condition results in weakness or paralysis of limbs, the potentially fatal paralysis of respiratory muscles, or a combination of these effects.[7]
The disease can progress very rapidly once symptoms present (severe damage can occur within as little as a day).[7] Because electrodiagnosis is one of the fastest and most direct methods of determining the presence of the illness and its proper classification, nerve conduction studies are extremely important.[16] Without proper electrodiagnostic assessment, GBS is commonly misdiagnosed as polio, West Nile virus, tick paralysis, various toxic neuropathies, CIDP, transverse myelitis, or hysterical paralysis.[7] Two sets of nerve conduction studies should allow for proper diagnosis of Guillain–Barré syndrome. It is recommended that these be performed within the first 2 weeks of symptom presentation and again sometime between 3 and 8 weeks.[16]
Electrodiagnostic findings that may implicate GBS include:[3][7][16]
- Complete conduction blocks
- Abnormal or absent F waves
- Attenuated compound muscle action potential amplitudes
- Prolonged motor neuron latencies
- Severely slowed conduction velocities (sometimes below 20 m/s)
Lambert–Eaton myasthenic syndrome[edit]
Lambert–Eaton myasthenic syndrome (LEMS) is an autoimmune disease in which auto-antibodies are directed against voltage-gated calcium channels at presynaptic nerve terminals. Here, the antibodies inhibit the release of neurotransmitters, resulting in muscle weakness and autonomic dysfunctions.[17]
Nerve conduction studies performed on the Ulnar motor and sensory, Median motor and sensory, Tibial motor, and Peroneal motor nerves in patients with LEMS have shown that the conduction velocity across these nerves is actually normal. However, the amplitudes of the compound motor action potentials may be reduced by up to 55%, and the duration of these action potentials decreased by up to 47%.[17]
Peripheral diabetic neuropathy[edit]
At least half the population with diabetes mellitus is also affected with diabetic neuropathy, causing numbness and weakness in the peripheral limbs.[18] Studies have shown that the Rho/Rho-kinase signaling pathway is more active in individuals with diabetes and that this signaling activity occurs mainly in the nodes of Ranvier and Schmidt-Lanterman incisures.[18] Therefore, over-activity of the Rho/Rho-kinase signaling pathway may inhibit nerve conduction.
Motor nerve conduction velocity studies revealed that conductance in diabetic rats was about 30% lower than that of the non-diabetic control group. In addition, activity along the Schmidt-Lanterman incisures was non-continuous and non-linear in the diabetic group, but linear and continuous in the control. These deficiencies were eliminated after the administration of Fasudil to the diabetic group, implying that it may be a potential treatment.[18]
See also[edit]
- Nerve conduction study
- Electrodiagnosis
- Electromyography
References[edit]
- ^ a b c «Nerve conduction velocity». National Institutes of Health. 31 October 2013. Retrieved 13 November 2013.
- ^ a b c d e f g h i j k Stetson, PhD, Diana S.; James W. Albers; Barbara A. Silverstein; Robert A. Wolfe (October 1992). «Effects of Age, Sex, and Anthropometric Factors on Nerve Conduction Measures» (PDF). Muscle & Nerve. 15 (10): 1095–1104. doi:10.1002/mus.880151007. hdl:2027.42/50152. PMID 1406766. S2CID 9508325.
- ^ a b c Sedano, Maria J.; Canga, Ana; Pablos, Carmen; Polo, Jose M.; Berciano, Jose (31 January 2013). «Muscle MRI in severe Guillain–Barré syndrome with motor nerve inexcitability». Journal of Neurology. 260 (6): 1624–1630. doi:10.1007/s00415-013-6845-y. PMID 23370612. S2CID 9763303.
- ^ Andrew BL, Part NJ (1972) Properties of fast and slow motor units in hind limb and tail muscles of the rat. Q J Exp Physiol Cogn Med Sci 57:213-225.
- ^ Russell NJ (1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». J Physiol. 298: 347–360. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Siegel, Allan; Sapru, Hreday (2005). Essential Neuroscience. p. 257. ISBN 978-0781750776.
- ^ a b c d e f g Parry, Gareth J. (2007). Guillain–Barré Syndrome. New York, NY: Demos Medical Publishing. pp. 1–9. ISBN 978-1-932603-56-9.
- ^ a b c d «Nerve Conduction Study (NCS)». Johns Hopkins Medicine. Retrieved 17 November 2013.
- ^ a b c d Joyce, Nanette C.; Carter, Gregory T. (May 2013). «Electrodiagnosis in Persons With Amyotrophic Lateral Sclerosis». PM&R. 5 (5, Supplement): S89–S95. doi:10.1016/j.pmrj.2013.03.020. PMC 4590769. PMID 23523708.
- ^ a b c Rajaraman, Swaminathan; Bragg, Julian A.; Ross, James D.; Allen, Mark G. (30 June 2011). «Micromachined three-dimensional electrode arrays for transcutaneous nerve tracking». Journal of Micromechanics and Microengineering. 21 (8): 085014. Bibcode:2011JMiMi..21h5014R. doi:10.1088/0960-1317/21/8/085014. S2CID 53482527.
- ^ Thanakiatpinyo, MD, Thanitta; Gulapar Srisawasdi (2013). «Effect of Hand Size on the Stimulation Intensities Required for Median and Ulnar Sensory Nerve Conduction Studies». Archives of Physical Medicine and Rehabilitation. 94 (5): 925–929. doi:10.1016/j.apmr.2012.11.029. PMID 23201426.
- ^ a b c d Werner, Robert A.; Andary, Michael (October 2011). «Electrodiagnostic evaluation of carpal tunnel syndrome» (PDF). Muscle & Nerve. 44 (4): 597–607. doi:10.1002/mus.22208. hdl:2027.42/87013. PMID 21922474. S2CID 18623599.
- ^ a b c d Ntani, Georgia; Palmer, Keith T.; Linaker, Cathy; Harris, E Clare; Van der Star, Richard; Cooper, Cyrus; Coggon, David (15 August 2013). «Symptoms, signs and nerve conduction velocities in patients with suspected carpal tunnel syndrome». BMC Musculoskeletal Disorders. 14 (1): 242. doi:10.1186/1471-2474-14-242. PMC 3765787. PMID 23947775.
- ^ a b Inukai, Tomoo; Uchida, Kenzo; Kubota, Chikara; Takamura, Takaharu; Nakajima, Hideaki; Baba, Hisatoshi (24 October 2013). «Second lumbrical-interossei nerve test predicts clinical severity and surgical outcome of carpal tunnel syndrome». Journal of Clinical Neuroscience. 20 (9): 1224–1227. doi:10.1016/j.pmrj.2013.04.007. PMID 23701980. S2CID 31973259.
- ^ Robinson, Lawrence, R.; Strakowski, Jeffrey; Kennedy, David J. (May 2013). «Is the Combined Sensory (Robinson) Index Routinely Indicated for All Cases of Suspected Carpal Tunnel Syndrome Undergoing Electrodiagnostic Evaluation?». PM&R. 5 (5): 433–437. doi:10.1016/j.pmrj.2013.04.007. PMID 23701980. S2CID 31973259.
- ^ a b c d Shahrizaila, Nortina; Goh, Khean Jin; Abdullah, Suhailah; Kuppusamy, Rishikesan; Yuki, Nobuhiro (8 February 2013). «Two sets of nerve conduction studies may suffice in reaching a reliable electrodiagnosis in Guillain–Barré syndrome». Clinical Neurophysiology. 124 (7): 1456–1459. doi:10.1016/j.clinph.2012.12.047. PMID 23395599. S2CID 33925550.
- ^ a b Crone, Clarissa; Christiansen, Ingelise; Vissing, John (3 May 2013). «Myopathic EMG findings and type II muscle fiber atrophy in patients with Lambert-Eaton myasthenic syndrome». Clinical Neurophysiology. 124 (9): 1889–1892. doi:10.1016/j.clinph.2013.02.115. PMID 23643575. S2CID 25526831.
- ^ a b c Kanazawa, Yasushi; Junko Takahashi-Fujigasaki; Sho Ishizawa; Naoko Takabayashi; Kumiko Ishibashi; Keiichiro Matoba; Daiji Kawanami; Tamotsu Yokota; Naoko Tajima; Kazunori Utsunomiya (September 2013). «The Rho-kinase inhibitor fasudil restores normal motor nerve conduction velocity in diabetic rats by assuring the proper localization of adhesion-related molecules in myelinating Schwann cells». Experimental Neurology. 247: 438–446. doi:10.1016/j.expneurol.2013.01.012. PMID 23337773. S2CID 3004517.
External links[edit]
- Virtual NCS training and other educational tools Archived 2016-03-12 at the Wayback Machine
-
Законы проведения возбуждения по нервным волокнам.
Механизм
проведения возбуждения по нервным
волокнам зависит от их типа. Существуют
два типа нервных волокон: миелиновые и
безмиелиновые.
Процессы
метаболизма в безмиелиновых волокнах
не обеспечивают быструю компенсацию
расхода энергии. Распространение
возбуждения будет идти с постепенным
затуханием – с декрементом. Декрементное
поведение возбуждения характерно для
низкоорганизованной нервной системы.
Возбуждение распространяется за счет
малых круговых токов, которые возникают
внутрь волокна или в окружающую его
жидкость. Между возбужденными и
невозбужденными участками возникает
разность потенциалов, которая способствует
возникновению круговых токов. Ток будет
распространяться от «+» заряда к «—».
В месте выхода кругового тока повышается
проницаемость плазматической мембраны
для ионов Na, в результате чего происходит
деполяризация мембраны. Между вновь
возбужденным участком и соседним
невозбужденным вновь возникает разность
потенциалов, что приводит к возникновению
круговых токов. Возбуждение постепенно
охватывает соседние участки осевого
цилиндра и так распространяется до
конца аксона.
В
миелиновых волокнах благодаря совершенству
метаболизма возбуждение проходит, не
затухая, без декремента. За счет большого
радиуса нервного волокна, обусловленного
миелиновой оболочкой, электрический
ток может входить и выходить из волокна
только в области перехвата. При нанесения
раздражения возникает деполяризация
в области перехвата А, соседний перехват
В в это время поляризован. Между
перехватами возникает разность
потенциалов, и появляются круговые
токи. За счет круговых токов возбуждаются
другие перехваты, при этом возбуждение
распространяется сальтаторно,
скачкообразно от одного перехвата к
другому. Сальтаторный способ распространения
возбуждения экономичен, и скорость
распространения возбуждения гораздо
выше (70—120 м/с), чем по безмиелиновым
нервным волокнам (0,5–2 м/с).
Существует
три закона проведения раздражения по
нервному волокну.
Закон
анатомо-физиологической целостности.
Проведение
импульсов по нервному волокну возможно
лишь в том случае, если не нарушена его
целостность. При нарушении физиологических
свойств нервного волокна путем охлаждения,
применения различных наркотических
средств, сдавливания, а также порезами
и повреждениями анатомической целостности
проведение нервного импульса по нему
будет невозможно.
Закон
изолированного проведения возбуждения.
Существует
ряд особенностей распространения
возбуждения в периферических, мякотных
и безмякотных нервных волокнах.
В
периферических нервных волокнах
возбуждение передается только вдоль
нервного волокна, но не передается на
соседние, которые находятся в одном и
том же нервном стволе.
В
мякотных нервных волокнах роль изолятора
выполняет миелиновая оболочка. За счет
миелина увеличивается удельное
сопротивление и происходит уменьшение
электрической емкости оболочки.
В
безмякотных нервных волокнах возбуждение
передается изолированно. Это объясняется
тем, что сопротивление жидкости, которая
заполняет межклеточные щели, значительно
ниже сопротивления мембраны нервных
волокон. Поэтому ток, возникающий между
деполяризованным участком и
неполяризованным, проходит по межклеточным
щелям и не заходит при этом в соседние
нервные волокна.
Закон
двустороннего проведения возбуждения.
Нервное
волокно проводит нервные импульсы в
двух направлениях – центростремительно
и центробежно.
В
живом организме возбуждение проводится
только в одном направлении. Двусторонняя
проводимость нервного волокна ограничена
в организме местом возникновения
импульса и клапанным свойством синапсов,
которое заключается в возможности
проведения возбуждения только в одном
направлении.
Закон
практической неутомляемости нервных
волокон (Н.Е. Введенский)
Нервное
волокно обладает малой утомляемостью
Это
обусловлено высокой скоростью ресинтеза
АТФ в волокне и высокой лабильностью
нервного волокна
Закон
прямой пропорциональной зависимости
скорости проведения импульса от диаметра
нервного волокна.
Закон
установлен лауреатами Нобелевской
премии Джозефом Эрлангером и Гербертом
Гассером.
На
основании этого закона они предложили
классификацию нервных волокон.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
398 просмотров17.10.2022Образование
0
князь чукотский (анонимный) 14.10.2022 0 комментариев
Выберите верные утверждения об аксоне:
Скорость проведения нервного импульса зависит от диаметра аксона
У некоторых аксонов могут быть миелиновые оболочки
Аксоны могут быть длиннее двух метров
Аксон — это длинный отросток нейрона
Наличие миелиновой оболочки повышает скорость проведения нервного импульса
князь чукотский 14.10.2022
Напишите свой ответ.
Регистрация или Вход
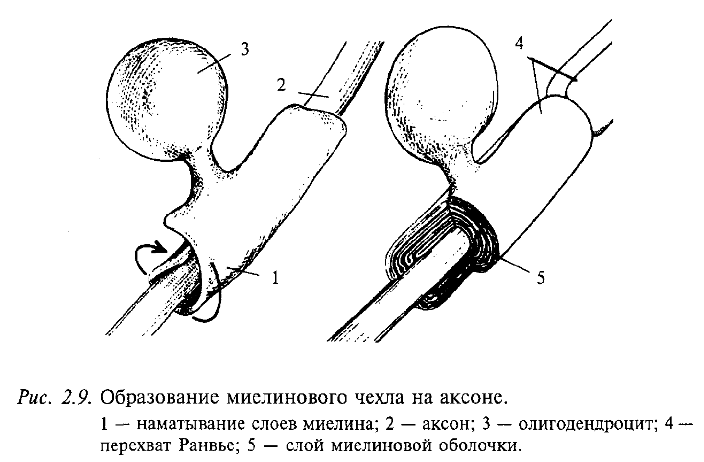
Возбуждение в виде потенциала действия покидает тело нейрона по его отростку, который называется аксоном. Аксоны отдельных нейронов обычно объединяются в пучки – нервы, а сами аксоны в этих пучках называются нервными волокнами. Природа позаботилась, чтобы волокна максимально хорошо справлялись с функцией проведения возбуждения в виде потенциалов действия. Для этой цели отдельные нервные волокна (аксоны отдельных нейронов) имеют специальные чехлы, выполненные из хорошего электрического изолятора (см. рис. 2.3). Чехол прерывается примерно через каждые 0,5-1,5 мм; это связано с тем, что отдельные участки чехла образуются в результате того, что специальные клетки в очень ранний период развития организма (в основном еще до рождения) обволакивают небольшие участки аксона. На рис. 2.9 показано, как это происходит. В периферических нервах миелин образуется клетками, которые получили название шванновских, а в головном мозге это происходит за счет клеток олигодендроглии.
Образование миелинового чехла на аксоне
Этот процесс называется миелинизацией, так как в результате образуется чехол из вещества миелина, примерно на 2/3 состоящего из жира и являющегося хорошим электрическим изолятором. Исследователи придают очень большое значение процессу миелинизации в развитии мозга.
Известно, что у новорожденного ребенка миелинизировано примерно 2/3 волокон головного мозга. Примерно к 12 годам завершается следующий этап миелинизации. Это соответствует тому, что у ребенка уже формируется функция внимания, он достаточно хорошо владеет собой. Вместе с тем полностью процесс миелинизации заканчивается только при завершении полового созревания. Таким образом, процесс миелинизации является показателем созревания ряда психических функций. В то же время известны заболевания нервной системы человека, которые связаны с демиелинизацией нервных волокон, что сопровождается тяжелыми страданиями. К самым известным относится рассеянный склероз. Это заболевание развивается незаметно и очень медленно, последствием является паралич движения.
Почему же так важна миелинизация нервных волокон? Оказывается, миелинизированные волокна в сотни раз быстрее проводят возбуждение, чем немиелинизированные, т. е. нейронные сети нашего мозга могут работать с большей скоростью, а значит, более эффективно. Поэтому не миелинизируются в нашем организме только самые тонкие волокна (менее 1 мкм в диаметре), которые проводят возбуждение к медленно работающим органам кишечнику, мочевому пузырю и др. Как правило, не миелинизируются волокна, проводящие информацию о боли и температуре.
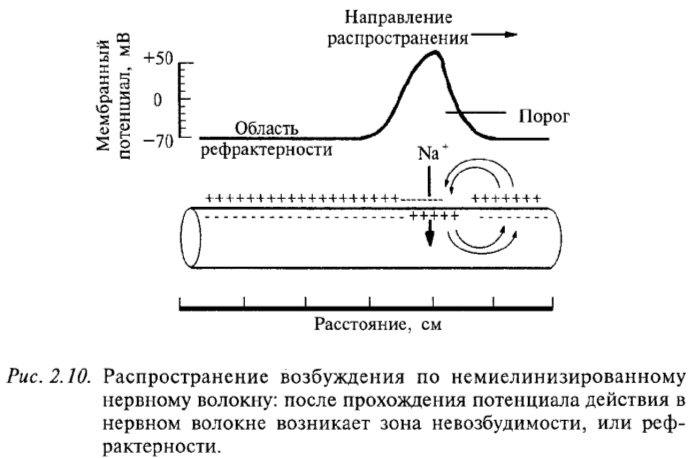
Распространение возбуждения по немиелинизированному нервному волокну: после прохождения потенциала действия в нервном волокне возникает зона невозбудимости, или рефрактерности
Как происходит распространение возбуждения по нервному волокну? Вначале разберем случай немиелинизированного нервного волокна. На рис. 2.10 показана схема нервного волокна. Возбужденный участок аксона характеризуется тем, что мембрана, обращенная к аксоплазме, заряжается положительно относительно экстраклеточной среды. Невозбужденные (покоящиеся) участки мембраны волокна отрицательны внутри. Между возбужденным и невозбужденным участками мембраны возникает разность потенциалов и начинает протекать ток. На рисунке это отражено линиями тока, пересекающими мембрану со стороны аксоплазмы,-выходящий ток, который деполяризует соседний невозбужденный участок волокна. Возбуждение движется по волокну только в одном направлении (показано стрелкой) и не может пойти в другую сторону, так как после возбуждения участка волокна в нем наступает рефрактерность – зона невозбудимости. Нам уже известно, что деполяризация приводит к открыванию потенциалзависимых натриевых каналов и в соседнем участке мембраны развивается потенциал действия. Затем натриевый канал инактивируется и закрывается, что и приводит к зоне невозбудимости волокна. Эта последовательность событий повторяется для каждого соседнего участка волокна. На каждое такое возбуждение тратится определенное время. Специальные исследования показали, что скорость проведения возбуждения немиелинизированных волокон пропорциональна их диаметру: чем больше диаметр, тем выше скорость движения импульсов. Например, немиелинизированные волокна, проводящие возбуждение со скоростью 100 – 120 м/с, должны иметь диаметр около 1000 мкм (1 мм).
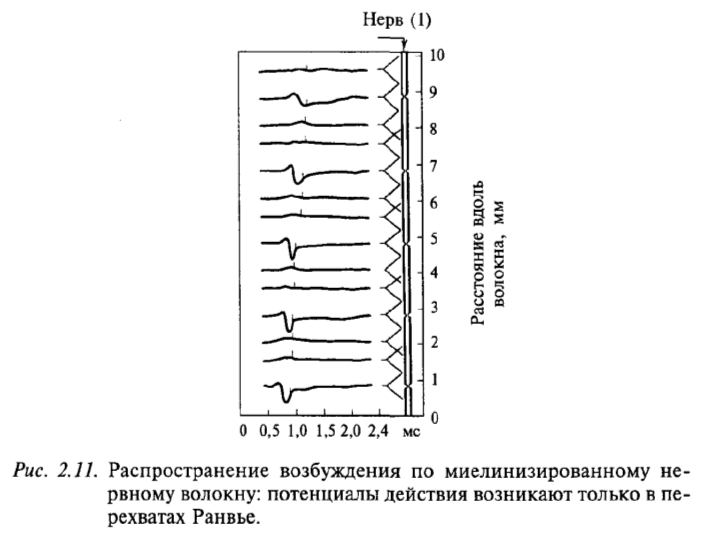
У млекопитающих животных природа сохранила немиелинизированными только те возбуждение о боли, температуре, управляют медленно работающими внутренними органами мочевым волокна, которые проводят органами – мочевым пузырем, кишечником и пр. Практически все нервные волокна в центральной нервной системе человека имеют миелиновые чехлы. На рис. 2.11 показано, что если вдоль волокна, покрытого миелином, регистрировать прохождение возбуждения, то потенциал действия возникает только в перехватах Ранвье. Оказывается, миелин, являясь хорошим электрическим изолятором, не пропускает выхода линий тока от предшествующего возбужденного участка. Выход тока в этом случае возможен только через те участки мембраны, которые находятся на стыке между двумя участками миелина. Напомним, что каждый участок образован только одной клеткой, поэтому это стыки между двумя клетками, образующими соседние участки миелиновой оболочки. Мембрана аксона между двумя соседними миелиновыми чехлами оказывается не покрытой миелином (так называемый перехват Ранвье). Благодаря такому устройству мембрана волокна возбуждается только в местах перехватов Ранвье. Вследствие этого потенциал действия (возбуждение) как бы перескакивает через участки изолированной мембраны. Другими словами, возбуждение движется скачками от перехвата к перехвату. Это похоже на те волшебные сапоги-скороходы, которые надевал кот в известной сказке, мгновенно переносясь из одного места в другое.
Распространение возбуждения по немиелинизированному нервному волокну: потенциалы действия возникают только в перехватах Ранвье